

所属成套资源:2023-2024学年八年级科学下学期课后培优分级练(浙教版)
八下期中复习——填空题(第二章)-2022-2023学年八年级科学下学期课后培优分级练(浙教版)
展开
这是一份八下期中复习——填空题(第二章)-2022-2023学年八年级科学下学期课后培优分级练(浙教版),共24页。试卷主要包含了回答下列问题,上海建成了我国第一条磁悬浮铁路等内容,欢迎下载使用。
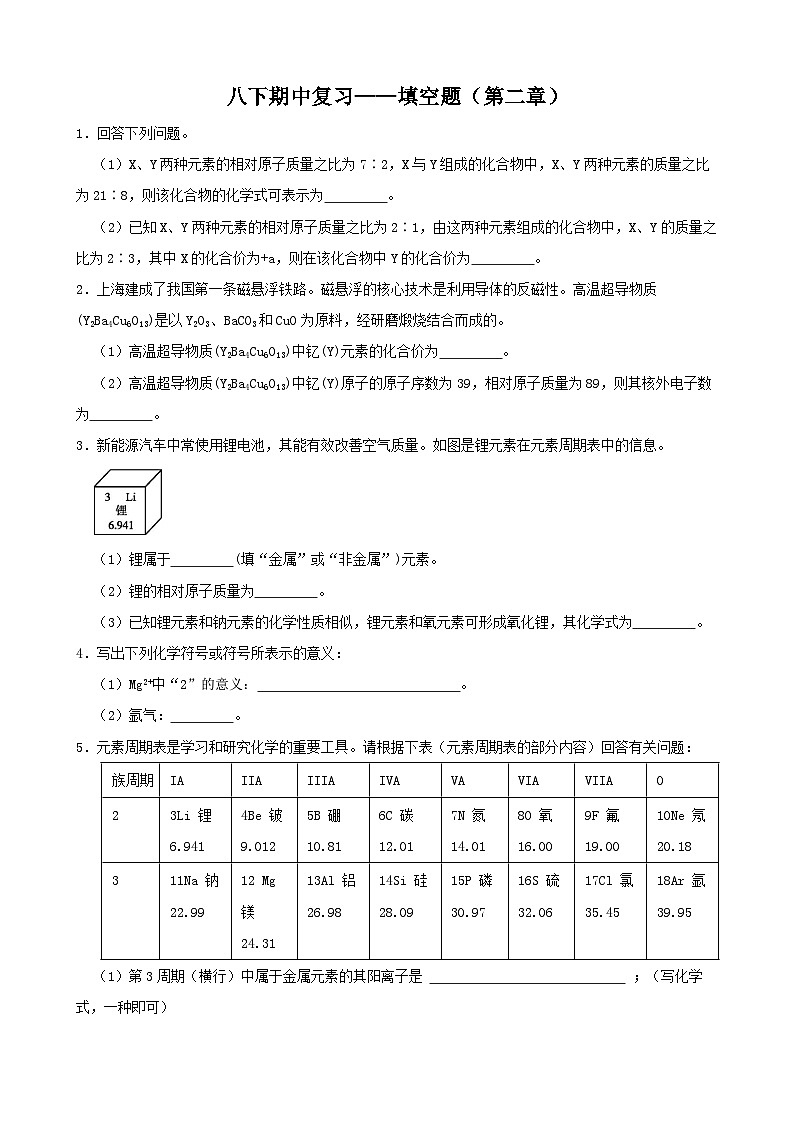
(1)X、Y两种元素的相对原子质量之比为7∶2,X与Y组成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为 。
(2)已知X、Y两种元素的相对原子质量之比为2∶1,由这两种元素组成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a,则在该化合物中Y的化合价为 。
2.上海建成了我国第一条磁悬浮铁路。磁悬浮的核心技术是利用导体的反磁性。高温超导物质(Y2Ba4Cu6O13)是以Y2O3、BaCO3和CuO为原料,经研磨煅烧结合而成的。
(1)高温超导物质(Y2Ba4Cu6O13)中钇(Y)元素的化合价为 。
(2)高温超导物质(Y2Ba4Cu6O13)中钇(Y)原子的原子序数为39,相对原子质量为89,则其核外电子数为 。
3.新能源汽车中常使用锂电池,其能有效改善空气质量。如图是锂元素在元素周期表中的信息。
(1)锂属于 (填“金属”或“非金属”)元素。
(2)锂的相对原子质量为 。
(3)已知锂元素和钠元素的化学性质相似,锂元素和氧元素可形成氧化锂,其化学式为 。
4.写出下列化学符号或符号所表示的意义:
(1)Mg2+中“2”的意义: 。
(2)氩气: 。
5.元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
(1)第3周期(横行)中属于金属元素的其阳离子是 ;(写化学式,一种即可)
(2)第13号元素与第17号元素组成的化合物是 ; (写化学式)
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是 (填标号)。
a.C和Ne b.B和Mg c.Al和Si d.F和Cl
6.用元素符号或化学式表示下列物质或微粒:
2 个亚铁离子 ;5 个甲烷分子 ;3 个氖原子 ;保持氧气化学性质的最小粒子 ;氯化铜中铜元素的化合价为+2 价 ; SO42− 中“2”的意义 。
7.某物质的分子式为 HnRO2n-1,它的相对分子质量是 m,则 R 元素的相对原子质量是 ,R 的化合价为 。
8.
(1)地壳中含量最多的金属元素与非金属元素形成的物质的化学式为 。
(2)元素X的原子获得2个电子,元素Y的原子失去1个电子后,所形成离子的所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物(具体物质)的化学式为 。
(3)相同质量的 H2O2 和 H2O 中氢元素的质量比为 。
(4)甲乙两种化合物都是由XY两种元素组成的,甲物质中X与Y元素的质量比为7:16,乙物质中X与Y元素的质量比为7:20,若甲的化学式为XY2,则乙的化学式为 。
9.某同学测得海水中含有Cl﹣的质量分数为 3.55%,如果其中的Cl﹣全部以 NaCl 计算,则海水中所含 NaCl的质量分数是 。
10.下表列出的是l~18号元素的部分最高正化合价和最低负化合价。请阅读并回答下列问题:
(1)14号元素属于 元素(填“金属”或“非金属”)。
(2)推测16号元素S最低负化合价为 ,+4价的S元素只与氧元素化合,形成的化合物的化学式为 。
(3)写出11号元素的单质在17号元素的单质中点燃后观察到的实验现象: 。(写1点即可)
11.用化学用语填空:①氯气 ;②保持二氧化氮的化学性质的最小微粒 ;③碳酸根离子 ;④硝酸铵 ;⑤氯化铁中铁的化合价为+3价 ;⑥地壳中含量最多的金属元素 。
12.写出符合要求的符号、意义:
(1)硝酸铜中铜元素的化合价为+2价: ;
(2)4个亚铁离子: ;
(3)高锰酸钾(KMnO4)含有 种元素;
(4)O3中“3”的意义 ;
(5)地壳中含量最多的金属元素和硫酸根组成的化合物的化学式: ;
(6)某元素原子 A 的质子数为a,已知 B2+和 A3-具有相同的核外电子数,则 B 元素的质子数为 。
13.CeCu2Si2是一种高温超导材料,其中铜元素化合价为+2价,硅元素为-4价,则铈(Ce)元素化合价为 ,已知一个碳原子(碳—12)的质量是m,一个铈(Ce)原子的质量是n,则铈(Ce)原子的相对原子质量是 。
14.写出下列符号中2表示的意义。
(1)SO42− :
(2)MgO+2 :
(3)O2:
(4)2H:
15.某元素R的原子序数为m,能够形成Rn-离子,则该离子核外有 个电子。该元素还可以和氢元素,氧元素所组成的化合物H2RO4,则R的化合价为 如果这种化合物的相对分子质量为98,则R的相对原子质量是
16.人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)卢瑟福核式结构模型是利用α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (选填序号)。
(2)从原子结构模型建立的过程中,我们发现 (选填序号) 。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
17.一瓶未贴标签粉末状常见金属R,为了测定R的相对原子质量,准确称取一定量金属粉末,在坩埚内加强热使其完全氧化,冷却后再称重,重复试验,获得如表数据。请回答:
(1)处理数据,取平均值,表格中m= 。
(2)该金属氧化物中,R元素和氧元素的质量比为 。
(3)已知R的化合价为+3价,则R的相对原子质量为 。
18.已知一个SO2 分子的质量为a克,一个SO3分子的质量为b克,若以一个硫原子质量的1/32作为相对原子质量的标准,则SO2的相对分子质量为
19.化合价为+3 价的金属R元素与氧元素形成的化合物中氧元素的质量分数为30%,则化合物的相对分子质量是 ,R元素的相对原子质量是 。
20.用适当的化学符号填空或写出题目中数字的意义
(1)3个一氧化碳分子:
(2)2Fe中数字“2”的意义:
(3)硫酸钠:
(4)Mg2+中数字“2”的意义:
21.下列分别盛有不同物质的容器中,所盛物质属于混合物的是 ,属于化合物的是 (均填容器下的字母)。若E杯中H2O2和H2O所含的氧元素的质量相等,则H2O2和H2O的质量比为 ,A瓶中保持液氧化学性质的最小微粒是
22.氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答:
(1)原子结构模型中的“〇”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是 吨。
23.用化学用语表示:
(1)2个钙原子
(2)液态氢
(3)三个硫酸根离子
24.元素周期表将已知元素科学有序的排列起来,便于研究它们的性质和用途。据表回答问题:
(1)写出由表格中③④两种元素组成的化合物的化学式 。
(2)在①②③④四种元素中,化学性质相似的是 。(用序号①②③④表示)
(3)113号元素的部分信息如右上图所示,则该元素是 元素。(选填“金属”或“非金属”)
25.下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
(1)表中的元素共有 种。
(2)属于阳离子的是 (填字母)。
(3)与A互为同位素原子的是 。
26.用化学用语填空:
(1)氩气 ;
(2)4 个二氧化硫分子 ;
(3)2 个氢氧根离子 ;
(4)空气中含量最多的物质
(5)保持水的化学性质的最小微粒 ;
27.1.6g某物质在氧气中燃烧,生成4.4g二氧化碳和3.6g水,则①一定含有C、H元素;②一定不含有O元素;③可能含有氧元素;④一定含有O元素;其中正确的是 。分子中C、H原子的个数比为 。
28.写出下列化学用语中数字“2”的意义。
(1)2H: 。
(2)H2: 。
29.水是生命之源,是生物生存所必须的最基本条件之一。
(1)明矾可用于制水,其原理是明矾溶于水形成氢氧化铝,从而吸附水中杂质,写出氢氧化铝的化学式 。
(2)火星上存在针铁矿,化学式为FeO(OH)。FeO(OH)中铁元素的化合价为 价。
30.请用化学用语表示:
(1)保持二氧化碳化学性质的最小微粒: 。
(2)带两个单位正电荷的镁离子: 。
31.2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:
(1)131I原子中含有53个质子,78个中子。131I原子的核外电子数是 。
(2)自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子
数为 。
32.某原子A的质子数为a,若B3+和A2-具有相同的核外电子数,则B元素的质子数 。
33.碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色(提示:碘分子能使馒头中的淀粉变蓝色);
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头 (选填“会”或“不会”)变蓝色。
(2)由上述三个实验可知,分子是 。
(3)现在市场上买来的食盐都是加碘盐(含有KIO3),用馒头蘸取少量的食盐水,馒头 (选填“会”或“不会”)变蓝色。
34.用元素符号或化学式表示下列物质或微粒:
(1)2个铁原子 ;
(2)m个碳酸根离子 ;
(3)5个二氧化碳分子 ;
(4)保持水的化学性质的最小微粒 ;
35.由元素R和氢元素、氧元素所组成的化合物为H2RO4,则R的化合价为 ;如果这化合物的相对分子质量为98,则R的相对原子质量为 ;该元素原子中有16个中子,该元素的元素符号为 。
36.由MgS、MgSO3、NaHSO4组成的混合物中,硫元素的质量分数为a,则氧元素的质量分数为 。
37.请用化学符号填空
(1)空气中含量多且常用作保护气的是 ;
(2)3 个硝酸根离子: ;
(3)地壳中含量最多的元素和含量最多的金属元素所形成的化合物是 ;
(4)氧化铜中铜元素的化合价为+2: 。
38.为了便于研究元素的性质,科学家把所有的已知元素科学有序地排列起来,得到元素周期表。请阅读下列元素周期表(部分),并按要求作答。
(1)图中位于第 3周期、ⅦA 族的元素所形成的单质化学式为 ;
(2)表中 3 至 10 号元素位于第二周期,11 至 18 号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同;
(3)第 11 号元素与第 17 号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 (填具体微粒的名称);
(4)表中不同种元素最本质的区别是 。
39.用适当的化学符号表示:
(1)氧原子 ;
(2)氧分子 ;
(3)氧离子 ;
(4)2个氧原子 ;
(5)氧化铝 ;
(6)二氧化碳 ;
40.为应对新冠疫情,我国开放了全民疫苗免费接种。下图为某品牌新冠疫苗包装盒,该新冠疫苗制剂属于 (纯净物或混合物),该疫苗填充剂有 种元素组成。
41.2021年7月23日至8月8日,东京奥运会引起了全球人民的热烈关注。比赛期间,运动员一旦受伤,医生会对着受伤部位喷射一种叫做氯乙烷(C2H5Cl)的药液,该药液会在皮肤表面迅速汽化,使受伤部位表层骤然变冷而暂时失去痛觉。
(1)氯乙烷中各元素的质量分数模型如图所示,图中甲表示的元素是 。
(2)下列关于氯乙烷说法正确的有 。(可多选)
A.氯乙烷的相对分子质量是64.5
B.氯乙烷由2个碳原子、5个氢原子、一个氯原子构成
C.氯乙烷由碳元素、氢元素、氯元素组成
D.一个氯乙烷分子中碳原子和氢原子的个数比为2:5
42.写出下列的化学符号或意义:
(1)氦气的化学式
(2)2H
43.模型可以反映客观现象,简单明了地表示事物。
(1)提起压在容器中水面上方的活塞,容器中的水发生汽化,如下图所示。则右下图中最能表示水汽化后在相同空间内粒子分布的是 (从A,B,C,D中选一个)并说出理由 。
(2)某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化铁等化合物,经测定各元素质量分数的模型如图甲。由此可推测,该样品中不可能含有的化合物是 。
(3)图乙是小明同学模仿甲图构建的尿素[CO(NH2)2]中各元素质量分数的模型,则图中的A表示的是 元素。
44.我国用新技术提纯了稀有金属铼Re,为航空航天发动机的制造提供了重要原料。
(1)铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为 。
(2)高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中钠、氧元素质量比为 。
45.氮元素和氧元素可以组成很多物质,如氧气、氮气、硝酸(HNO3)等。
(1)氧气和氮气在化学性质上有很大不同,是因为构成它们的 不同。
(2)氧元素和氮元素的最根本区别是 不同。
A.元素符号
B.原子中的中子数
C.原子中的质子数
D.相对原子质量
(3)氮元素的化合价有-3,+1,+2,+3,+4,+5价等,则+5 价的氮元素与氧元素形成化合物的化学式为 。
46.下图是元素周期表的一部分。根据图片信息可以知道:
(1)氧元素在图乙中的 位置(填写图乙中的序号)。
(2)氧元素可以与图乙中的元素⑥组成多种物质,请写出其中一种物质的化学式
47.近期,我国科学家合成了一种高密度原子级金属铂和碳化钼组成的界面催化结构,使利用水煤气(成分为一氧化碳和水蒸气)制取氢气变得更高效。其反应模型如下:
(1)反应过程中,金属铂选择性吸附的分子是水煤气中的 。
(2)根据模型,写出该反应的化学方程式 。
48.m 个 N2O3 分子和 n 个 N2O5 分子中所含氧元素的质量比是 ;若一个 N2O3 分子的质量为 a 千克,一个 N2O5 分子的质量为 b 千克,以氧原子质量的 116 作为标准,则 N2O3 的相对分子质量为 。
49.2019年1月3日,嫦娥四号着陆器成功实现了人类在月球背面的首次软着陆,为人类探索月球打开了新的篇章。
(1)月球土壤中存在天然的铁、钛等多种金属矿物,工业上常利用钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)冶炼金属钛,FeTiO3中Ti元素的化合价是 。
(2)月球表面温度最低时可达零下200℃,最高可超过100℃。嫦娥四号探头等设备中专配有低温多层隔热组件,这些部件在受热和散热时温度变化较小,可使设备运行温度维持在正常范围内,由此可知该组件一个重要的物理性质是 。
50.相同分子数目的SO2和SO3中氧元的质量比为 ,等质量的CO2和CO中氧元素的质量比 。
答案解析
1.【答案】(1)X3Y4
(2)−a3
【解答】(1)X、Y两元素的相对原子质量之比为7:2,X与Y形成的化合物中,X、Y两元素的质量之比为21:8,
化合物中X、Y的原子个数比为:217:82=3:4.
则该化合物的化学式可表示为 X3Y4。
(2)已知X、Y两元素的相对原子质量之比是2:1,
由这两种元素形成的化合物中,X、Y的质量之比是2:3,
化合物中X、Y的原子个数比为22:31=1:3;
化合物的化学式可表示为 XY3.其中X的化合价为+a。
根据化合物中正负化合价的代数和为零,
可得在化合物中Y的化合价为a3。
2.【答案】(1)+3
(2)39
【解答】(1)在 (Y2Ba4Cu6O13 中,Ba的化合价为+2,Cu的化合价为+2,O的化合价为+2,根据正负化合价代数和为零得到:2x+(+2)×4+(+2)×6+(-2)×13=0,解得:x=+3.
(2)根据“核外电子数=原子序数”可知,它的核外电子数为39。
3.【答案】(1)金属
(2)6.941
(3)Li2O
【解答】(1)因为“锂”中含有金字旁,因此为金属元素;
(2)根据图片可知,锂的相对原子质量为6.941;
(3)锂元素的化合物为+1,氧元素的化合价为-2,则氧化锂的化学式为:Li2O。
4.【答案】(1)1个镁离子带2个单位正电荷
(2)Ar
【解答】(1)Mg2+中“2”的意义:1个镁离子带2个单位正电荷。
(2)氩气为稀有气体,符号为Ar。
5.【答案】(1)Na+(其他答案合理也可以)
(2)AlCl3
(3)d
【解答】(1)根据表格可知,第3周期中属于金属元素的是钠、镁和铝,它们的最外层电子数依次为1、2、3,则生成阳离子分别为:Na+,Mg2+,Al3+。
(2)第13号元素为Al,第17号元素为Cl,则组成的化合物的化学式为:AlCl3。
(3)在元素周期表中,同一列为一族,具有相同的化学性质。观察可知,只有F和Cl在同一族,故选d。
6.【答案】2Fe2+;5CH4 ;3Ne;O2;Cu+2Cl2;一个硫酸根离子带2个单位的负电荷
【解答】(1)亚铁离子带两个单位的正电荷,即在铁的元素符号右上角写2+,而2 个亚铁离子,即在前面写数字2,写作: 2Fe2+ ;
(2)甲烷分子由1个碳原子和4个氢原子构成,在前面写5表示分子个数,写作: 5CH4 ;
(3)氢原子用元素符号H表示,在前面写3表示氢原子个数,即3H;
(4)保持氧气化学性质的最小粒子是氧分子,由两个氧原子构成,写作:O2;
(5)氯化铜中铜元素的化合价为+2 价,即在铜的元素符号正上方写“+2”,写作: Cu+2Cl2 ;
(6) SO42− 中“2”的含义:一个硫酸根离子带2个单位的负电荷。
7.【答案】m-33n+16;+(3n-2)
【解答】(1)根据化学式 HnRO2n-1 可知,该物质的相对分子质量:m=1×n+x+16×(2n-1),解得:x=m-33n+16;
(2)在HnRO2n-1中,H的化合价为+1,O的化合价为-2,根据正负化合价代数和为零得到:(+1)×n+y+(-2)×(2n-1)=0,解得:y=+(3n-2)。
8.【答案】(1)Al2O3
(2)Na2O
(3)9:17
(4)X2Y5
【解答】(1)地壳中含量最多的金属元素是铝,非金属元素是氧,二者组成的物质为三氧化二铝,化学式为: Al2O3 ;
(2)氖原子的质子数为10,根据“核外电子数=质子数”可知,它的核外电子数为10。那么X元素的核外电子数为:10-2=8,即质子数为8,那么X为O元素。Y元素的核外电子数为:10+1=11,即质子数为11,则Y为Na。X与Y形成的物质为氧化钠,写作:Na2O;
(3)设二者的质量都是m,
则H2O2和H2O中氢元素的质量之比为:m×22+32;(m×22+16)=9:17.
(4)甲的化学式为XY2,二者的质量比为:7:16,则X与Y的相对原子质量之比为:71:162=7:8;
乙中X与Y元素的质量比为:7:20,
则其中X与Y的原子个数比为:77:208=2:5,
则乙的化学式为:X2O5。
9.【答案】5.85%
【解答】设海水的质量为m,则氯的质量为:3.55%m;
海水中氯化钠的质量为:3.55%m÷35.523+35.5=5.85%m;
则海水中氯化钠的质量分数为:5.85%mm=5.85%。
10.【答案】(1)非金属
(2)-2;SO2
(3)有白烟生成
【解答】(1)14号元素为Si,名字为硅,不含金子旁,为非金属元素;
(2)16号元素的原子的最外层电子为6,达到8个电子的稳定状态,需要得到2个电子,因此最低化合价为-2。设化学式为SxOy,根据正负化合价代数和为零得到:(+4)x+(-2)y=0,解得:x:y=1:2,则化学式为:SO2。
(3)11号元素为Na,17号元素为Cl,钠在氯气中燃烧生成氯化钠,现象为:有白烟生成。
11.【答案】Cl2;NO2;CO32-;NH4NO3;FeCl3;Al
【解答】①氯气的分子由两个氯原子构成,写作:Cl2;
②保持二氧化氮的化学性质的最小微粒为二氧化氮分子,由1个氮原子和2个氧原子构成,写作:NO2;
③碳酸根离子带两个单位的负电荷,写作: CO32- ;
④硝酸铵分子,由1个铵根离子和1个硝酸根离子构成,写作: NH4NO3 ;
⑤氯化铁中的铁元素化合价为+3价,即在铁的元素符号上面写+3,即:Fe+3Cl3;
⑥地壳中含量最多的金属元素为铝,写作Al。
12.【答案】(1)Cu+2(NO3)2
(2)4Fe2+
(3)3
(4)一(每)个臭氧分子中含有三个氧原子
(5)Al2(SO4)3
(6)a+5
【解答】(1)硝酸铜中铜元素的化合价为+2价写作: Cu+2(NO3)2 ;
(2)亚铁离子带两个单位的正电荷,则4个亚铁离子写作:4Fe2+;
(3)高锰酸钾(KMnO4)含有K、Mn、O共3种元素;
(4)O3中“3”的意义:一(每)个臭氧分子中含有三个氧原子;
(5)地壳中含量最多的金属元素是Al。和硫酸根组成的化合物为硫酸铝,化学式为:Al2(SO4)3。
(6)原子失去电子带正电荷,得到电子带负电荷,
那么得到:x-2=a+3;
解得:x=a+5。
13.【答案】+4;12n/m
【解答】(1)在化学式 CeCu2Si2 中,铜元素化合价为+2价,硅元素为-4价,根据正负化合价代数和为零得到:x+(+2)×2+(-4)×2=0,解得:x=+4;
(2)相对原子质量是原子的实际质量与碳原子质量的1/12的比值,
则铈(Ce)原子的相对原子质量是 :nm12=12nm。
14.【答案】(1)一个硫酸根离子带两个单位负电荷
(2)氧化镁中镁元素的化合价为+2价
(3)一个氧分子中有两个氧原子
(4)2个氢原子
【解答】(1) SO42−的数字“2”表示:一个硫酸根离子带两个单位负电荷;
(2) MgO+2 的数字“2”表示:氧化镁中镁元素的化合价为+2价;
(3) O2 中的数字“2”表示:一个氧分子中有两个氧原子;
(4)2H中的数字“2”表示:2个氢原子。
15.【答案】m+n;+6;32
【解答】(1)某元素R的原子序数为m,根据“核外电子数=质子数=原子序数”可知,该原子的核外电子数为m。Rn-离子是原子得到n个电子形成的,那么此时离子核外电子数为:m+n。
(2)在化学式 H2RO4 中,H的化合价为+1,O的化合价为-2,根据正负化合价代数和为零得到:(+1)×2+x+(-2)×4=0,解得:x=+6。
(3)这种化合物的相对分子质量为98,那么得到:98=1×2+y+16×4,解得:y=32。
16.【答案】(1)乙
(2)A;B;D
【解答】(1)原子中心为原子核,带正电荷,质量很大但体积很小。α粒子也带正电荷,当它们靠近原子核时,会受到排斥力而改变运动方向,且距离越近,受到的排斥力越大,运动轨迹改变的幅度越大。少数α粒子的运动轨迹几乎会偏转180°,故选乙。
(2)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识到达新的高度,但是远没有大的完美的境地,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
17.【答案】(1)85.0
(2)9:8
(3)27
【解答】(1)根据表格可知,m=84.9g+85.1g+85g3=85g;
(2)该金属氧化物中,R元素和氧元素的质量比为:45g:(85g-45g)=9:8;
(3)O的化合价为-3价,R的化合价为+3价,根据正负化合价代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3,则氧化物的化学式为R2O3。
设R的相对原子质量为z,那么二者的质量之比:98=2z3×16;
解得:z=27。
18.【答案】32a/(3a-2b)
【解答】比较可知,一个氧原子的质量为:b-a;
一个SO2的分子质量为ag,
则一个S原子的质量为:a−2b−a=3a−2b;
如果以一个硫原子质量的1/32作为相对原子质量的标准,
那么S原子的相对原子质量为32;
而氧原子的相对原子质量为:b−a3a−2b32=b−a3a−2b×32;
那么SO2的相对分子质量为为:32+b−a3a−2b×32×2=32a3a−2b。
19.【答案】160;56
【解答】设该化合物的化学式为RxOy,
根据正负化合价代数和为零得到:(+3)x+(-2)y=0,
解得:x:y=2:3,
则化学式为:R2O3。
那么该化合物的相对分子质量为:16×330%=160;
相对分子质量等于相对原子质量与个数的乘积之和,
据此得到:2z+16×3=160;
解得:z=56.
那么R元素的相对原子质量为56。
20.【答案】(1)3CO
(2)两个铁原子
(3)Na2SO4
(4)一个镁离子带两个单位的正电荷
【解答】(1)一氧化碳分子由1个碳原子和1个氧原子构成,写作CO,在前面写3表示个数,即3CO;
(2)2Fe中数字“2”的意义:两个铁原子。
(3)硫酸钠由2个钠离子和1个硫酸根离子构成,写作: Na2SO4 。
(4)Mg2+中数字“2”的意义:一个镁离子带两个单位的正电荷。
21.【答案】BCE;D;17:18;氧分子
【解答】(1)A:液氧和氧气其实是一种物质,由于只有一种氧元素组成,因此为单质;
B:氧气和臭氧是两种不同物质,属于混合物;
C:二氧化碳和一氧化碳是两种不同物质,属于混合物;
D:冰和水其实是一种物质,由于由两种元素组成,因此为化合物;
E:过氧化氢和水是两种不同物质,属于混合物。
则属于混合物的是BCE,属于化合物的是D。
(2)设氧元素的质量为m,
则H2O2和H2O的质量比为:m3234:m1618=17:18。
(3)A瓶中保持液氧化学性质的最小微粒为氧分子。
22.【答案】(1)中子
(2)+1价
(3)4x10-3或0.004
【解答】(1)同位素原子具有相同的质子数和不同的中子数。根据图片可知,相同的是●,它为质子;不同的是○,则它为中子。
(2)在 T2O 中,O的化合价为-2,根据正负化合价代数和为零得到:2x+(-2)=0,解得:x=+1。
(3)100吨海水中含氘的质量:100t×0.02%×2×22×2+16=0.004t。
23.【答案】(1)2Ca
(2)H2
(3)3SO42-
【解答】(1)2个钙原子写作2Ca;
(2)液态氢由氢分子构成,而氢分子由两个原子构成,写作:H2;
(3)硫酸根离子带两个单位的负电荷,写作SO42-,在前面写数字3表示离子的个数,即:3SO42-。
24.【答案】(1)NaCl
(2)②④
(3)金属
【解答】(1)根据图片可知,③为第11号元素,即Na;④为17号元素,即Cl,二者组成的化合物叫氯化钠,化学式为NaCl;
(2)根据图片可知,②④在同一列,即属于同一族,具有相似的化学性质;
(3)根据图片可知,中间的汉字为鉨,因此为鉨元素,由于含有金字旁,因此为金属元素。
25.【答案】(1)2
(2)B
(3)D
【解答】(1)元素是具有相同核电荷数的同一类原子的统称,即元素的本质区别就是核电荷数不同,即质子数不同。根据表格可知,质子数只有两种,因此共有2种元素。
(2)质子带正电荷,电子带负电荷,如果质子数大于电子数,那么带正电,为阳离子。根据表格可知,只有B的质子数大于电子数,因此阳离子是B。
(3)同位素原子具有相同的质子数和不同的中子数。根据表格可知,A和D的质子数相同,而中子数不同,为同位素原子。
26.【答案】(1)Ar
(2)4SO2
(3)2OH—
(4)N2
(5)H2O
【解答】(1)氩气为稀有气体,直接由原子构成,写作Ar。
(2)二氧化硫分子由一个硫原子和两个氧原子构成,写作SO2,则4个二氧化硫写作: 4SO2 ;
(3)氢氧根离子带一个单位的负电荷,写作OH-,则2个氢氧根离子写作:2OH-;
(4)空气中含量最多的物质为氮气,由分子构成,每个氮气分子由两个氮原子构成,写作:N2;
(5)保持水的化学性质的最小微粒为水分子,由两个氢原子和一个氧原子构成,写作:H2O。
27.【答案】①②;1:4
【解答】(1)该物质中碳元素的质量:4.4g×1244=1.2g;
该物质中氢元素的质量:3.6g×218=0.4g;
那么氢元素和碳元素的总质量为:1.2g+0.4g=1.6g;
因此该物质只含有碳和氢元素,不含氧元素。
故选①②。
(2)该分子中C、H的原子个数之比:1.2g12:0.4g1=1:4。
28.【答案】(1)2个氢原子
(2)一个氢气分子由2个氢原子构成
【解答】(1)2H:2个氢原子。
(2)H2:一个氢气分子由2个氢原子构成。
29.【答案】(1)Al(OH)3
(2)+3
【解答】(1)氢氧化铝由1个铝离子和3个氢氧根离子构成,则化学式为: Al(OH)3 ;
(2)在化学式 FeO(OH) 中,O元素的化合价为-2,OH根的化合价为-1,根据正负化合价代数和和为零得到:x+(-2)+(-1)=0,解得:x=+3。
30.【答案】(1)CO2
(2)Mg2+
【解答】(1)保持二氧化碳化学性质的最小微粒为二氧化碳分子,由1个碳原子和2个氧原子构成,写作:CO2;
(2)镁离子带两个单位的正电荷,即在元素符号右上角写数字2和“+”,即Mg2+。
31.【答案】(1)53
(2)53
【解答】(1)131I原子中含有53个质子,根据“核外电子数=质子数”可知,这个原子的核外电子数为53。
(2)127I和131I同属于碘元素,则它们的质子数相同,都是53。
32.【答案】a+5
【解答】设B元素的质子数为x,
x-3=a+2;
解得:x=a+5。
33.【答案】(1)会
(2)保持物质化学性质的一种微粒
(3)不会
【解答】(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会变蓝色。
(2)由上述三个实验可知,分子是保持物质化学性质的一种微粒。
(3)现在市场上买来的食盐都是加碘盐(含有KIO3),其中只有碘原子,没有碘分子,因此用馒头蘸取少量的食盐水,馒头不会变蓝色。
34.【答案】(1)2Fe
(2)mCO32-
(3)5CO2
(4)H2O
【解答】(1)2个铁原子写作:2Fe;
(2)碳酸根离子带2个单位的负电荷,写作:CO32-,则m个碳酸根离子写作:mCO32-。
(3)二氧化碳分子由一个碳原子和两个氧原子构成,则5个二氧化碳分子写作:5CO2;
(4)保持水的化学性质的最小微粒是水分子,由两个氢原子和一个氧原子构成,写作:H2O。
35.【答案】+6;32;S
【解答】(1)在化学 H2RO4中,H的化合价为+1,O的化合价为-2,根据正负化合价代数和为零得到:(+1)×2+x+(-2)×4=0,解得:x=+6.
(2)根据相对分子质量的定义得到:1×2+y+16×4=98,解得:y=32;
(3)该原子中有16个中子,则质子数为:32-16=16。根据元素周期表可知,原子序数为16的元素为S。
36.【答案】1−74a
【解答】根据等效原理,可以转化为MgS、MgSO3、MgSO4(相当于NaHSO4)组成,
则视为两部分MgS和氧元素组成,
硫元素的质量分数为a,则镁元素的质量分数为a32×24=3a4;
则氧元素的质量分数为:1−a−3a4=1−7a4。
37.【答案】(1)N2
(2)3NO3-
(3)Al2O3
(4)CuO
【解答】(1)空气中含量多且常用作保护气的是氮气,写作N2;
(2)3 个硝酸根离子:3NO3-;
(3)地壳中含量最多的元素为O,含量最多的金属元素为Al,二者所形成的化合物是 三氧化二铝,写作Al2O3;
(4)氧化铜中铜元素的化合价为+2写作:Cu+2O。
38.【答案】(1)Cl2
(2)电子层数
(3)氯化钠
(4)质子数不同
【解答】(1)图中位于第 3周期、ⅦA 族的元素为Cl,组成的单质为氯气,写作Cl2;
(2)根据元素周期表可知,第一周期的元素只有一个电子层,第二周期的元素都有2个电子层,第三周期都有3个电子层,那么得到:每一周期元素原子的电子层数相同。
(3)第11号元素为Na,第17号元素为Cl,二者构成的物质为氯化钠,写作NaCl;
(4)表中不同种元素最本质的区别是质子数不同。
39.【答案】(1)O
(2)O2
(3)O2-
(4)2O
(5)Al2O 3
(6)CO2
【解答】(1)氧原子写作:O;
(2)氧分子写作:O2;
(3)氧离子带2个单位的负电荷,写作:O2-;
(4)2个氧原子写作:2O;
(5)氧化铝分子由2个氯原子和3个氧原子构成,写作 Al2O3 :
(6)二氧化碳分子由一个碳原子和2个氧原子构成,写作: CO2 。
40.【答案】混合物;5
【解答】(1)根据包装盒可知,该物质由三种物质组成,为混合物;
(2)根据包装盒可知,该疫苗填充剂由Na、Cl、H、P、O共5种元素组成。
41.【答案】(1)C
(2)A;C;D
【解答】(1)根据化学式可知,氯乙烷中碳、氢、氧的质量之比为:(12×2):(1×5):(35.5×1)=24:5:35.5,即质量分数从大到小为:Cl>C>H,则甲为C。
(2)A.氯乙烷的相对分子质量为:12×2+1×5+35.5×1=64.5,故A正确;
B.根据化学式 C2H5Cl可知,氯乙烷分子由2个碳原子、5个氢原子、一个氯原子构成,故B错误;
C.根据化学式 C2H5Cl可知,氯乙烷由碳元素、氢元素、氯元素组成,故C正确;
D.根据化学式 C2H5Cl可知,一个氯乙烷分子中碳原子和氢原子的个数比为2:5,故D正确。
故选ACD。
42.【答案】(1)He
(2)2个氢原子
【解答】(1)氦气为稀有气体,可用元素符号表示,即He;
(2)H表示一个氢原子,则2H表示2个氢原子。
43.【答案】(1)C;分子间的间隙变大了
(2)碳酸钙(或CaCO3)
(3)氮(或 N)
【解答】(1)物态变化中没有新物质生成,即分子的种类不变,变化的只是分子之间的距离。当水由液态变成气态时,分子间的距离最大,故选C。
(2)由于给出的图示中不含碳元素,所以不存在的是碳酸钙,所以不可能含有碳酸钙。
(3)CO(NH2)2中碳氢氮氧的质量比为12:4:(14×2):16=12:4:28:16,所以质量分数最大的是氮元素,所以A表示氮元素。
44.【答案】(1)75
(2)23:64
【解答】(1)根据核外电子数=质子数可知,它的核外电子数为75。
(2)根据化学式 NaReO4 可知,高铼酸钠中纳、氧元素的质量比为:(23×1):(16×4)=23:64。
45.【答案】(1)分子
(2)分子
(3)N2O5
【解答】(1)氧气和氮气在化学性质上有很大不同,是因为构成它们的分子不同。
(2)元素是具有相同的核电荷数的同一类原子的统称,则氧元素和氮元素的最根本区别是核电荷数不同,即质子数不同,故选C。
(3)设化合物的化学式为NxOy,根据正负化合价代数和为零得到:(+5)x+(-2)y=0,解得:x:y=2:5,即化学式为N2O5。
46.【答案】(1)③
(2)SO2或SO3等
【解答】(1)氧元素原子序数为8,在图乙中的③位置处;
(2)图乙中的元素⑥为硫元素,氧元素可以与硫元素组成二氧化硫或三氧化硫等物质。
故答案为:(1) ③ ;(2) SO2或SO3等 。
47.【答案】(1)CO
(2)CO+H2O 催化剂__ CO2+H2
【解答】(1)由图示可知, 反应过程中,金属铂选择性吸附的分子是水煤气中的CO;
(2)由模型可知,该反应是CO和水在催化剂作用下生成二氧化碳和氢气,反应方程式为CO+H2O 催化剂__ CO2+H2 。
故答案为:(1)CO;(2) CO+H2O 催化剂__ CO2+H2 。
48.【答案】3m:5n;akgb−a2kg×116=32ab−a
【解答】 1个N2O3分子中3个氧原子,1个N2O5分子中5个氧原子,m个 N2O3 分子和n个 N2O5 分子中所含氧元素的质量比是3m:5n; 若一个 N2O3 分子的质量为a千克,一个 N2O5 分子的质量为 b千克,则一个氧原子质量为b−a2kg,以氧原子质量的1/16 作为标准,则 N2O3 的相对分子质量为akgb−a2kg×116=32ab−a。
故答案为: 3m:5n ;32ab−a。
49.【答案】(1)+4
(2)比热大
【解答】(1)在化学式 FeTiO3 中,Fe的化合价为+2,O的化合价为-2,根据正负化合价代数和为零得到:(+2)+x+(-2)×3=0,解得:x=+4。
(2)月球表面温度最低时可达零下200℃,最高可超过100℃。嫦娥四号探头等设备中专配有低温多层隔热组件,这些部件在受热和散热时温度变化较小,可使设备运行温度维持在正常范围内,由此可知该组件一个重要的物理性质是比热容大。
50.【答案】2:3;14:11
【解答】(1)设分子数为n,则n个SO2中O原子的个数为2n,n个SO3中O原子的个数为3n,那么其中氧元素的质量之比为:(16×2n):(16×3n)=2:3;
(2)设质量为m,
则二氧化碳中氧元素的质量为:m×3244=3244m;
则一氧化碳中氧元素的质量为:m×1628=1628m;
那么二者氧元素的质量之比为:3244m:1628m=14:11。族周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
3Li 锂
6.941
4Be 铍
9.012
5B 硼
10.81
6C 碳
12.01
7N 氮
14.01
8O 氧
16.00
9F 氟
19.00
10Ne 氖
20.18
3
11Na 钠
22.99
12 Mg
镁
24.31
13Al 铝
26.98
14Si 硅
28.09
15P 磷
30.97
16S 硫
32.06
17Cl 氯
35.45
18Ar 氩
39.95
试验次数
金属质量(g)
金属氧化物质量(g)
1
45.0
84.9
2
45.0
85.1
3
45.0
85.0
平均值
45.0
m
名称
符号
相对原子质量
氕
H
1
氘
D
2
氚
T
3
粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
相关试卷
这是一份八下期中试卷A卷-2022-2023学年八年级科学下学期课后培优分级练(浙教版),共15页。试卷主要包含了填写答题卡的内容用2B铅笔填写,提前 xx 分钟收取答题卡等内容,欢迎下载使用。
这是一份八下期中复习——计算题与解答专题-2022-2023学年八年级科学下学期课后培优分级练(浙教版),共28页。试卷主要包含了电磁铁应用计算与解答题,电动机和发电机,家庭电路及安全用电,第二章计算题,第二章解答题等内容,欢迎下载使用。
这是一份八下期中复习——实验探究(第二章)-2022-2023学年八年级科学下学期课后培优分级练(浙教版),共18页。试卷主要包含了分子特性,原子的结构,组成物质的元素,元素周期表,化合价,实验探究题等内容,欢迎下载使用。