

- 人教版2019选择性必修2高二化学课时过关提优AB练2.3.1共价键的极性(基础过关A练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练2.2.1分子的空间结构价层电子对互斥模型(基础过关A练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.1物质的聚集状态与晶体的常识(素养提优B练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.2分子晶体与共价晶体(素养提优B练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.4配合物与超分子(基础过关A练)(原卷版+解析) 试卷 1 次下载
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体同步测试题
展开(建议时间:30分钟)
1.下列叙述正确的是
A.金属受外力作用时常常发生变形而不易折断,这是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
2.下列四种性质的叙述,可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点低
B.固态时或熔融后易导电,熔点在1 000 ℃左右
C.以共价键结合成三维骨架结构,熔点高
D.固态时不导电,但溶于水或熔融后能导电
3.在金属晶体中,金属原子的价电子数越多,原子半径越小,金属键越强,金属的熔、沸点越高。由此判断下列各组金属熔、沸点高低顺序,其中正确的是
A.Mg>Al>CaB.Al>Na>Li
C.Al>Mg>CaD.Mg>Ba>Al
4.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔点的高低和硬度的大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是
A.金属镁的熔点大于金属铝
B.碱金属的熔点从到是逐渐增大的
C.金属铝的硬度大于金属钠
D.金属钙的硬度小于金属钡
5.下图为某金属的面心立方晶胞,则该金属的一个晶胞中实际拥有的微粒数为( )
A.3 B.4 C.7 D.9
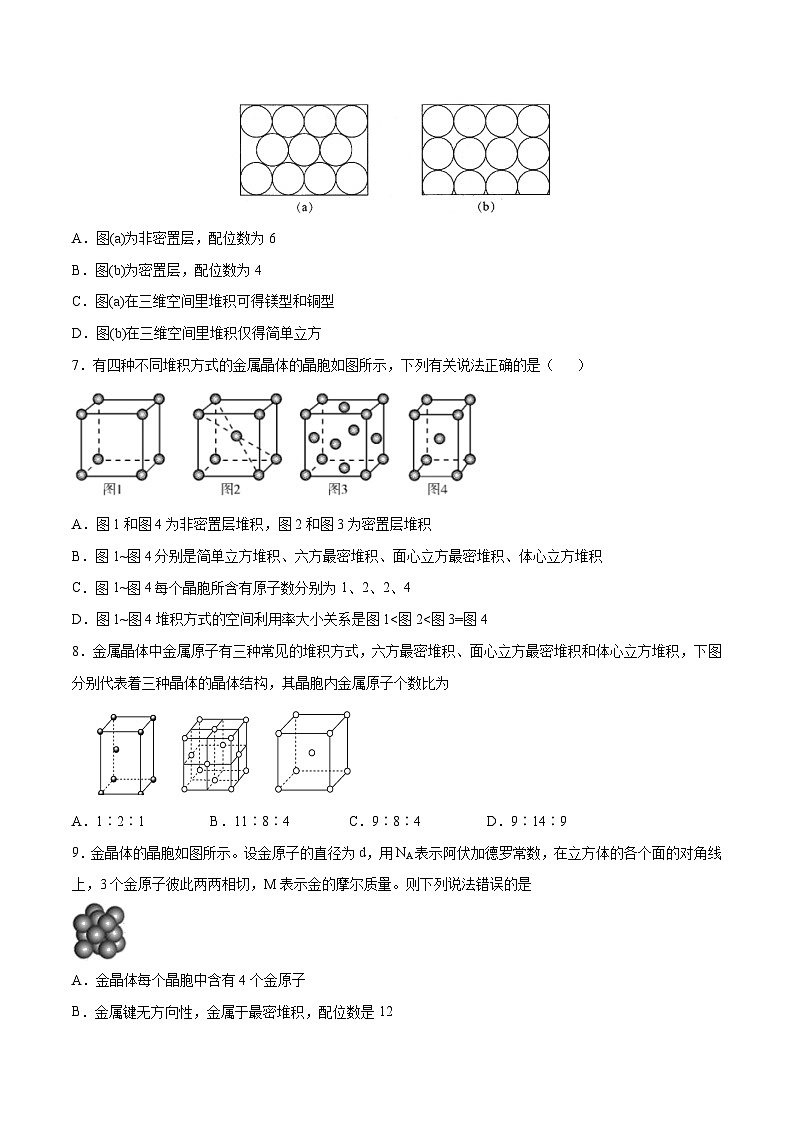
6.金属原子在二维空间里的放置有下图所示的两种方式,下列说法中正确的是
A.图(a)为非密置层,配位数为6
B.图(b)为密置层,配位数为4
C.图(a)在三维空间里堆积可得镁型和铜型
D.图(b)在三维空间里堆积仅得简单立方
7.有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率大小关系是图1<图2<图3=图4
8.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为
A.1∶2∶1B.11∶8∶4C.9∶8∶4D.9∶14∶9
9.金晶体的晶胞如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属于最密堆积,配位数是12
C.一个晶胞的体积是16d3
D.金晶体的密度是
10.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法错误的是
A.铁镁合金的化学式可表示为
B.晶胞中有14个铁原子
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是(表示阿伏加德罗常数的值)
11.金晶体是面心立方最密堆积,已知立方体的每个面上5个金原子紧密堆砌,金原子半径为r cm,则金晶体的空间利用率为
A.B.
C.D.
12.石墨晶体是层状结构(如图)。以下有关石墨晶体的说法正确的一组是( )
①石墨中存在两种作用力;②石墨是混合晶体;③石墨中的C为sp2杂化;④石墨熔点、沸点都比金刚石低;⑤石墨中碳原子数和C—C键数之比为1∶2;⑥石墨和金刚石的硬度相同;⑦石墨层内导电性和层间导电性不同;⑧每个六元环完全占有的碳原子数是2
A.全对 B.除⑤外
C.除①④⑤⑥外D.除⑥⑦⑧外
13.Al 的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示。
已知 Al的原子半径为 d,NA代表阿伏加德罗常数,Al 的相对原子质量为 M。
(1)晶胞中 Al 原子的配位数为_____,一个晶胞中 Al 原子的数目为_____,该晶胞的空间利用率是_____。
(2)该晶体的密度为_____(用字母表示)。
14.碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
15.(1)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子数是_________个。
②该晶胞称为________(填序号)。
A 六方晶胞 B 体心立方晶胞 C 面心立方晶胞 D 简单立方晶胞
③此晶胞立方体的边长为,的摩尔质量为,金属铜的密度为,则阿伏加德罗常数为________(用a、表示)。
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的品面上的单层附着局部示意图(图中小黑色球代表氮原子,大灰色球代表铁原子)。则在图示状况下,铁颗粒表面上的原子数的比值为____________。
(3)硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为_______。
(4)若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是_______。
A 氢键:分子间作用力:非极性键 B 氢键;分子间作用力:极性键
C 氢键;极性键;分子间作用力 D 分子间作用力;氢键:非极性键
16.早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)①铜元素位于周期表中________区。Cu2+的价电子排布图为___________
___________。
②锰、铁、钴三种元素的逐级电离能如下表:
铁元素的第三电离能明显低于锰元素和钴元素,其原因是 __。
③实验室可用赤血盐K3[Fe(CN)6]检验Fe2+,在赤血盐中铁元素的化合价为________,中心离子的配位数为________。
(2)利用反应:X+C2H2+NH3→Cu2C2+NH4Cl(未配平)可检验乙炔。
①化合物X晶胞结构如图,据此可知X的化学式为________。
②乙炔分子中σ键与π键数目之比为_______,碳原子的杂化方式为_______;N空间构型为 (用文字描述)。
(3)Al单质中原子采取面心立方最密堆积,其晶胞边长为0.405 nm,列式表示Al单质的密度 g·cm-3(不必计算出结果)。
电离能/kJ·ml-1
I1
I2
I3
I4
Mn
717.3
1 509.0
3 248
4 940
Fe
762.5
1 561.9
2 957
5 290
C
760.4
1 648
3 232
4 950
B练——素养提优
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
(建议时间:30分钟)
1.下列叙述正确的是
A.金属受外力作用时常常发生变形而不易折断,这是由于金属原子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
【答案】D
【解析】A.金属受外力作用时常常发生变形而不易折断,这是因为金属晶体中各层会发生相对滑动, A错误;
B.金属里的自由电子要在外电场作用下才能发生定向移动产生电流,B错误;
C.金属的导热性是由于自由电子碰撞金属原子将能量进行传递,C错误;
D.受热的自由电子的能量增大,无规则运动加剧,影响自由电子的定向移动,导电能力减弱,D正确;
故选D。
2.下列四种性质的叙述,可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点低
B.固态时或熔融后易导电,熔点在1 000 ℃左右
C.以共价键结合成三维骨架结构,熔点高
D.固态时不导电,但溶于水或熔融后能导电
【答案】B
【解析】由分子间作用力结合而成,熔点低,为分子晶体的特点,A错误;固态或熔融后能导电,熔点在1 000 ℃左右,可能为金属晶体,B正确;以共价键结合成三维骨架结构,熔点高,是共价晶体的特点,C错误;固态时不导电,不符合金属晶体的特征,D错误。
3.在金属晶体中,金属原子的价电子数越多,原子半径越小,金属键越强,金属的熔、沸点越高。由此判断下列各组金属熔、沸点高低顺序,其中正确的是
A.Mg>Al>CaB.Al>Na>Li
C.Al>Mg>CaD.Mg>Ba>Al
【答案】C
【解析】电荷数:Al3+>Mg2+=Ca2+>Li+=Na+;而金属阳离子半径:r(Ba2+)>r(Ca2+)>r(Na+)>r(Mg2+)>r(Al3+)>r(Li+),原子半径越小,金属键越强,金属的熔、沸点越高。
A.通过分析可知,选项中熔、沸点:Al>Mg,A错误;
B.通过分析可知,选项中熔、沸点:Li>Na,B错误;
C.通过分析可知,C正确;
D.通过分析可知,选项中熔、沸点:Al>Mg>Ba,D错误;
答案选C。
4.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔点的高低和硬度的大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是
A.金属镁的熔点大于金属铝
B.碱金属的熔点从到是逐渐增大的
C.金属铝的硬度大于金属钠
D.金属钙的硬度小于金属钡
【答案】C
【解析】A.镁离子的半径比铝离子大且所带电荷数少,所以金属镁的金属键比金属铝弱,熔点和硬度都小,A错误;
B.从到,离子的半径是逐渐増大的,所带电荷数相同,金属键逐渐减弱,熔点和硬度都逐渐减小,B错误;
C.因离子的半径小而所带电荷数多,故金属铝的金属键比金属钠强,所以金属铝的熔点和硬度比金属钠都大,C正确;
D.钙离子的半径比钡离子小而所带电荷数相同,则金属钙的金属键比金属钡强,所以金属钙的熔点和硬度比金属钡都大,D错误;
故选C。
5.下图为某金属的面心立方晶胞,则该金属的一个晶胞中实际拥有的微粒数为( )
A.3 B.4 C.7 D.9
【答案】B
【解析】根据均摊法计算:面心立方晶胞中有8个原子位于顶点,6个原子位于面心,所以晶胞中的原子个数为8×eq \f(1,8)+6×eq \f(1,2)=4。
6.金属原子在二维空间里的放置有下图所示的两种方式,下列说法中正确的是
A.图(a)为非密置层,配位数为6
B.图(b)为密置层,配位数为4
C.图(a)在三维空间里堆积可得镁型和铜型
D.图(b)在三维空间里堆积仅得简单立方
【答案】D
【解析】A.把金属键描述为金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共有,从而把所有金属原子维系在一起,金属晶体是一种“巨型分子”,故A正确;B.把金属键描述为金属原子脱落下来的价电子形成遍布整快晶体的“电子气”,被所有原子所共有,故B正确;C.金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%.因此简单立方的空间利用率最低,面心立方空间利用率最高,故C正确;D. 金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%,因此简单立方的空间利用率最低,面心立方空间利用率最高,故D错误;故选D。
7.有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率大小关系是图1<图2<图3=图4
【答案】D
【解析】A.图1、图2为非密置层堆积,图3、图4为密置层堆积,故A错;
B.图1~图4分别是简单立方堆积、体心立方堆积、面心立方堆积和六方最密堆积,故B错;
C.图1~图4每个晶胞所含有的原子数分别为8=1、8+1=2、8+6=4、8+1=2,故C错;
D.图1~图4堆积方式的空间利用率分别为:52%、68%、74%、74%,故D正确 ;
答案选D。
8.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为
A.1∶2∶1B.11∶8∶4C.9∶8∶4D.9∶14∶9
【答案】A
【解析】根据均摊法可推知,第一个为六方最密堆积的晶胞,此晶胞中有两个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子;所以原子个数比为2∶4∶2,化简为1∶2∶1,所以选A。
9.金晶体的晶胞如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属于最密堆积,配位数是12
C.一个晶胞的体积是16d3
D.金晶体的密度是
【答案】C
【解析】A.金原子处于顶点与面心上,算晶胞中含有的金原子数目为8×+6×=4,A说法正确;
B.金晶体中,金属键无方向性,金原子采取面心立方最密堆积,配位数是12,B说法正确;
C.在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为×2d=d,故晶胞的体积为(d)3=2d3,C说法错误;
D.晶胞中含有4个原子,故晶胞质量为,晶胞的体积为2d3,故晶胞密度=,D说法正确;
答案为C。
10.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法错误的是
A.铁镁合金的化学式可表示为
B.晶胞中有14个铁原子
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是(表示阿伏加德罗常数的值)
【答案】B
【解析】A.晶胞中含有铁原子的数目为,含有镁原子的数目为8,故化学式可表示为,A项正确,
B.据A选项分析,晶胞中有4个铁原子,B项错误;
C.金属合金仍为金属,晶体中有金属键,C项正确;
D.一个晶胞中含有4个“”,其质量为,D项正确。
故选:B。
11.金晶体是面心立方最密堆积,已知立方体的每个面上5个金原子紧密堆砌,金原子半径为r cm,则金晶体的空间利用率为
A.B.
C.D.
【答案】B
【解析】面心立方最密堆积原子在晶胞中的位置关系如图。
金晶体为面心立方最密堆积,则晶胞面对角线为金原子半径的4倍,金原子半径为r cm,则晶胞的边长为4r=r cm,每个金晶胞中含有4个原子,则金原子总体积为,金晶胞体积为,故空间利用率为。
故选B。
12.石墨晶体是层状结构(如图)。以下有关石墨晶体的说法正确的一组是( )
①石墨中存在两种作用力;②石墨是混合晶体;③石墨中的C为sp2杂化;④石墨熔点、沸点都比金刚石低;⑤石墨中碳原子数和C—C键数之比为1∶2;⑥石墨和金刚石的硬度相同;⑦石墨层内导电性和层间导电性不同;⑧每个六元环完全占有的碳原子数是2
A.全对 B.除⑤外
C.除①④⑤⑥外D.除⑥⑦⑧外
【答案】C
【解析】①不正确,石墨中存在三种作用力,一种是范德华力,一种是共价键,还有一种是金属键;②正确;③正确,石墨中的C为sp2杂化;④不正确,石墨熔点比金刚石高;⑤不正确,石墨中碳原子数和C—C键数之比为2∶3;⑥不正确,石墨质软,金刚石的硬度大;⑦正确;⑧正确,每个六元环完全占有的碳原子数是6×1/3=2。
13.Al 的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示。
已知 Al的原子半径为 d,NA代表阿伏加德罗常数,Al 的相对原子质量为 M。
(1)晶胞中 Al 原子的配位数为_____,一个晶胞中 Al 原子的数目为_____,该晶胞的空间利用率是_____。
(2)该晶体的密度为_____(用字母表示)。
【答案】12 4 74%
【分析】根据晶胞结构得出金属Al为面心立方,根据面心立方得出配位数,空间利用率,再根据晶胞结构先计算晶胞参数,再计算密度。
【解析】(1)根据晶胞的结构得出晶体Al是面心立方,晶胞中原子的配位数为12,一个晶胞中Al原子的数目为,该晶胞的空间利用率是74%;故答案为:12;4;74%。
(2)晶体Al是面心立方,则晶胞参数,该晶体的密度为;故答案为:。
【点睛】晶胞密度的计算是常考知识,根据密度公式分别找出质量和体积,先找出一个的质量,再乘以晶胞中有几个,再根据晶胞参数计算晶胞体积。
14.碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
【答案】(1)同素异形体 (2)sp3 sp2 (3)分子 混合 (4)σ σ π(或大π或ppπ)
【解析】(1)金刚石、石墨、C60、碳纳米管都是由同种元素形成的不同单质,故它们互为同素异形体。(2)在金刚石中,每个碳原子都形成四个共价单键,故碳原子的杂化方式为sp3;石墨烯中碳原子采用sp2杂化。(3)一个“C60”就是一个分子,故C60属于分子晶体;石墨层与层之间是范德华力,而同一层中碳原子之间是共价键,故形成的晶体为混合晶体。(4)在金刚石晶体中,碳原子之间只形成共价单键,全部为σ键;在石墨层内的碳原子之间既有σ键又有π键。
15.(1)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子数是_________个。
②该晶胞称为________(填序号)。
A 六方晶胞 B 体心立方晶胞 C 面心立方晶胞 D 简单立方晶胞
③此晶胞立方体的边长为,的摩尔质量为,金属铜的密度为,则阿伏加德罗常数为________(用a、表示)。
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的品面上的单层附着局部示意图(图中小黑色球代表氮原子,大灰色球代表铁原子)。则在图示状况下,铁颗粒表面上的原子数的比值为____________。
(3)硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为_______。
(4)若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是_______。
A 氢键:分子间作用力:非极性键 B 氢键;分子间作用力:极性键
C 氢键;极性键;分子间作用力 D 分子间作用力;氢键:非极性键
【答案】4 C B
【分析】(2)①根据图片知,该晶胞中含有6个半个球、8个球,据此计算铜原子个数;
②该晶胞属于面心立方晶胞;
③晶胞体积为a3cm3,晶胞体积=,据此计算阿伏伽德罗常数。
【解析】(1)①根据图片知,该晶胞中含有6个半个球、8个球,则该晶胞中Cu原子个数=8×+6×=4,答案为:4;
②该晶胞属于面心立方晶胞,故选C;
③晶胞体积为a3cm3,晶胞体积=,则阿伏加德罗常数= = /ml= /ml,故答案为:/ml。
(2)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子周围的铁原子数为4×=2,故氮原子与铁原子的最大个数比为1:2;
(3)根据晶体结构单元可知,在六棱柱顶点上的镁原子被6个六棱柱共用,在上下底面上的镁原子被两个六棱柱共用,根据均摊法可知晶胞中Mg原子的个数为2×,B原子的个数为6,所以Mg原子和B原子的个数比为3:6=1:2,所以化学式为MgB2;
(4)固态水中和液态水中含有氢键,当雪花→水→水蒸气主要是氢键被破坏,还有分子间作用力,但属于物理变化,共价键没有破坏,水蒸气→氧气和氢气,为化学变化,破坏的是极性共价键,故选:B。
16.早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)①铜元素位于周期表中________区。Cu2+的价电子排布图为___________
___________。
②锰、铁、钴三种元素的逐级电离能如下表:
铁元素的第三电离能明显低于锰元素和钴元素,其原因是 __。
③实验室可用赤血盐K3[Fe(CN)6]检验Fe2+,在赤血盐中铁元素的化合价为________,中心离子的配位数为________。
(2)利用反应:X+C2H2+NH3→Cu2C2+NH4Cl(未配平)可检验乙炔。
①化合物X晶胞结构如图,据此可知X的化学式为________。
②乙炔分子中σ键与π键数目之比为_______,碳原子的杂化方式为_______;N空间构型为 (用文字描述)。
(3)Al单质中原子采取面心立方最密堆积,其晶胞边长为0.405 nm,列式表示Al单质的密度 g·cm-3(不必计算出结果)。
【答案】(1)① ds
②C的核电荷数多于Fe,电子离开时克服的引力较大,所以C的第三电离能比Fe大。Mn2+是半充满结构(3d5),再电离一个电子所需的能量较高,所以Mn的第三电离能也比Fe大
③+3 6
(2)①CuCl ②3∶2 sp杂化 正四面体
(3)
【解析】(1)①铜原子价电子排布式为3d104s1,位于ds区,Cu2+是Cu原子失去2个电子,即价电子排布图为;②Fe价电子排布式为3d64s2,Mn的价电子排布式为3d54s2,C价电子排布式为3d74s2, C的核电荷数多于Fe,电子离开时克服的引力较大,所以C的第三电离能比Fe大,Mn2+是半充满结构(3d5),再电离一个电子所需的能量较高,所以Mn的第三电离能也比Fe大;③K显+1价,CN显-1价,整个化合价代数和为0,因此Fe的价态是+3价,CN-是Fe的配离子,因此中心离子的配位数为6;(2)①Cu位于顶点和面心,个数为8×1/8+6×1/2=4,Cl位于晶胞内部,有4个,因此化学式为CuCl;②乙炔结构简式为HC≡CH,成键原子间只能有1个σ键,碳碳三键中有2个π键,因此1 ml乙炔中σ键和π键数目的比值为3∶2;碳有2个σ键,无孤电子对,杂化类型为sp;N中N有4个σ键,无孤电子对,即杂化类型为sp3,空间构型为正四面体;(3)晶胞中Al的个数为8×1/8+6×1/2=4,则晶胞的质量为4×27/NA g,晶胞的体积为(0.405×10-7)3cm3,根据密度的定义,则密度为 g·cm-3。
电离能/kJ·ml-1
I1
I2
I3
I4
Mn
717.3
1 509.0
3 248
4 940
Fe
762.5
1 561.9
2 957
5 290
C
760.4
1 648
3 232
4 950
高中人教版 (2019)第一节 原子结构课堂检测: 这是一份高中人教版 (2019)<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构课堂检测</a>,共15页。试卷主要包含了下列微粒半径大小比较正确的是,下列说法正确的是等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构随堂练习题: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构随堂练习题</a>,共13页。试卷主要包含了下列说法正确的是,下列说法中正确的是,下列说法中不正确的是,下列说法错误的是等内容,欢迎下载使用。
高中人教版 (2019)实验活动3 糖类的性质精品一课一练: 这是一份高中人教版 (2019)实验活动3 糖类的性质精品一课一练,文件包含33醛酮素养提优B练-2022-2023学年高二化学课时过关提优AB练人教版2019选择性必修3解析版docx、33醛酮素养提优B练-2022-2023学年高二化学课时过关提优AB练人教版2019选择性必修3原卷版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。













