

- 人教版2019选择性必修2高二化学课时过关提优AB练2.3.1共价键的极性(基础过关A练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练2.2.1分子的空间结构价层电子对互斥模型(基础过关A练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.1物质的聚集状态与晶体的常识(素养提优B练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.2分子晶体与共价晶体(素养提优B练)(原卷版+解析) 试卷 0 次下载
- 人教版2019选择性必修2高二化学课时过关提优AB练3.3金属晶体与离子晶体(素养提优B练)(原卷版+解析) 试卷 0 次下载
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子同步测试题
展开(建议时间:25分钟)
1.下列不能形成配位键的组合是( )
A.Ag+、NH3 B.H2O、H+
C.C3+、COD.Ag+、H+
2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.若X提供空轨道,则配位键表示为X→Y
3.下列粒子中含配位键的是( )
①N2Heq \\al(+,5) ②CH4 ③OH- ④NHeq \\al(+,4) ⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧D.全部
4.配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为[TiCl(H2O)5]Cl2∙H2O,下列有关说法正确的是
A.该配合物中存在离子键、配位键和极性键
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.配体是Cl-和H2O,配位数是9
D.加入足量AgNO3溶液,所有Cl-均以沉淀形式存在
5.已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间结构为( )
A.直线形B.平面正方形
C.正四面体形D.正八面体形
6.下列关于超分子的说法不正确的是
A.超分子是两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装性质
7.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键
B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6
C.1ml 配合物中σ键数目为10NA
D.该配合物为离子化合物,易电离,1ml 配合物电离共得到3 NA阴、阳离子
8.下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
C.配位化合物Ni(CO)4结构如图,1ml分子中所含的配位键个数有8NA
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
9.向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是
A.深蓝色溶液中含有的主要有色离子为
B.与间的配位键比与间的配位键弱
C.加乙醇的目的是降低生成的配合物的溶解度
D. 中含有键的数目为
10.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。有关该配离子的说法错误的是
A.中心离子Fe3+的配位数是6
B.该配离子中碳原子的杂化类型为sp2和sp3
C.该配离子中含有的化学键有离子键、共价键、配位键
D.该配离子含有的非金属元素中电负性最小的是氢
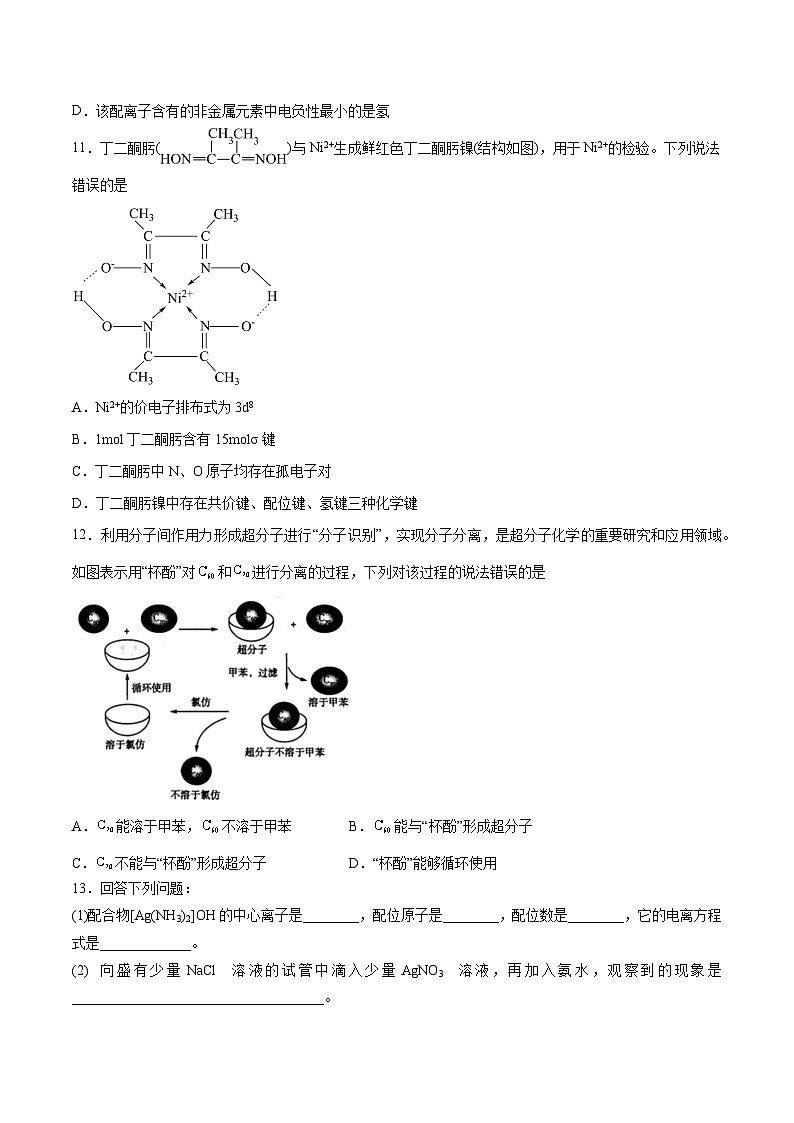
11.丁二酮肟()与Ni2+生成鲜红色丁二酮肟镍(结构如图),用于Ni2+的检验。下列说法错误的是
A.Ni2+的价电子排布式为3d8
B.1ml丁二酮肟含有15mlσ键
C.丁二酮肟中N、O原子均存在孤电子对
D.丁二酮肟镍中存在共价键、配位键、氢键三种化学键
12.利用分子间作用力形成超分子进行“分子识别”,实现分子分离,是超分子化学的重要研究和应用领域。如图表示用“杯酚”对和进行分离的过程,下列对该过程的说法错误的是
A.能溶于甲苯,不溶于甲苯B.能与“杯酚”形成超分子
C.不能与“杯酚”形成超分子D.“杯酚”能够循环使用
13.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是________,配位原子是________,配位数是________,它的电离方程式是_____________。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是____________________________________。
(3)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_________。 (用离子方程式表示,已知AlFeq \\al(3-,6)在溶液中可稳定存在)。
(5)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_____(填元素符号)。
14.无水CCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CCl2,故常在实验室中用作吸湿剂和空气湿度指示剂:CCl2(深蓝色)+xH2O=CCl2·xH2O(粉红色),现有65 g无水CCl2,吸水后变成CCl2·xH2O119 g。
(1)水合物中x=___________。
(2)已知该水合物中C2+配位数为6,将等浓度等体积的CCl2溶液与硝酸银溶液混合并充分反应后,取上层清液再滴加硝酸银溶液没有沉淀产生,则该水合物化学式可表示为___________,该化合物配体是___________(写化学式),该晶体含有的化学键有___________。
A.离子键 B.共价键 C.配位键 D.氢键 E.金属键
A练——基础过关
第三章 晶体结构与性质
第四节 配合物与超分子
(建议时间:25分钟)
1.下列不能形成配位键的组合是( )
A.Ag+、NH3 B.H2O、H+
C.C3+、COD.Ag+、H+
【答案】D
【解析】配位键的形成条件必须是一方能提供孤电子对,另一方能提供空轨道,A、B、C三项中,Ag+、H+、C3+能提供空轨道,NH3、H2O、CO能提供孤电子对,所以能形成配位键,而D项Ag+与H+都只能提供空轨道,而无法提供孤电子对,所以不能形成配位键。
2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.若X提供空轨道,则配位键表示为X→Y
【答案】C
【解析】形成配位键的两种粒子可以均是分子或者均是离子,还可以一种是分子、一种是离子,但必须是一种粒子提供空轨道、另一种粒子提供孤电子对,A、B项错误,C项正确;配位键中箭头应该指向提供空轨道的X,D项错误。
3.下列粒子中含配位键的是( )
①N2Heq \\al(+,5) ②CH4 ③OH- ④NHeq \\al(+,4) ⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧D.全部
【答案】C
【解析】形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。在②CH4、③OH-中,中心原子碳和氧的价电子已完全成键,没有孤电子对。
4.配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为[TiCl(H2O)5]Cl2∙H2O,下列有关说法正确的是
A.该配合物中存在离子键、配位键和极性键
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.配体是Cl-和H2O,配位数是9
D.加入足量AgNO3溶液,所有Cl-均以沉淀形式存在
【答案】A
【解析】A.该配合物是带有结晶水的盐,属于离子化合物,阳离子[TiCl(H2O)5]2+与阴离子Cl-之间以离子键结合,在阳离子[TiCl(H2O)5]2+中的中心离子Ti3+与配位体H2O、Cl-以配位键结合,在配位体H2O及外界结晶水中存在H-O极性共价键,因此该配合物中存在离子键、配位键和极性键,A正确;
B.根据化合物中化合价代数和为0,可知中心离子是Ti3+,配离子是[TiCl(H2O)5]2+,B错误;
C.配体是Cl-和H2O,配位数是1+5=6,C错误;
D.向该配合物溶液中加入足量AgNO3溶液,只有外界Cl-能够形成AgCl沉淀,而内界配位体的Cl-与中心离子结合牢固,不能形成AgCl沉淀,D错误;
故合理选项是A。
5.已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间结构为( )
A.直线形B.平面正方形
C.正四面体形D.正八面体形
【答案】C
【解析】此配离子的中心原子采取sp3杂化,配位数为4,则[ZnCl4]2-的空间结构为正四面体形,C正确。
6.下列关于超分子的说法不正确的是
A.超分子是两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装性质
【答案】B
【解析】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,故A正确;
B.超分子有的是有限的,有的是无限伸展的,故B错误;
C.冠醚与某些金属的包合物都是超分子,可以识别碱金属离子,故C正确;
D.细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种生物分子自组装而成,故D正确;
选B。
7.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键
B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6
C.1ml 配合物中σ键数目为10NA
D.该配合物为离子化合物,易电离,1ml 配合物电离共得到3 NA阴、阳离子
【答案】C
【详解】A.Na+与[Fe(CN)5(NO)]2-存在离子键,NO分子、 CN-与 Fe3+形成配位键,碳氮之间,氮氧之间存在极性共价键,A正确;
B.NO分子、CN-与 Fe3+形成配位键,共有6个,B正确;
C.1ml配合物中σ键数目为(5×2+1×2)×NA =12 NA,C错误;
D.配合物Na2[Fe(CN)5(NO)]为离子化合物,电离出2个Na+与1个[Fe(CN)5(NO)]2-,所以1ml配合物电离共得到3NA阴阳离子,D正确;
答案选C。
8.下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
C.配位化合物Ni(CO)4结构如图,1ml分子中所含的配位键个数有8NA
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
【答案】B
【详解】A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变,A正确;
B.配位数为4的配合单元可能呈平面四边形也可能是正四面体,故B错误;
C.每个CO分子与Ni之间形成一个配位键,这种配位键个数为4,每个CO分子中还有一个配位键,所以一个该分子含有8个配位键,1ml分子中所含的配位键个数有8NA,故C正确;
D.[Pt(NH3)6]2+中NH3整体为0价,所以Pt为+2价,[PtCl4]2-中Cl-为-1价,所以Pt为+2价,故D正确;
故答案为B。
【点睛】
本题C选项为易错点,要注意CO分子中也有一个配位键。
9.向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是
A.深蓝色溶液中含有的主要有色离子为
B.与间的配位键比与间的配位键弱
C.加乙醇的目的是降低生成的配合物的溶解度
D. 中含有键的数目为
【答案】C
【分析】由题意可知,硫酸铜蓝色溶液中存在四水合铜离子,向溶液中加入氨水时,蓝色的四水合铜离子与氨水反应生成氢氧化铜蓝色沉淀,继续加入氨水,氢氧化铜蓝色沉淀与氨水反应生成深蓝色的四氨合铜离子,加入无水乙醇降低硫酸四氨合铜的溶解度,使溶液中硫酸四氨合铜析出得到深蓝色晶体。
【详解】A.由分析可知,深蓝色溶液中含有的主要有色离子为四氨合铜离子,故A错误;
B.由分析可知,实验时蓝色的四水合铜离子转化为深蓝色的四氨合铜离子,说明氨分子与铜离子形成的配位键强于水分子与铜离子形成的配位键,故B错误;
C.由分析可知,加入无水乙醇能降低硫酸四氨合铜的溶解度,使溶液中硫酸四氨合铜析出得到深蓝色晶体,故C正确;
D.四水合铜离子中铜离子与4个水分子形成的配位键属于键,每个水分子中含有2个键,则1ml离子中含有的键的数目为1ml×(4+2×4)×NAml—1=12NA,故D错误;
故选C。
10.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。有关该配离子的说法错误的是
A.中心离子Fe3+的配位数是6
B.该配离子中碳原子的杂化类型为sp2和sp3
C.该配离子中含有的化学键有离子键、共价键、配位键
D.该配离子含有的非金属元素中电负性最小的是氢
【答案】C
【解析】A.由图可知,此络合分子中,中心离子是Fe3+,配位数为6,选项A正确;
B.该配离子中碳原子有形成双键和单键的,其杂化类型有sp2、sp3杂化,选项B正确;
C.该配离子中含有的化学键有离子键、共价键、配位键、键、键,选项C错误;
D.该配离子含有的非金属元素有C、O、H,根据他们非金属性可知,电负性最大的是氧,最小的是H,选项D正确;
答案选C。
11.丁二酮肟()与Ni2+生成鲜红色丁二酮肟镍(结构如图),用于Ni2+的检验。下列说法错误的是
A.Ni2+的价电子排布式为3d8
B.1ml丁二酮肟含有15mlσ键
C.丁二酮肟中N、O原子均存在孤电子对
D.丁二酮肟镍中存在共价键、配位键、氢键三种化学键
【答案】D
【解析】A.Ni是28号元素,根据结构可知基态Ni原子核外电子排布是1s22s22p63s23p63d84s2,则Ni2+的价电子排布式为3d8,故A正确;
B.丁二酮肟的结构为,分子中含有13个单键和2个双键,共含有15个σ键,则1ml丁二酮肟含有15mlσ键,故B正确;
C.该物质中N、O原子均存在孤电子对,故C正确;
D.丁二酮肟镍中存在共价键、配位键、氢键三种作用力,氢键不属于化学键,故D错误;
答案选D。
12.利用分子间作用力形成超分子进行“分子识别”,实现分子分离,是超分子化学的重要研究和应用领域。如图表示用“杯酚”对和进行分离的过程,下列对该过程的说法错误的是
A.能溶于甲苯,不溶于甲苯B.能与“杯酚”形成超分子
C.不能与“杯酚”形成超分子D.“杯酚”能够循环使用
【答案】A
【解析】A.由题图可知,能够与“杯酚”通过分子间作用力形成超分子,而不能,与“杯酚”形成的超分子不能溶于甲苯,但不能证明是否能溶于甲苯,A项错误;
B.由题图可知,能够与“杯酚”通过分子间作用力形成超分子,故B正确;
C.由题图可知,不能够与“杯酚”通过分子间作用力形成超分子,故C正确;
D.通过溶剂氯仿的作用,破坏“杯酚”与形成的超分子,可实现将与分离,且“杯酚”能够循环使用,D项正确;
答案选A。
13.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是________,配位原子是________,配位数是________,它的电离方程式是_____________。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是____________________________________。
(3)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_________。 (用离子方程式表示,已知AlFeq \\al(3-,6)在溶液中可稳定存在)。
(5)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_____(填元素符号)。
【答案】(1)Ag+ N 2 [Ag(NH3)2]OH===[Ag(NH3)2]++OH-
(2)先产生白色沉淀,加入氨水后,白色沉淀溶解
(3)配位键 N (4)3CaF2+Al3+===3Ca2++AlFeq \\al(3-,6) (5)O
【解析】在配合物[Ag(NH3)2]OH中,中心离子是Ag+,配位原子是NH3分子中的N原子,配位数是2。
(3)Ni2+与NH3之间形成共价键时Ni2+提供空轨道,N提供孤电子对,形成配位键。(4)CaF2中存在沉淀溶解平衡:CaF2(s)Ca2+(aq)+2F-(aq),溶液中的F-与Al3+形成配位离子AlFeq \\al(3-,6),使沉淀溶解平衡向右移动,导致氟化钙溶解。(5)H2O分子中的O原子有孤电子对,能与Cr3+形成配位键。
14.无水CCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CCl2,故常在实验室中用作吸湿剂和空气湿度指示剂:CCl2(深蓝色)+xH2O=CCl2·xH2O(粉红色),现有65 g无水CCl2,吸水后变成CCl2·xH2O119 g。
(1)水合物中x=___________。
(2)已知该水合物中C2+配位数为6,将等浓度等体积的CCl2溶液与硝酸银溶液混合并充分反应后,取上层清液再滴加硝酸银溶液没有沉淀产生,则该水合物化学式可表示为___________,该化合物配体是___________(写化学式),该晶体含有的化学键有___________。
A.离子键 B.共价键 C.配位键 D.氢键 E.金属键
【答案】(1)6
(2) [C(H2O)5Cl]Cl·H2O H2O、Cl- ABC
【解析】
(1)65 g无水CCl2的物质的量n(CCl2)=,吸收水的质量m(H2O)=119 g-65 g=54 g,n(H2O)=,n(CCl2):n(H2O)=0.5 ml:3 ml=1:6,故CCl2·xH2O中结晶水的数目x=6;
(2)将等浓度等体积的CCl2溶液与硝酸银溶液混合并充分反应后CCl2、AgNO3的物质的量相等。取上层清液再滴加硝酸银溶液没有沉淀产生,说明晶体中的两个Cl-中只有1个是外界离子,另一个Cl-为内界配离子,由于该水合物中C2+配位数为6,则该水合物化学式可表示为[C(H2O)5Cl]Cl·H2O;该配合物的配位体是H2O、Cl-,该晶体是盐,属于离子化合物,外界Cl-与配离子之间以离子键结合;在内界离子中,中心C2+与配位键H2O、Cl-之间以配位键结合,在配位体H2O中H、O原子之间以共价键结合,故该晶体中含有的化学键有离子键、共价键、配位键,合理选项是ABC。
高中人教版 (2019)第一节 原子结构同步测试题: 这是一份高中人教版 (2019)<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构同步测试题</a>,共19页。
人教版 (2019)选择性必修2第一节 原子结构同步训练题: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构同步训练题</a>,共19页。
高中化学人教版 (2019)选择性必修2第一节 原子结构达标测试: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002442_t7/?tag_id=28" target="_blank">第一节 原子结构达标测试</a>,共10页。试卷主要包含了下列叙述不正确的是,下列说法正确的是等内容,欢迎下载使用。













