
黑龙江省哈尔滨市第九中学校2024届高三下学期第二次模拟考试化学试卷含答案
展开可能用到的相对原子质量:H―1 C―12 O―16 Na―23 S―32 Cl―35.5 As―75 Ta―181
Ⅰ卷(共45分)
一、单项选择题(每小题只有1个选项符合题意,每小题3分)
1.中华传统文化博大精深,也蕴含着很多化学知识,下列说法中错误的是( )
A.《天工开物》中描述“凡白土曰垩土,为陶家精美启用”,其中“陶”是传统硅酸盐材料
B.《汉书》中记载“今世有白铜,盖点化为之,非其本质”,白铜属于铜的合金
C.《周礼》中描绘了“煤饼烧蛎房成灰”,煅烧贝壳发生的是氧化还原反应
D.宋代名画《莲塘乳鸭图》中描绘了缂丝的场景,丝的主要成分是蛋白质
2.下列化学用语或表述正确的是( )
A.沸点:对羟基苯甲醛<邻羟基苯甲醛B.硅原子轨道电子云图:
C.酸性:D.基态Se的简化电子排布式为:
3.设为阿伏加德罗常数的值。下列说法正确的是( )
A.足量水与7.8g完全反应,转移的电子数为
B.标准状况下,4.48L中所含氧原子数为
C.取0.1ml乙醇与0.1ml乙酸充分进行酯化反应,生成的乙酸乙酯分子数为
D.向1LpH=12的氨水中加入足量,反应后溶液中数目为
4.下列离子方程式能正确表示该化学反应过程的是( )
A.向硫化钠溶液中通入过量的:
B.硫酸亚铁溶液中加入产生沉淀:
C.向含AgCl的悬浊液中加入足量氨水:
D.溶于溶液的主要反应:
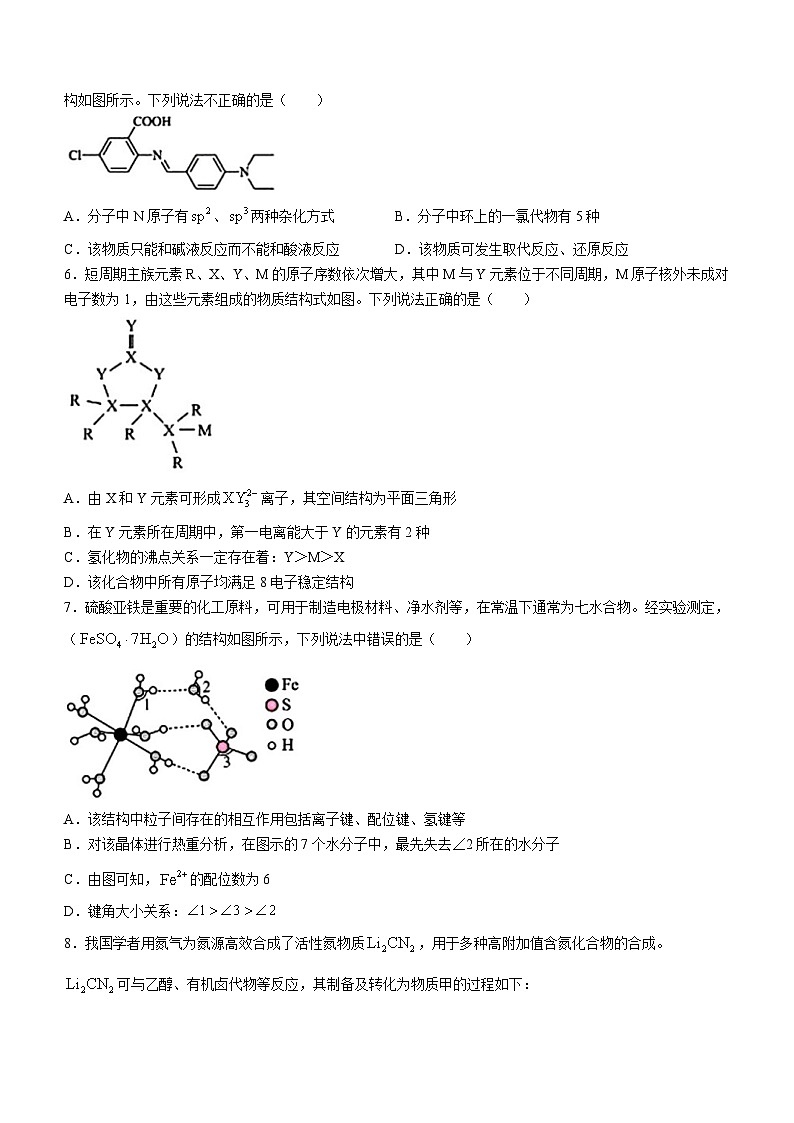
5.我国科学家提出的聚集诱导发光机制已成为研究热点之一,一种具有聚集诱导发光性能的物质,其分子结构如图所示。下列说法不正确的是( )
A.分子中N原子有、两种杂化方式B.分子中环上的一氯代物有5种
C.该物质只能和碱液反应而不能和酸液反应D.该物质可发生取代反应、还原反应
6.短周期主族元素R、X、Y、M的原子序数依次增大,其中M与Y元素位于不同周期,M原子核外未成对电子数为1,由这些元素组成的物质结构式如图。下列说法正确的是( )
A.由X和Y元素可形成离子,其空间结构为平面三角形
B.在Y元素所在周期中,第一电离能大于Y的元素有2种
C.氢化物的沸点关系一定存在着:Y>M>X
D.该化合物中所有原子均满足8电子稳定结构
7.硫酸亚铁是重要的化工原料,可用于制造电极材料、净水剂等,在常温下通常为七水合物。经实验测定,()的结构如图所示,下列说法中错误的是( )
A.该结构中粒子间存在的相互作用包括离子键、配位键、氢键等
B.对该晶体进行热重分析,在图示的7个水分子中,最先失去∠2所在的水分子
C.由图可知,的配位数为6
D.键角大小关系:
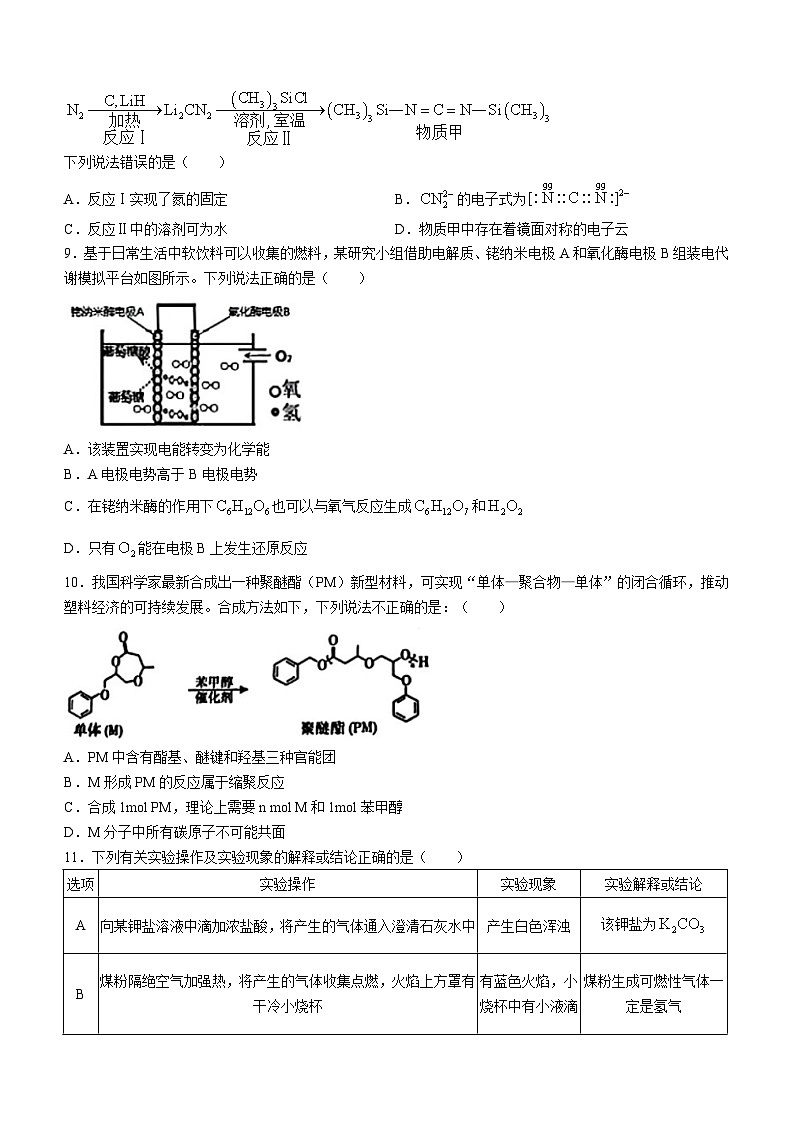
8.我国学者用氮气为氮源高效合成了活性氮物质,用于多种高附加值含氮化合物的合成。
可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
下列说法错误的是( )
A.反应Ⅰ实现了氮的固定B.的电子式为
C.反应Ⅱ中的溶剂可为水D.物质甲中存在着镜面对称的电子云
9.基于日常生活中软饮料可以收集的燃料,某研究小组借助电解质、铑纳米电极A和氧化酶电极B组装电代谢模拟平台如图所示。下列说法正确的是( )
A.该装置实现电能转变为化学能
B.A电极电势高于B电极电势
C.在铑纳米酶的作用下也可以与氧气反应生成和
D.只有能在电极B上发生还原反应
10.我国科学家最新合成出一种聚醚酯(PM)新型材料,可实现“单体—聚合物—单体”的闭合循环,推动塑料经济的可持续发展。合成方法如下,下列说法不正确的是:( )
A.PM中含有酯基、醚键和羟基三种官能团
B.M形成PM的反应属于缩聚反应
C.合成1ml PM,理论上需要n ml M和1ml苯甲醇
D.M分子中所有碳原子不可能共面
11.下列有关实验操作及实验现象的解释或结论正确的是( )
12.食用油是人们日常饮食中必需的消费品,为了保障其安全性,可以通过库仑测氯仪(下图)测定其中氯含量。检测前,电解质溶液中的保持定值时,电解池不工作。待测物质进入电解池后与反应,测氯仪便立即自动进行电解到,又回到原定值,测定结束。下列说法错误的是( )
A.电解池中的阳极反应是
B.处理后的食用油样品氯转化为HCl,通入测氯仪中发生反应
C.样品中存在的会导致测定结果偏大,用碘水处理样品可以消除误差
D.样品为ag,电解消耗的电量为x库仑,样品中氯的含量(按含氯元素计)为
(已知:电解中转移1ml电子所消耗的电量为F库仑)
13.甲烷与氧气直接选择性转化为甲醇是当今催化领域的“梦想反应”,科学家用负载双组份催化剂(纳米金和纳米簇)在室温和光照下完成了上述反应,选择性高达95%。机理如图A所示。下列说法正确的是( )
A.Au表面反应为:
B.图A中含碳微粒只存在2种杂化方式
C.有无催化剂纳米簇对合成甲醇的产量无影响
D.图B是通过和同位素示踪分析氧化甲烷过程中的产品质谱测试图,由图可知体系中产品中氧主要来源于
14.常温下,向某溶剂(不参与反应)中加入一定量X、Y和M,所得溶液中同时存在如下平衡:
①②③。
X、Y的物质的量浓度c随时间反应t的变化关系如图所示,400s时反应体系达到平衡状态。下列说法正确的是( )
A.100~400s内,约为
B.100s时反应③的逆反应速率大于正反应速率
C.若再向容器中加入上述溶剂,平衡后Y的物质的量不变
D.若反应③的活化能,则X比Y更稳定
15.常温下,某学习小组用HA(强酸)调节pH,将AgB的溶解度()的变化数据绘制出曲线如图所示。在酸性条件下忽略的水解。已知:,。下列说法错误的是( )
A.x的值:
B.b点的溶液中存在:
C.水的电离程度:
D.c点的溶液中:或均正确
Ⅱ卷(共55分)
二、填空题
16.(14分)钽(Ta)和铌(Nb)为高新技术产业的关键元素,其单质的性质相似。一种以花岗伟晶岩型铌钽矿(主要成分为、、和少量的FeO、CaO、MgO等)为原料制取钽和铌的流程如图一:
“浸取”后的浸出液中含有、两种二元强酸。
已知:①MIBK为甲基异丁基酮:
②,,。
(1)加快“浸取”速率可采取的措施是______。
(2)“浸取”时得到的“浸渣”主要成分为______(填化学式),“浸取”时还会产生“废气”,“废气”中除了挥发出的HF还可能有______(填化学式)。与氢氟酸反应的离子方程式为______。
(3)“萃取”时,若萃取剂MIBK的量一定,______(填“一次萃取”或“少量多次萃取”)的萃取效率更高。
(4)用金属钠还原制取金属铌的化学方程式为______。
(5)钽形成的晶体TaAs在室温下拥有超高的空穴迁移率和较低的电子迁移率。TaAs的晶胞结构如图二所示。诗写出As的配位数:______。晶体的密度为______(列出计算式,阿伏伽德罗常数的值为)。
17.(14分)苯乙酮是一种重要的化工原料,可用于制造香皂和塑料的增塑剂。实验室可用苯和乙酸酐为原料,在无水催化下加热制得:
过程中还有等副反应发生
步骤1.【制备】
向仪器A中迅速加入13g粉状无水和0.18ml无水苯。在搅拌下将0.04ml乙酸酐慢慢滴加到A中,严格控制滴加速率,必要时用冷水冷却,待反应缓和后,在70-80℃下加热回流1小时,直至无HCl气体逸出为止。
步骤2.【分离提纯】
(1)将反应混合物冷却到室温,倒入含盐酸的冰水中使胶状物完全溶解。
(2)再将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL),合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水干燥。
(3)将苯乙酮粗产品放入蒸馏烧瓶中,先用水浴法蒸馏回收物质B,稍冷后改用空气冷凝管蒸馏收集馏分,产量约4.2g。
回答下列问题:
(1)盛装醋酸酐的仪器名称是______。从步骤1的操作中可以看出,苯与乙酸酐的反应为______反应(填“吸热”或“放热”)。
(2)图一装置中的作用是(用化学方程式和必要文字解释)______。
(3)用15mL10%的NaOH溶液洗涤主要是为了除去______(填物质名称)。
(4)步骤2水浴法蒸馏回收的物质B为______。
(5)本实验为收集产品用了减压蒸馏装置,如图二所示,其中毛细管的作用是______,减压蒸馏中需要控制一定温度,应该为______(填字母代号)。
A.202℃B.220℃C.175℃
(6)本次实验苯乙酮的产率为______。
18.(13分)资源化利用有助于实现“双碳目标”。选择不同条件,利用和可获得甲醇、甲醛等多种有机物。回答下列问题:
(1)工业上在Cu-ZnO催化下利用发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.
Ⅱ.
①已知反应Ⅰ过程中正反应活化能为76kJ/ml,逆反应活化能为130.4kJ/ml,则反应Ⅰ的______。
②若反应的,则下列温度下该反应能自发进行的是______(填标号)。
A.120℃B.137℃C.200℃D.500℃
③按照投料,在恒容密闭容器中进行反应,的平衡转化率随温度和压强的变化如图所示,则压强、、由大到小的顺序为______。在压强下,温度高于300℃之后,随着温度升高,的平衡转化率增大,原因是______。
(2)T℃(T>100℃),在容积为2L的恒容密闭容器中充入1ml和一定量,在一定条件下只发生可逆反应Ⅰ。若起始时容器内气体压强为1.2kPa,达到平衡时,的分压与起始投料比的变化关系如下图所示。
当起始时,反应达到平衡时,平衡常数______(列出计算式)。
(3)甲醇催化制取丙烯()的过程中发生如下反应:
Ⅰ.
Ⅱ.
已知Arrhenius经验公式为(Ea为活化能,k为速率常数,R和C为常数),反应Ⅰ的Arrhenius经验公式的实验数据如图中直线a所示,则该反应的活化能______。当改变外界条件时,实然数据如图中直线b所示,则实然可能改变的外界条件是______。
19.(14分)氯维地平是治疗高血压的药物,有机物I是合成该药物的一种重要中间体,其一种合成路线如下图所示:
已知:
(1)若以乙酰基()为取代基,化合物F的名称为______。
(2)化合物D中含氮官能团名称为______、______。
(3)由E生成G分两步进行:①E+F→M;②M→G+N。则②的反应类型为______。
(4)酮式和烯醇式存在互变异构:(R为烃基或氢),但大多数情况下酮式是主要存在形式。则化合物C的结构简式为______。
(5)G与足量在Ni催化下反应的化学方程式为______。
(6)胺类化合物K与D互为同分异构体,则符合下列条件的K有______种。
①只含两种官能团,且同种官能团的氢原子化学环境完全相同;
②遇溶液显紫色
(7)键迁移重排是有机反应中一类重要反应,有机物X→Y的键迁移重排异构化反应如图所示,
据此推测的异构化反应产物的结构简式为______。
哈九中2024届高三学年第二次模拟考试化学答案
16.(14分) (1)将钽铌矿磨碎(“升高浸取时的温度”等合理答案也可)(1分)
(2)CaF2、MgF2(2分,每个化学式1分,写CaSO4不得分),
SiF4 (2分),Ta2O3+14HF=4H++2TaF+5H2O(2分)
(3)少量多次萃取(1分)
(4) (2分)
(5 )6(2分) (其他合理计算式给分)(2分)
17.(14分)(1)恒压滴液漏斗(1分) 放热(1分)
(2)防止锥形瓶内的水蒸气进入三颈烧瓶中使醋酸酐和Al3+水解,(CH3CO)2O+ H2O 2CH3COOH,AlCl3+ 3H2O⇌Al(OH)3+3HCl (3分)(文字解释1分,两个方程式各一分)
(3)盐酸、醋酸(2分) (4)苯(1分)
(5)防止暴沸,搅拌(2分) (少一项扣一分) C(2分)
(6) 87.5% (2分)
18.(13分)
(1)-54.4 KJ/ml (本次不写单位可不扣分)(2分) ② AB (2分)
③ P3>P2>P1 (1分)
反应I是放热反应,反应是Ⅱ吸热反应,升高温度,反应I平衡逆向移动,反应Ⅱ平衡正向移动,温度高于300℃之后,反应Ⅱ起主导作用,CO2的平衡转化率主要由反应Ⅱ决定(2分)
(2)0.24××0.16(2分)
(3)31.0 (2分) 使用更高效的催化剂 (答使用催化剂不得分)(2分)
19.(14分)(1)乙酰(基)乙酸甲酯(2分)
(2)氨基(1分)氰基(1分)
(3)消去反应(2分)
(4)(2分)
(5)+5H2(2分)
(6)4(2分)
(7)(2分)
选项
实验操作
实验现象
实验解释或结论
A
向某钾盐溶液中滴加浓盐酸,将产生的气体通入澄清石灰水中
产生白色浑浊
该钾盐为
B
煤粉隔绝空气加强热,将产生的气体收集点燃,火焰上方罩有干冷小烧杯
有蓝色火焰,小烧杯中有小液滴
煤粉生成可燃性气体一定是氢气
C
向2mL溶液中滴加2滴KSCN溶液,再滴加5滴5%的溶液
滴加过程中溶液先变红后褪色
不能说明反应后不存在
D
将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,久置光照
试管内液面上升
甲烷和氯气发生取代反应
名称
相对分子质量
熔点/℃
沸点/℃
密度/
溶解度
乙酸酐
102
―73
140
1.082
微溶于水,易水解
苯
78
5.5
80.5
0.879
不溶于水
苯乙酮
120
20.5
202
1.028
微溶于水
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C
B
A
B
C
A
D
C
C
B
C
C
D
B
C
黑龙江省哈尔滨市第九中学校2024届高三下学期第二次模拟考试化学试卷+(无答案): 这是一份黑龙江省哈尔滨市第九中学校2024届高三下学期第二次模拟考试化学试卷+(无答案),共10页。试卷主要包含了8g完全反应,转移的电子数为,48L中所含氧原子数为,1ml乙醇与0等内容,欢迎下载使用。
黑龙江省哈尔滨市第九中学校2024届高三下学期第二次模拟考试化学试卷+: 这是一份黑龙江省哈尔滨市第九中学校2024届高三下学期第二次模拟考试化学试卷+,共5页。
20,黑龙江省哈尔滨市第九中学校2023-2024学年高三下学期开学考试化学试题: 这是一份20,黑龙江省哈尔滨市第九中学校2023-2024学年高三下学期开学考试化学试题,共11页。试卷主要包含了单项选择题,填空题等内容,欢迎下载使用。












