




江西省赣州市兴国中学2023-2024学年高一下学期第一次月考化学试题(Word版附解析)
展开注意事项:
1.答卷前,考生务必将自己的姓名、考场号、座位号、准考证号填写在答题卡指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。
可能用到的相对原子质量:Na-23
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是最符合题目要求的。
1. 下列生产生活中的反应不涉及氧化还原反应的是
A. 常温下用铝制容器盛装浓硫酸B. ClO2用作自来水消毒剂
C. 实验室制备少量氨气D. 豆科植物根瘤菌固氮
【答案】C
【解析】
【详解】A.常温下,铝和浓发生钝化反应生成铝的氧化物,A项涉及氧化还原反应,故A错误;
B.具有强氧化性可杀死自来水中的病菌,起到消毒作用,B项涉及氧化还原反应,故B错误;
C.实验室使用氯化铵和氢氧化钙固体或浓氨水等加热制备少量氨气,C项不涉及氧化还原反应,故C正确;
D.固氮是将游离态的氮转化为化合态的氮的过程,D项涉及氧化还原反应,故D错误;
故选C。
2. 下列关于试剂瓶的使用描述错误的是
A. S可用甲储存B. 浓硫酸可用乙储存
C. 浓硝酸可用丙储存D. NaOH溶液可用丁储存
【答案】D
【解析】
【详解】A.S是固体试剂可用广口瓶储存,A正确;
B.浓硫酸可保存在无色玻璃细口瓶中,B正确;
C.浓硝酸具有挥发性且见光易分解,可用棕色玻璃细口瓶保存,C正确;
D.溶液不应存放在广口瓶中,D错误;
故选D。
3. 下列物质的用途与性质不相对应的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.博物馆将文物保存在中,利用的稳定性,防止文物被氧化而损坏,性质和用途对应,A正确;
B.用溶液刻蚀铜电路板,与Cu还原溶液有关,与铁金属性比铜强无关,性质和用途不对应,B错误;
C.具有还原性,防止葡萄酒被氧化,果香味消失,性质和用途对应,C正确;
D.具有放射性,利用其衰变原理,可以测定文物年代,性质和用途对应,D正确;
故选B
4. 根据所学知识,下列元素的单质与氧气直接反应能生成酸性氧化物的是
A. CuB. SC. AlD. N
【答案】B
【解析】
【详解】A.铜和氧气反应生成氧化铜,为碱性氧化物,故A错误;
B.硫和氧气反应生成二氧化硫,为酸性氧化物,故B正确;
C.铝和氧气反应生成氧化铝,为两性氧化物,故C错误;
D.氮气和氧气反应生成一氧化氮,为不成盐氧化物,故D错误;
故选B。
5. 下列离子组在指定条件下一定能大量共存的是
A. 强酸溶液中:Na+、K+、SO、Cl-
B. 使紫色石蕊溶液变红的溶液:Fe2+、Mg2+、NO、Cl-
C. 澄清透明的溶液中:Fe3+、Mg2+、Br-、Cl-
D. 加入铝粉产生大量氢气的溶液中:K+、Na+、NO、SO
【答案】C
【解析】
【详解】A.强酸溶液中,不能大量共存,A项错误;
B.使紫色石蕊溶液变红的溶液显酸性,酸性条件下,可被氧化,B项错误;
C.澄清透明的溶液中,、、、可大量共存,C项正确;
D.若含且为酸性时,与铝反应不能产生大量氢气,D项错误;
故选C。
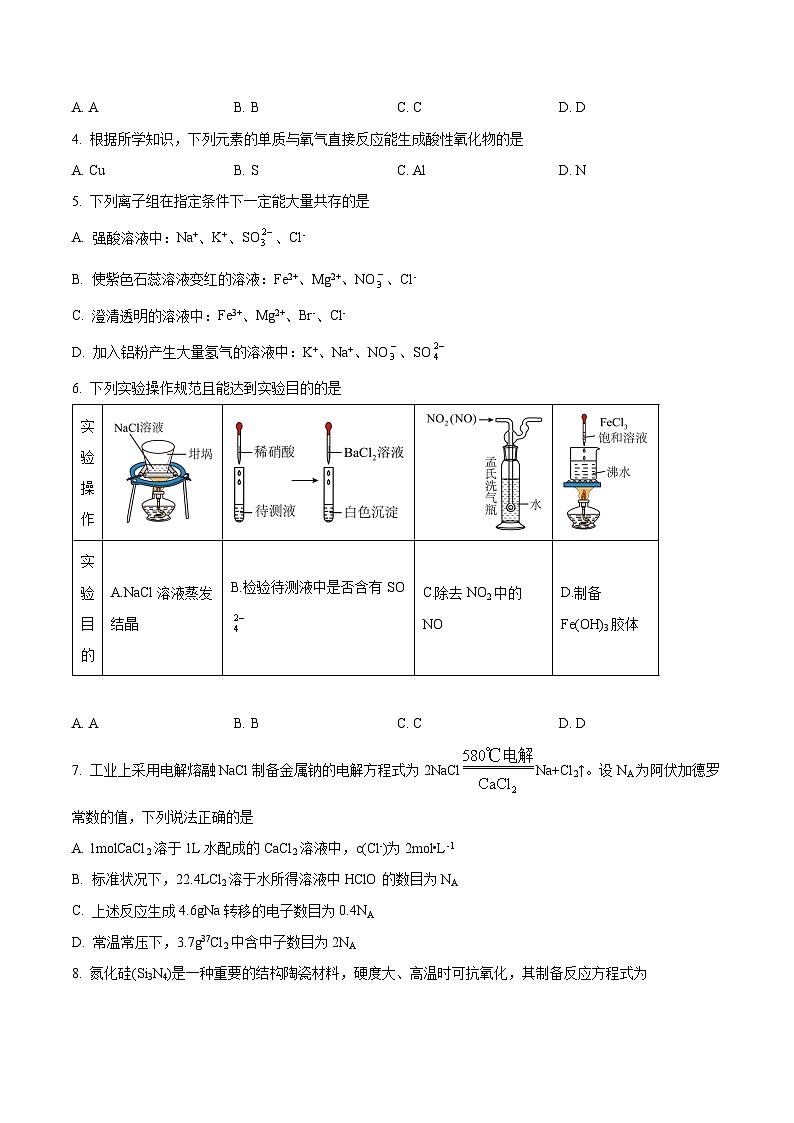
6. 下列实验操作规范且能达到实验目的的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.蒸发结晶应选蒸发皿而不是坩埚,A项错误;
B.检验待测液中是否含有,应用稀盐酸酸化,排除干扰,若用稀硝酸酸化,可使转化为,造成干扰,B项错误;
C.通过蒸馏水后,与水反应生成和,C项错误;
D.向沸水中滴加饱和溶液制备胶体,D项正确;
故选D。
7. 工业上采用电解熔融NaCl制备金属钠的电解方程式为2NaClNa+Cl2↑。设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mlCaCl2溶于1L水配成的CaCl2溶液中,c(Cl-)为2ml•L-1
B. 标准状况下,22.4LCl2溶于水所得溶液中HClO的数目为NA
C. 上述反应生成4.6gNa转移的电子数目为0.4NA
D. 常温常压下,3.7g37Cl2中含中子数目为2NA
【答案】D
【解析】
【详解】A.溶于1L水配成的溶液体积不是1L,故该溶液中的不是,A错误;
B.标准状况下,22.4L溶于水所得溶液中的物质的量小于,的数目小于,B错误;
C.生成4.6gNa转移的电子数为,C错误;
D.3.7g的物质的量为,其中含中子数目为,D正确;
故选D。
8. 氮化硅(Si3N4)是一种重要的结构陶瓷材料,硬度大、高温时可抗氧化,其制备反应方程式为3SiO2+6C+2N2Si3N4+6CO,下列有关说法错误的是
A. 氮化硅可用作耐高温材料、涂层和磨料
B. SiO2既不作氧化剂也不作还原剂
C. 氧化剂和还原剂的物质的量之比为3:1
D. 当生成标准状况下6.72LCO时,反应消耗0.1mlN2
【答案】C
【解析】
【详解】A.根据氮化硅的性质可判断其可用作耐高温材料、涂层和磨料,A正确;
B.由反应方程式可知,既不作氧化剂也不作还原剂,B正确;
C.作氧化剂,C作还原剂,二者的物质的量之比为1:3,C错误;
D.当生成标准状况下6.72L()时,根据前述化学方程式可知消耗,D正确;
故选C。
9. 下列事实不能用相应的化学用语解释的是
A. 加热滴加酚酞的浓氨水,溶液红色变浅:NH3•H2ONH+OH-
B. 浓硝酸应在阴凉处储存:4HNO3(浓)4NO2↑+O2↑+2H2O
C. 同时打开邻近的盛有浓氨水和浓盐酸的试剂瓶塞,稍后空中出现白烟:NH3+HCl=NH4Cl
D. 向新制氯水中通入SO2后氯水褪色:SO2+Cl2+2H2O=H2SO4+2HCl
【答案】A
【解析】
【详解】A.浓氨水受热分解的化学方程式为,A项错误;
B.浓硝酸受热分解4HNO3(浓)4NO2↑+O2↑+2H2O,B项正确;
C.浓氨水和浓盐酸易挥发,发生反应:而生成白烟,C项正确;
D.新制氯水中通入后发生反应:,氯水褪色,D项正确;
故选A。
10. 部分含硫化合物的分类与相应化合价关系如图所示。下列推断正确的是
A. 存在c→g的转化
B. c→e→f是形成酸雨的唯一途径
C. 自然界不存在单质b
D. a只具有还原性
【答案】A
【解析】
【分析】根据化合价和含硫物质的关系可判断a是H2S,b是S,c是SO2,d是SO3,e是H2SO3,f是H2SO4,g使亚硫酸盐,h是硫酸盐,据此解答。
【详解】A.与溶液反应可生成或,A项正确;
B.硫酸型酸雨形成的主要途径:①;②,B项错误;
C.在火山口附近有S单质存在,C项错误;
D.a,中H为价,S为价,既具有氧化性又具有还原性,D项错误;
故选A。
11. 按如图装置进行实验,将70%浓硫酸全部加入Y形试管Na2SO3中,关闭活塞。B、C处分别为蘸取相应溶液的试纸,下列说法错误的是
A. A处品红溶液褪色后,加热可恢复红色
B. B处试纸紫色褪去
C. C处现象可验证SO2被氧化
D. 若将D中NaOH溶液换为Na2S溶液,则D中会有淡黄色沉淀生成
【答案】B
【解析】
【分析】装置A中,浓硫酸与亚硫酸钠会反应生成二氧化硫气体,二氧化硫能使A中品红溶液褪色,二氧化硫溶于水会与水反应生成亚硫酸,使B处紫色石蕊变红,二氧化硫具有还原性能够使C处的高锰酸钾褪色,二氧化硫有毒,装置D的氢氧化钠用于尾气处理。
【详解】A.具有漂白性,能使品红褪色,其漂白性具有不稳定性,加热可恢复红色,A正确;
B.溶于水显酸性,使紫色石蕊试纸由紫色变为红色,不能漂白酸碱指示剂,试纸不会褪色,B错误;
C.C处高锰酸钾试纸褪色可验证被氧化,离子方程式为,C正确;
D.与反应生成S,D中会有淡黄色沉淀生成,D正确;
故选B。
12. 某浅海沉积岩矿物的化学式为X5(YZ4)3W,X、Y、Z、W四种元素为不同主族前20号元素且原子半径依次减小,仅Z、W位于同周期,Z是地壳中含量最多的元素,Y原子的M层有5个电子,原子序数满足X+Y+Z+W=52。下列说法正确的是
A. 常温常压下,W单质为黄绿色气体
B. W单质比所在主族其他单质与氢气化合更难
C. 推测XZ2可与水发生反应放出氧气
D. Y的最高价氧化物对应的水化物是强酸
【答案】C
【解析】
【分析】由Z是地壳中含量最多的元素,可知Z为O,Z、W位于同周期,且W在四种元素中半径最小,则W为F,根据Y原子的M层有5个电子可知Y为P,原子序数满足X+Y+Z+W=52,则X为Ca。
【详解】A.常温常压下,氟气为浅黄绿色气体,A错误;
B.氟单质比所在主族其他单质与氢气化合更容易,暗处即可化合,B错误;
C.推测与性质相似,都可与水发生反应放出氧气,C正确;
D.Y为P,P的最高价氧化物对应的水化物为,是中强酸,D错误;
故选C。
13. 经处理后的火电厂粉煤灰的主要氧化物组成为Al2O3、FeO、Fe2O3。从粉煤灰中提取氧化铝的工艺流程如图所示,下列说法错误的是
A “碱浸”可用NaOH溶液或浓氨水B. “溶液”中含有[Al(OH)4]-
C. “操作X”向“溶液”中通入过量CO2D. 流程中涉及分解反应
【答案】A
【解析】
【分析】粉煤灰的主要成分为Al2O3、FeO、Fe2O3,碱浸氧化铝溶解生成偏铝酸盐,滤渣为FeO、Fe2O3,滤液通入过量的CO2气体,偏铝酸盐转化为氢氧化铝,过滤,得到氢氧化铝,氢氧化铝煅烧得到氧化铝,氧化铝电解得到铝。
【详解】A.是两性氧化物,可溶于强碱,不能溶于弱碱,A项错误;
B.经强碱“碱浸”发生反应:,B项正确;
C.“操作X”向“溶液”中通入过量,最终生成,C项正确;
D.“煅烧”及“电解”制铝的反应均为分解反应,D项正确;
故选A。
14. 某天然气电厂对废气回收利用,在催化剂作用下重新合成天然气作为燃料再利用,反应机理如图所示。下列说法错误的是
A. 步骤-2中存在极性键的断裂、Ⅱ-3中存在非极性键断裂
B. 步骤Ⅱ-4存在极性键生成
C. 当消耗1mlCO2生成1mlCH4时,转移8ml电子
D. CO2、N2、CH4分子中各原子均满足8电子稳定结构
【答案】D
【解析】
【详解】A.步骤Ⅱ-2中断裂碳氧极性键,Ⅱ-3中断裂氢氢非极性键,A正确;
B.步骤Ⅱ-4生成的、中均含有极性键,B正确;
C.当消耗时,消耗,生成,电子转移,C正确;
D.甲烷中的H原子只有2个电子,D错误;
故选D。
二、非选择题:本题共4小题,共58分。
15. 如表所示为元素周期表的前四周期部分,根据图示结合所学知识回答下列问题:
(1)h、i的简单离子半径由大到小的顺序为_______(填离子符号)。
(2)i、e、f的最高价氧化物对应的水化物的碱性由强到弱的顺序是_______(填化学式)。
(3)用电子式表示e和h形成离子化合物的过程:________。
(4)非金属性:b_______g(填“>”或“<”);以如图装置进行实验比较b、g对应的最高价氧化物对应水化物的酸性,则试剂A为_______(填试剂名称),试剂B为_______。
(5)X处包含_______纵列,_______个族。
(6)i单质与d的简单氢化物反应的离子方程式为_______。
【答案】15. Cl->K+
16. KOH>NaOH>Al(OH)3
17. 18. ①. > ②. 稀盐酸(或稀硝酸) ③. 饱和NaHCO3溶液(或饱和碳酸氢钠溶液)
19. ①. 10 ②. 8
20. 2K+2H2O=2KOH+H2↑
【解析】
【分析】根据题中元素周期表元素位置可知,a为H,b为C,c为N,d为O,e为Na,f为Al,g为Si,h为Cl,i为K,X包含副族和第Ⅷ族。
【小问1详解】
Cl、K的简单离子电子层结构完全相同,原子序数越大,离子半径越小,离子半径由大到小的顺序为。
【小问2详解】
金属性:,K、Na、Al的最高价氧化物对应的水化物分别为、、,碱性依次减弱,即
【小问3详解】
e为Na、h为Cl,用电子式表示两者形成的形成过程为。
【小问4详解】
C与Si位于同一主族,非金属性;通过比较最高价含氧酸酸性的方法比较非金属性,比较最高价含氧酸的酸性的方法是由“较强酸制较弱酸”;将稀盐酸滴入到圆底烧瓶中与碳酸钙反应生成,以饱和溶液除去挥发的,再通入到硅酸钠溶液中生成硅酸,产生白色沉淀,离子方程式为或;说明酸性:,即非金属性:。
【小问5详解】
X处包含有7个副族和第Ⅷ族,共有10个纵列,8个族。
【小问6详解】
K与水反应的离子方程式为
16. 如图为某些中学常见物质的转化关系(部分反应条件或生成物略去)。其中A、B、C为常见单质,其余物质为化合物,C为黑色固体,气体D溶于水所得溶液显碱性,E为常用调味剂且焰色试验为黄色火焰,J为细小的白色晶体,常用作食物膨松剂,F常温下为无色无味液体。回答下列问题:
(1)H中含有的化学键为_______(填“离子键”“共价键”或“离子键和共价键”)。
(2)实验室检验I中所含阳离子的方法为_________。
(3)反应①的化学方程式为________,以气体D与蒸馏水利用如图装置进行喷泉实验,引发喷泉的操作为________。
(4)反应②的化学方程式为________,其中氧化产物和还原产物的物质的量之比为________。
(5)反应④的化学方程式为_______,该反应可以发生的原因为________。
(6)向J的溶液中通入过量H时发生反应的离子方程式为________。
【答案】(1)共价键 (2)取少量NH4Cl于试管,加入少量NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,如果试纸变蓝,则可以证明含有NH
(3) ①. ②. 打开止水夹,挤压胶头滴管,使水进入烧瓶
(4) ①. C+2H2SO4(浓)CO2↑+2SO2↑+2H2O ②. 1:2
(5) ①. NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl ②. NaHCO3的溶解度较小,析出促进反应进行
(6)HCO+SO2=HSO+CO2
【解析】
【分析】图中A、B、C为常见单质,其余物质为化合物,C为黑色固体结合其与浓硫酸反应推测其为单质C,气体D溶于水显碱性,D为,E为常用调味剂且焰色试验为黄色火焰,E为,J为细小白色晶体且可用作食物膨松,J为,F常温下为无色无味液体,对照碳和浓硫酸的反应可知,F为,H为,G为,A和B分别为和,I为。
【小问1详解】
H为,中含有的化学键为共价键。
【小问2详解】
实验室检验中所含的方法为取少量于试管,加入少量溶液并加热,在试管口用红色石蕊试纸检验,如果试纸变蓝,则可以证明含有。
【小问3详解】
反应①为和合成的反应,化学方程式为,引发氨喷泉实验的操作为打开止水夹,挤压胶头滴管,使水进入烧瓶。
【小问4详解】
反应②的化学方程式为,其中氧化产物为,还原产物为,物质的量之比为1:2。
【小问5详解】
反应④是侯氏制碱法,化学方程式为,该反应可以发生的原因为的溶解度较小,析出促进反应进行。
【小问6详解】
向溶液中通入过量时,生成和,发生反应的离子方程式为。
17. 实验室制备SO2并探究SO2的性质,利用如图装置进行实验。
回答下列问题:
(1)盛装浓硫酸的仪器名称为________,装置A中的化学方程式为________。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为________。
(3)若试剂a为BaCl2溶液,则B中________(填“能”或“不能”)观察到有白色沉淀生成,请说明原因: _______。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:________;
②推测含Ag2SO4的原因是_______。
【答案】(1) ①. 分液漏斗 ②. Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)SO2+H2OH2SO3
(3) ①. 不能 ②. SO2与BaCl2不反应
(4) ①. 取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有Ag2SO3,若品红溶液无明显变化,则说明不含 ②. Ag2SO3可能在酸性环境中被NO氧化
【解析】
【分析】装置A中亚硫酸钠与浓硫酸反应生成二氧化硫,装置B用于探究二氧化硫的性质,装置C吸收多余的二氧化硫,防止污染环境。
【小问1详解】
实验室用浓硫酸和固体亚硫酸钠制备,盛装浓硫酸的仪器名称为分液漏斗,制备的化学方程式为。
【小问2详解】
和的反应为可逆反应:。
【小问3详解】
与不反应,故B中不能观察到有白色沉淀生成。
【小问4详解】
①取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有,若品红溶液无明显变化,则说明不含;
②具有还原性,在酸性环境中被氧化。
18. 以某铜矿石制备Cu(NO3)2晶体的工艺流程如图所示,已知铜矿石的主要成分为Cu2S和少量SiO2,滤液I中含Cu2+,滤渣I可回收单质S和SiO2。
(1)Cu2S中Cu的化合价为_______。
(2)铜矿石“氧化浸出”前需碾碎的目的是________。
(3)“滤液Ⅱ”中的金属阳离子为________。
(4)“反应”中生成Cu(NO3)2的离子方程式为________。
(5)“沉铁”后分离出沉淀的操作的名称为________,该操作在实验室进行时用到的玻璃仪器有________。
(6)“气体”与足量空气混合被水吸收过程中发生反应的化学方程式为________,其生成物可循环到上述流程中的________(填“氧化浸出”“还原”“反应”或“沉铁”)过程中再利用。
【答案】(1)+1价 (2)增大反应物的接触面积,使反应更快更充分
(3)Fe2+ (4)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(5) ①. 过滤 ②. 烧杯、漏斗、玻璃棒
(6) ①. 4NO+3O2+2H2O=4HNO3 ②. 反应
【解析】
【分析】铜矿石中的硫化亚铜与硝酸铁溶液反应生成铜离子、亚铁离子和硫单质,二氧化硅与硝酸铁溶液不反应,滤渣Ⅰ的成分是单质S和SiO2。滤液I中含Cu2+,加入过量的铁与铁离子、铜离子反应生成铜单质和亚铁离子,所以滤渣Ⅱ是铁和铜,向滤渣Ⅱ中加入稀硝酸,稀硝酸与铁、铜均能反应,生成铜离子、铁离子、一氧化氮气体,沉铁过程加入氢氧化铜消耗溶液中的氢离子,使铁离子生成氢氧化铁沉淀除去,对滤液进行一系列操作最后得到硝酸铜晶体。
【小问1详解】
根据化合价为0的原则,中Cu的化合价为价,S的化合价为价。
【小问2详解】
将铜矿石碾碎可以增大反应物的接触面积,使反应更快更充分。
【小问3详解】
“还原”过程中,Fe与、反应得到和Cu,“滤液Ⅱ”中的金属阳离子为。
【小问4详解】
“滤渣Ⅱ”中有过量的Fe和Cu,Cu与稀硝酸反应生成的离子方程式为。
【小问5详解】
分离沉淀和溶液的操作为过滤,过滤操作在实验室进行时用到的玻璃仪器有烧杯、漏斗、玻璃棒。
【小问6详解】
铁和铜与稀硝酸反应都会生成气体,与足量空气混合被水吸收制成硝酸,该过程中发生反应的化学方程式为,“反应”用到了硝酸,所以生成物可循环到上述流程的“反应”过程中。选项
物质的用途
物质的性质
A
博物馆将某些文物保存在N2中
N2性质稳定
B
用FeCl3溶液刻蚀铜电路板
铁的金属性比铜强
C
SO2用于保持葡萄酒的天然果香味
SO2具有还原性
D
C用于测定文物年代
C具有放射性
实验操作
实验目的
A.NaCl溶液蒸发结晶
B.检验待测液中是否含有SO
C.除去NO2中的NO
D.制备Fe(OH)3胶体
江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题(Word版附解析): 这是一份江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题(Word版附解析),文件包含江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题原卷版docx、江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
江西省赣州市2023-2024学年高二上学期期末考试化学试题(Word版附解析): 这是一份江西省赣州市2023-2024学年高二上学期期末考试化学试题(Word版附解析),文件包含江西省赣州市2023-2024学年高二上学期期末考试化学试题原卷版docx、江西省赣州市2023-2024学年高二上学期期末考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
江西省赣州市2023-2024学年高一上学期期末考试化学试题(Word版附答案): 这是一份江西省赣州市2023-2024学年高一上学期期末考试化学试题(Word版附答案),共7页。试卷主要包含了本卷可能用到的相对原子质量,下列实验能达到目的的是等内容,欢迎下载使用。












