

第一部分 题型17 化学反应速率与化学平衡的综合考查(含解析)2024高考化学二轮复习
展开
这是一份第一部分 题型17 化学反应速率与化学平衡的综合考查(含解析)2024高考化学二轮复习,共24页。
1.反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH<0可用于处理汽车尾气。下列说法正确的是( )
A.该反应在任何温度下都能自发进行
B.上述反应平衡常数K=eq \f(c2CO·c2NO,c2CO2·cN2)
C.其他条件相同,增大体系压强,能提高NO的平衡转化率
D.其他条件相同,提高c(CO),正反应速率加快,逆反应速率减慢
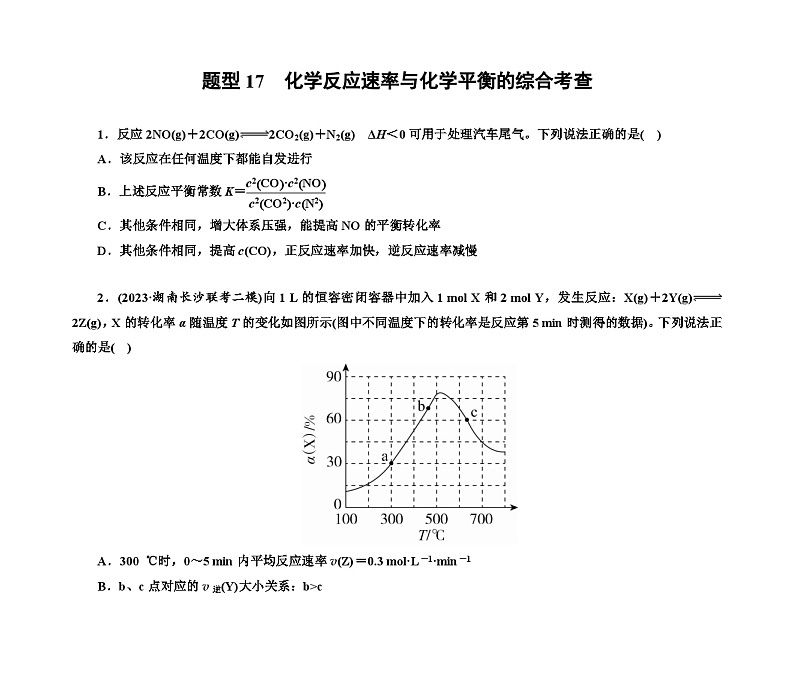
2.(2023·湖南长沙联考二模)向1 L的恒容密闭容器中加入1 ml X和2 ml Y,发生反应:X(g)+2Y(g)2Z(g),X的转化率α随温度T的变化如图所示(图中不同温度下的转化率是反应第5 min时测得的数据)。下列说法正确的是( )
A.300 ℃时,0~5 min内平均反应速率v(Z)=0.3 ml·L-1·min-1
B.b、c点对应的v逆(Y)大小关系:b>c
C.若c点时反应达到平衡状态,反应消耗p ml X(p乙
C.除0时刻外,任意时刻的压强始终满足p甲>p乙
D.该反应正反应的活化能小于逆反应的活化能
4.一定温度下,向2 L恒温恒容密闭容器中加入足量活性炭和2 ml NO2,发生反应2NO2(g)+2C(s)2CO2(g)+N2(g),部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是( )
A.曲线Ⅱ表示n(CO2)随t的变化
B.0~2 min内,v(C)=v(CO2)=0.375 ml·L-1·min-1
C.3 min时,加入催化剂可同时增大NO2的生成速率和消耗速率
D.3 min时,充入N2增大压强,该容器的气体颜色不变
5.室温下,气体M、N、P、Q之间存在如下转化关系:①MN+P;②MN+Q,反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M),(k1、k2为速率常数)。在容积为10 L的密闭容器中,反应体系中组分M、P的物质的量随时间的变化如下表所示:
下列说法正确的是( )
A.0~3 min时间段内,Q的平均反应速率为0.15 ml·L-1·min-1
B.反应开始后,体系中P和Q的浓度之比保持不变
C.平衡时M生成Q的转化率为36%
D.反应①的活化能比反应②的活化能低
6.(2023·广东汕头实验中学联考)常压下羰基化法精炼镍的原理为Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选30 ℃
D.第二阶段,Ni(CO)4分解率较低
7.(2023·广东深圳统考一模)恒容密闭容器中,n ml CO2与3n ml H2在不同温度下发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n ml CO2与6n ml H2在T1 ℃下反应,达到平衡时c(H2)0
B.温度升高,S8分解率增大,S2体积分数增大
C.向平衡体系中充入惰性气体,平衡向右移动
D.其他条件相同,S2体积分数越大,CH4平衡转化率越小
12.恒温密闭容器中,发生反应:2CO2(g)+6H2(g)eq \(,\s\up15(催化剂))C2H4(g)+4H2O(g) ΔH<0。起始时,若按照n(CO2)∶n(H2)=1∶3的投料比充入容器,测得平衡时n(H2)和n(H2O)随温度的变化如图所示。下列说法中正确的是( )
A.L线表示平衡时n(H2O)随温度的变化
B.其他条件不变时,若增大容器容积,则v正减小,v逆增大
C.x=5.16
D.使用催化剂,可降低反应的活化能,减小ΔH的值
13.(2023·河南安阳模拟)在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g)。已知该反应平衡常数与温度的关系如下表,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B.25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为0.5
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5 ml·L-1,则此时温度高于80 ℃
D.80 ℃达到平衡时,保持体积不变,向体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
14.已知反应:CH2===CHCH3(g)+Cl2(g)CH2===CHCH2Cl(g)+HCl(g)。在一定压强下,按w=eq \f(nCl2,nCH2===CHCH3)向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、w的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是( )
A.图甲中w2>1
B.图乙中,A线表示逆反应的平衡常数
C.温度为T1,w=2时,Cl2的转化率为50%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大
15.(2023·北京丰台统考一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
A. 1 173 K时,反应①起始c(CO2)=0.6 ml·L-1,平衡时c(CO2)约为0.4 ml·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3=eq \f(K2,K1);ΔH3=ΔH2-ΔH1
题型17 化学反应速率与化学平衡的综合考查
1.反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH<0可用于处理汽车尾气。下列说法正确的是( C )
A.该反应在任何温度下都能自发进行
B.上述反应平衡常数K=eq \f(c2CO·c2NO,c2CO2·cN2)
C.其他条件相同,增大体系压强,能提高NO的平衡转化率
D.其他条件相同,提高c(CO),正反应速率加快,逆反应速率减慢
解析 该反应的ΔHp乙
D.该反应正反应的活化能小于逆反应的活化能
解析 该反应为放热反应,若容器为绝热容器,则体系内温度升高,温度越高反应速率越快,由任意时刻的正反应速率始终满足v甲>v乙,可判断甲中温度高,为绝热容器,故A正确;该反应为放热反应,温度升高使平衡逆向移动,会降低NO的转化率,因此乙中NO的平衡转化率高于甲,故B错误;除0时刻外,甲中温度高于乙,且甲正向进行程度小于乙,甲中气体分子数大于乙,则甲中压强始终大于乙,故C正确;该反应为放热反应,正反应的活化能小于逆反应的活化能,故D正确。
4.一定温度下,向2 L恒温恒容密闭容器中加入足量活性炭和2 ml NO2,发生反应2NO2(g)+2C(s)2CO2(g)+N2(g),部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是( C )
A.曲线Ⅱ表示n(CO2)随t的变化
B.0~2 min内,v(C)=v(CO2)=0.375 ml·L-1·min-1
C.3 min时,加入催化剂可同时增大NO2的生成速率和消耗速率
D.3 min时,充入N2增大压强,该容器的气体颜色不变
解析 加入活性炭和NO2,随着反应时间的推移,NO2的物质的量减少,CO2和N2的物质的量增加,相同反应时间内CO2增加的量是N2的两倍,因此曲线Ⅰ表示n(CO2)随t的变化,曲线Ⅱ表示n(N2)随t的变化,曲线Ⅲ表示n(NO2)随t的变化,A项错误;C是固体,浓度不随着反应时间推移而变化,不能用于表示反应速率,B项错误;反应在此条件下2 min后已经达到平衡,3 min时加入催化剂可以同时且同等程度加快正、逆反应的速率,C项正确;3 min时向恒温恒容密闭容器中充入N2,平衡向逆反应方向移动,c(NO2)增大,容器中气体的颜色加深,D项错误。
5.室温下,气体M、N、P、Q之间存在如下转化关系:①MN+P;②MN+Q,反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M),(k1、k2为速率常数)。在容积为10 L的密闭容器中,反应体系中组分M、P的物质的量随时间的变化如下表所示:
下列说法正确的是( B )
A.0~3 min时间段内,Q的平均反应速率为0.15 ml·L-1·min-1
B.反应开始后,体系中P和Q的浓度之比保持不变
C.平衡时M生成Q的转化率为36%
D.反应①的活化能比反应②的活化能低
解析 由表格数据可知,0~3 min内,M的物质的量变化量为0.60 ml,P的物质的量变化量为0.15 ml,则反应生成的Q的物质的量为0.60 ml-0.15 ml=0.45 ml,则Q的平均反应速率为eq \f(0.45 ml,10 L×3 min)=0.015 ml·L-1·min-1,故A错误;由化学反应速率定义可知,反应开始后,体系中P和Q的浓度变化量之比Δc(P)∶Δc(Q)=tv1∶tv2=k1c(M)∶k2c(M)=k1∶k2,k1、k2为定值,所以反应开始后,体系中P和Q的浓度之比保持不变,故B正确;由表格数据可知,4 min反应达到平衡时,M的物质的量变化量为0.64 ml,P的物质的量变化量为0.16 ml,则反应生成的Q的物质的量为0.64 ml-0.16 ml=0.48 ml,M生成Q的转化率为eq \f(0.48 ml,1.00 ml)×100%=48%,故C错误;由上述分析可知,反应①的反应速率慢于反应②,反应速率越快,活化能越小,则反应①的活化能比反应②的活化能高,故D错误。
6.(2023·广东汕头实验中学联考)常压下羰基化法精炼镍的原理为Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( A )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选30 ℃
D.第二阶段,Ni(CO)4分解率较低
解析 反应Ni(s)+4CO(g)Ni(CO)4(g)的正反应是一个熵减的自发反应,故可判断Ni(s)+4CO(g)Ni(CO)4(g)是放热反应,所以升高温度,该反应的平衡常数减小,A正确;该反应达到平衡时,正、逆反应速率相等,4v生成[Ni(CO)4]=v生成(CO),B错误;Ni(CO)4的沸点为42.2 ℃,将粗镍与CO反应转化成气态Ni(CO)4,选择反应温度应选50 ℃,C错误;Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数K=eq \f(c[NiCO4],c4CO)=2×10-5,第二阶段反应为Ni(CO)4(g)Ni(s)+4CO(g),该反应的平衡常数K=eq \f(c4CO,c[NiCO4])=eq \f(1,2×10-5)=5×104,故Ni(CO)4分解率较高,D错误。
7.(2023·广东深圳统考一模)恒容密闭容器中,n ml CO2与3n ml H2在不同温度下发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( C )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n ml CO2与6n ml H2在T1 ℃下反应,达到平衡时c(H2)1,已知:T ℃时,该反应的化学平衡常数K=1,ΔH
相关试卷
这是一份第一部分 题型4 氧化还原反应规律的综合考查(含解析)2024高考化学二轮复习,共18页。
这是一份第一部分 题型4 氧化还原反应规律的综合考查(含解析)2024高考化学二轮复习,共18页。
这是一份第一部分 题型3 有关NA的综合考查(含解析)2024高考化学二轮复习,共15页。试卷主要包含了NA是阿伏加德罗常数的值,设NA为阿伏加德罗常数的值,设NA是阿伏加德罗常数的值,NA为阿伏加德罗常数的值,设阿伏加德罗常数的值为NA等内容,欢迎下载使用。








