



第11讲 构成物质的基本微粒(2)-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国)
展开学习目标
1.知道原子是化学变化中的最小粒子及性质;了解原子是由质子、中子和电子构成的;知道不同种类原子的区别。
2.初步了解相对原子质量的概念,并能利用相对原子质量进行简单的计算。
3.初步了解核外电子是分层排布的;能画出1~18号元素的原子结构示意图。
4.掌握离子的形成和离子的表示方法;认识离子也是构成物质的一种粒子。
5.能根据粒子结构示意图判断粒子的种类;了解核外电子排布规律及其与元素化学性质的关系。
要点梳理
要点一、原子的构成
1.原子是由下列粒子构成的:
原子由原子核和核外电子(带负电荷)构成,原子核由质子(带正电荷)以及中子(不带电)构成,但并不是所有的原子都是由这三种粒子构成的。例如:普通的氢原子核内没有中子。
2.原子中的等量关系:核电荷数=质子数=核外电子数
在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),每个质子带1个单位正电荷,每个电子带一个单位负电荷,原子整体是呈电中性 的粒子。
3.原子内部结构揭秘—散射实验(如下图所示):
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。实验结论:
(1)原子核体积很小,原子内部有很大空间,所以大多数α粒子能穿透金箔;
(2)原子核带正电,α粒子途经原子核附近时,受到斥力而改变了运动方向;
(3)金原子核的质量比α粒子大得多,当α粒子碰到体积很小的金原子核被弹了回来。
【要点诠释】
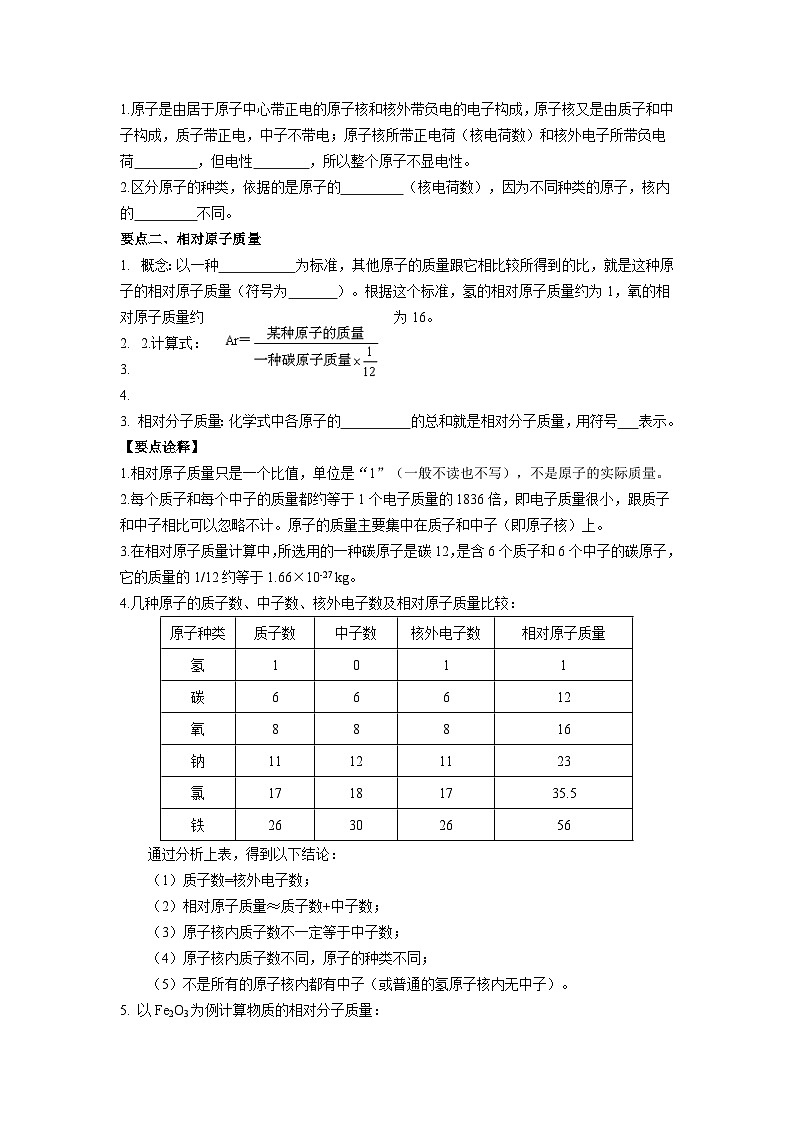
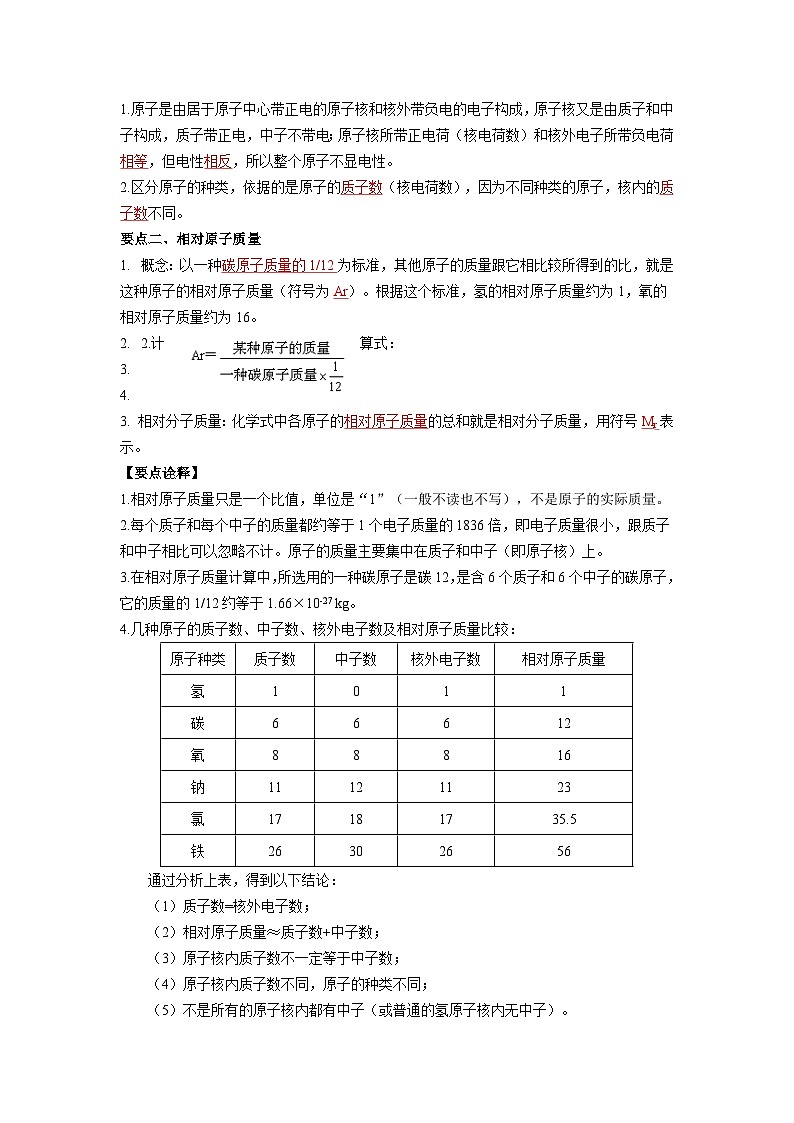
1.原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷 相等,但电性相反,所以整个原子不显电性。
2.区分原子的种类,依据的是原子的质子数(核电荷数),因为不同种类的原子,核内的质子数不同。
要点二、相对原子质量
概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量(符号为Ar)。根据这个标准,氢的相对原子质量约为1,氧的相对原子质量约为16。
2.计算式:
3. 相对分子质量:化学式中各原子的相对原子质量的总和就是相对分子质量,用符号Mr表示。
【要点诠释】
1.相对原子质量只是一个比值,单位是“1”(一般不读也不写),不是原子的实际质量。
2.每个质子和每个中子的质量都约等于1个电子质量的1836倍,即电子质量很小,跟质子和中子相比可以忽略不计。原子的质量主要集中在质子和中子(即原子核)上。
3.在相对原子质量计算中,所选用的一种碳原子是碳12,是含6个质子和6个中子的碳原子,它的质量的1/12约等于1.66×10-27 kg。
4.几种原子的质子数、中子数、核外电子数及相对原子质量比较:
通过分析上表,得到以下结论:
(1)质子数=核外电子数;
(2)相对原子质量≈质子数+中子数;
(3)原子核内质子数不一定等于中子数;
(4)原子核内质子数不同,原子的种类不同;
(5)不是所有的原子核内都有中子(或普通的氢原子核内无中子)。
5. 以Fe2O3为例计算物质的相对分子质量:
Fe2O3的相对分子质量= 56 ×2+16×3=160 。
要点三、核外电子的分层排布
1.电子层:
核外电子运动有自己的特点,在含有多个电子的原子里,电子的能量是不相同的,能量低的电子通常在离核较近的区域运动,能量高的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
核外电子是在不同的电子层内运动的,人们又把这种现象叫做核外电子的分层排布 。离原子核较近的第一层不超过2个电子,第二层不超过8个电子……最外层不超过8个电子。2.原子结构示意图:
原子结构示意图可简明、方便地表示原子的结构(如下图所示)。小圈和圈内的数字表示原子核和质子数(即核电荷数),弧线表示电子层,弧线上面的数字表示该层的电子数。
【要点诠释】
1.在原子结构示意图中,每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过 2个,第二层不超过 8 个,第三层不超过18个;最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
2.把原子最外电子层有8个电子(只有一个电子层的具有2个电子)的结构,称为相对稳定结构。稀有气体元素,如氖、氩等,它们的最外层电子都是8个(氦为2个),属于相对稳定结构(不易与其他物质发生化学反应)。金属元素和非金属元素的原子在化学反应中有通过得失电子或共用电子,趋向达到相对稳定结构。
3.元素的化学性质主要由最外层电子数决定。
要点四、离子
1.概念:带电荷的原子(或原子团)叫离子,如Na+、 、 等。
2.离子的分类:
3.离子的形成:阳离子原子 阴离子
(1)阳离子:金属元素的原子易失去最外层电子,使原子核外电子所带的负电荷比原子核带的正电荷少,原子带上正电荷,变成了阳离子。(阳离子中:核电荷数=质子数>核外电子数)
(2)阴离子:非金属元素的原子易得到电子,使原子核外电子所带的负电荷比原子核带的正电荷多,原子带上负电荷,变成了阴离子。(阴离子中:核电荷数=质子数<核外电子数)
4.离子符号及其意义(数字“2”的意义):
【要点诠释】
1.原子得失电子变成离子,元素的种类、质子数、相对原子质量都不变。
2.离子和原子的比较:
要点五、化合物的形成过程(以钠与氯气反应生成NaCl为例)
【要点诠释】
分子、原子、离子三者的关系:
模块二、知识秀
类型一、考查原子及原子的结构
1.下列由原子构成的物质是
A.氯化钠B.金刚石C.氨气D.二氧化氮
【答案】B
【详解】A、氯化钠由钠离子和氯离子构成,故选项A不符合题意;
B、金刚石为非金属固态单质,由碳原子构成,故选项B符合题意;
C、氨气由氨气分子构成,故选项C不符合题意;
D、二氧化氮由二氧化氮分子构成,故选项D不符合题意;
故选:B。
2.下列叙述正确的是
A.元素的化学性质取决于核外电子数
B.分子能保持物质的化学性质,原子不能保持物质的化学性质
C.相对原子质量是一个该原子的实际质量与一个碳12原子质量的比值
D.分子和原子的主要区别是在化学变化中分子可分,而原子不可分
【答案】D
【详解】A、元素的化学性质取决于最外层电子数,故A错误;
B、由分子构成的物质,分子是保持物质化学性质的最小粒子,如保持氧气化学性质的粒子是水分子,由原子直接构成的物质,原子是保持该物质化学性质的粒子,如保持汞化学性质的粒子是汞原子,所以分子能保持物质的化学性质,原子也能保持物质的化学性质,故B错误;
C、相对原子质量是一个该原子的实际质量与一个碳12原子质量的的比值,故C错误;
D、分子和原子的主要区别是在化学变化中分子可分,而原子不可分,原子是化学变化中的最小粒子,故D正确。
故选:D。
3.微粒观是重要的化学思想。下列关于微粒观的叙述中正确的是
A.物质都是由微观粒子构成的B.氧离子的结构示意图为
C.所有原子的原子核都有质子和中子D.化学反应中,分子可分,原子也可分
【答案】A
【详解】A、物质都是由微观粒子分子、原子、离子构成的,选项正确;
B、氧原子最外层有6个电子,大于4,易得2个电子成为氧离子,氧离子的结构示意图为 ,选项错误;
C、不是所有原子的原子核都有质子和中子,如氢原子的原子核中不含有中子,选项错误;
D、化学反应的实质是分子的分裂和原子的重组,化学反应中,分子可分,原子不可分,选项错误。
故选A。
4.原子论和分子学说的创立,奠定了近代化学的基础。下列有关分子和原子的性质说法错误的是
A.分子和原子的质量和体积都很小B.分子间有间隔,原子间没有间隔
C.分子和原子总是在不断运动着D.在化学变化中,分子可以再分而原子不可以再分
【答案】B
【详解】A、分子和原子的质量和体积都很小,选项正确;
B、分子和原子之间间都有间隔,选项错误;
C、分子和原子总是在不断运动着,选项正确;
D、在化学变化中,分子可以再分而原子不可以再分,选项正确;
故选:B。
5.英国科学家汤姆生和卢瑟福对化学的突出贡献在于
A.提出质量守恒定律B.认识原子基本结构
C.揭示了燃烧的本质D.发现了空气的组成
【答案】B
【详解】英国科学家汤姆生发现了电子,发现原子仍可再分;卢瑟福通过实验得出结论:原子由原子核和核外电子构成。两位科学家使人们认识到原子基本结构。
综上所述:选择B。
6.如图是1911年英国科学家卢瑟福及其团队进行的著名的α粒子轰击金箔实验。下列实验现象描述不正确的是
A.原子中心有一个体积很小、质量相对较大、带正电荷的原子核
B.绝大多数α粒子顺利穿过
C.一小部分α粒子改变了原来的方向
D.极少数a粒子被反弹了回来
【答案】A
【详解】A、原子中心有一个体积很小、质量相对较大、带正电荷的原子核,属于实验结论,不是实验现象,符合题意;
B、原子内部有相对较大的空间,故绝大多数α粒子顺利穿过,不符合题意;
C、原子核带正电,故一小部分α粒子改变了原来的方向,不符合题意;
D、原子核很小,但是原子核的质量远大于α粒子的质量,故极少数a粒子被反弹了回来,不符合题意。
故选A。
7.科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论,关于原子结构的观点有:
①在球体内正电荷均匀分布,电子镶嵌其中;
②原子是可分的;
③原子中有带负电的电子;
④原子中有带正电的原子核;
⑤原子核很小,但集中了原子的大部分质量。
其中经过卢瑟福传承和发展后的观点是
A.④⑤B.③④⑤C.①②③④D.②③④⑤
【答案】D
【分析】根据原子的构成、原子中各微粒带的电荷的电性回答本题。
【详解】①在球体内正电荷均匀分布,电子镶嵌其中,错误,因为质子带正电荷,位于原子核内,核外带负电荷的电子在原子核外高速运动;
②原子可分为原子核和核外电子,说法正确;
③原子中有带负电的电子,核外带负电荷的电子在原子核外高速运动,说法正确;
④原子中有带正电的原子核,正确;
⑤原子核很小,但集中了原子的大部分质量,正确,因为原子中质子和中子的质量远大于电子的质量。
②③④⑤正确,故选:D。
8.下图是铁原子的结构示意图,有关说法正确的是
A.铁原子核内含有26个中子B.图中x=14
C.铁原子易得到2个电子D.Fe原子与Fe2+质子数不同
【答案】B
【详解】A、原子中,质子数=核外电子数,但不一定等于中子数,该选项说法不正确;
B、在原子中,质子数=核外电子数,则x=26-2-8-2=14,该选项说法正确;
C、铁原子最外层电子数为2,在化学变化中易失去2个电子,该选项说法不正确;
D、原子得失电子形成离子,则铁原子和Fe2+的质子数相同,该选项说法不正确。
故选B。
9.氯元素广泛存在于自然界中,对人体的生理活动也有重要意义。下图为氯原子的结构示意图,下列说法不正确的是
A.x=2B.氯原子核外有两个电子层
C.氯原子的核电荷数为17D.氯原子在化学反应中易得到电子
【答案】B
【详解】A、在原子中,质子数=核外电子数,则有17=x+8+7,x=2,故A正确;
B、由氯原子的结构示意图可知,氯原子核外有3个电子层,故B错误;
C、在原子中,核电荷数=质子数,由图可知,氯原子的核电荷数为17,故C正确;
D、由氯原子的结构示意图可知,氯原子的最外层电子数为7>4,在化学反应中易得到电子,故D正确。
故选B。
10.2022 年 6 月 17 日,我国第三艘完全自主建造的航母“福建舰”成功下水,在其建造时用到了大量钛合金,钛原子的质子数为 22,相对原子质量为 48,则钛原子的核外电子数、中子数分别为
A.26、22B.22、26C.48、22D.26、48
【答案】B
【详解】在原子中,质子数=核外电子数=22,中子数≈相对原子质量-质子数=48-22=26。
故选B。
11.关于原子,下列叙述正确的是
A.一切原子核都是由质子和中子构成的
B.原子是最小的粒子,不可再分
C.整个原子的质量几乎全部集中在原子核上
D.一种原子变成离子时,一定得到电子
【答案】C
【详解】A、不是所有的原子核都是由质子和中子构成的,如氢原子核内只有质子没有中子,故A错误;
B、原子可以分成原子核和核外电子,在化学变化中,原子不可再分,故B错误;
C、原子包括原子核和核外电子,电子的质量很小,可以忽略不计,因此整个原子的质量几乎全部集中在原子核上,故C正确;
D、一种原子变成离子时,若最外层电子数大于4,易得到电子;若最外层电子数小于4,易失去电子,故D错误。
故选C。
12.仔细观察下表回答问题。
(1)请将表中空格填写完整。
(2)通过分析上表的有关数据,除了可总结出如“原子中质子数等于核外电子数”的结论外,你还能总结出的结论有:
①_______;
②_______;
③_______。
【答案】(1) 1 6 16 12 26 56
(2)原子核中不一定都有中子 相对原子质量=质子数+中子数 在原子中,原子核内的质子数不一定等于中子数(或不同种类的原子,其质子数不同,核外电子数也不同等)
【详解】(1)氢原子核内有1个质子,质子数等于核外电子数是1;
碳原子核外电子数是6,质子数等于核外电子数是6;
氧原子核内质子数是8,中子数是8,相对原子质量约等于质子数加中子数是;
钠原子相对原子质量是23,质子数是11,相对原子质量约等于质子数加中子数,故中子数是;
铁原子核外电子数是26,核内质子数是26,相对原子质量是;
(2)过分析上表的有关数据,除了可总结出如“原子中质子数等于核外电子数”的结论外,还能总结出的结论有:原子核中不一定都有中子;相对原子质量=质子数+中子数;在原子中,原子核内的质子数不一定等于中子数(或不同种类的原子,其质子数不同,核外电子数也不同等)。
13.一种氦原子的质子数为2、中子数为1。下列示意图能正确表示这种氦原子结构的是
A.B.C.D.
【答案】D
【详解】根据在原子中核内质子数等于核外电子数,其中核内有2个质子和1个中子,可知氦原子核外有2个电子,故选:D。
14.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如表示核内有6个质子和7个中子的碳原子。下列关于和的说法中错误的是
A.各一个原子相比较,质子数相同
B.各一个原子相比较,中子数相同
C.各一个原子相比较,核外电子数相同
D.属于同种元素
【答案】B
【详解】A、由题意可知,两个原子的质子数相同,为53个,正确,不符合题意;
B、两个原子中,第一个原子中中子数为131-53=78个,第二个原子中中子数为127-53=74个,错误,符合题意;
C、两个原子的质子数相同,核外电子数也相同,为53个,正确,不符合题意;
D、由题意可知,两个原子的质子数相同,所以它们属于同种元素,正确,不符合题意。
故选B。
类型二、相对原子质量的概念及相对分子质量的有关计算
1.紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的相对原子质量为
A.10B.34C.78D.44
【答案】C
【详解】相对原子质量≈质子数+中子数,而质子数=核电荷数,则硒原子的相对原子质量为34+44=78,故选C。
2.碳12原子的质量为,一种锌原子的质量为,该锌原子的相对原子质量是
A.12B.64C.66D.
【答案】C
【详解】一个原子质量与一个碳12原子的质量的的比值就是相对原子质量;则Zn的相对原子质量=;
故选C。
3.化学家为人类社会的进步做出了巨大贡献。对铟、铱、锑、铕、铈等元素的相对原子质量的测定作出卓越贡献的我国化学家是
A.阿伏伽德罗B.张青莲C.拉瓦锡D.门捷列夫
【答案】B
【详解】A、阿伏伽德罗在原子论和分子学说的创立上有贡献,故A错误;
B、对相对原子质量的测定作出卓越贡献的我国化学家是张青莲,故B正确;
C、拉瓦锡测定了空气的组成,故C错误;
D、门捷列夫发现了元素周期律和元素周期表,故D错误。
故选B。
4.已知一个硫原子的质量为m g,其相对原子质量为32,则一个相对原子质量为152的铕(Eu)原子的质量为
A.B.C.D.
【答案】C
【详解】两个原子的相对原子质量比等于其实际质量比,故,铕原子质量 =。
故选C。
5.关于相对原子质量说法一定正确的是
A.是某种原子质量与氧原子质量的比值
B.原子质量越大,其相对原子质量也越大
C.单质中原子的相对原子质量等于该物质的式量
D.化合物中各原子的物质的量之比等于它们的相对原子质量之比
【答案】B
【详解】A、相对原子质量指任何一个原子的真实质量跟一个碳-12原子质量的十二分之一的比值,故A错误;
B、原子质量越大,相对原子质量也越大,故B正确;
C、部分单质并不是单原子分子,比如氢气(H2)该物质的式量为原子的相对原子质量的两倍,故C错误;
D、化合物中各原子的物质的量之比与它们的相对原子质量之比无关,物质的量之比需要观察化合物的化学式,故D错误;
故选B。
6.下列关于“氧的相对原子质量为16”的意义及其他说法正确的是
A.一个氧原子的质量是16g
B.一个氧原子的质量是一个碳原子质量的16倍
C.一个氧原子的质量是相当于16个“相对原子质量标准”的质量
D.氧16和氧18两种氧原子,16和18表示原子个数
【答案】C
【详解】A、相对原子质量和原子的质量不是一个概念,原子的实际质量很小,不符合题意;
B、原子的实际质量与相对原子质量呈正比,故一个氧原子的质量是一个碳原子质量的倍,即一个氧原子的质量是一个碳-12原子质量的的16倍,不符合题意;
C、一个氧原子的质量是相当于16个“相对原子质量标准”的质量,即一个氧原子的质量是相当于一个碳-12原子质量的的16倍,符合题意;
D、氧16和氧18两种氧原子,16和18表示相对原子质量,不符合题意。
故选C。
7.一水合氨是一种化合物,其化学式是NH3·H2O,试计算:
(1)NH3·H2O的相对分子质量_____。
(2)NH3·H2O原子个数比_____。
(3)NH3·H2O中氮元素和氢元素的质量比____。
【答案】(1)35
(2)氮、氢、氧原子个数比为1:5:1
(3)14:5
【详解】(1)相对分子质量指化学式中各个原子的相对原子质量的总和。NH3·H2O的相对分子质量=14×1+1×5+16×1=35。
(2)由一水合氨的化学式NH3·H2O可知,氮、氢、氧原子个数比为1:5:1。
(3)化合物中各元素的质量比等于各元素的相对原子质量与它的原子个数的乘积之比。NH3·H2O中氮元素和氢元素的质量比=(14×1):(1×5)=14:5。
8.一个水分子是由两个质子数为1的氢原子和一个质子数为8的氧原子构成的,则每个水分子中共含有___________个原子核,___________个质子;铁原子质子数为26,中子数比质子数多4个,该原子中微粒总数为___________个。
【答案】3 10 82
【详解】1个原子中含有1个原子核,而1个水分子中含有2个氢原子和1个氧原子,则1个分子中含有3个原子核;1个氢原子有1个质子,1个氧原子有8个质子,则1个水分子中有1×2+8=10。由于原子中,质子数=核外电子数,则该原子中微粒总数为26+26+26+4=82。
类型三、核外电子的排布和离子的形成
1.物质是由微粒构成的。下列物质由离子构成的是
A.蒸馏水B.氯化钠C.氦气D.干冰
【答案】B
【详解】A、蒸馏水是由非金属元素组成的化合物,由分子构成的,选项错误;
B、氯化钠是含有金属元素与非金属元素的化合物,故氯化钠由钠离子和氯离子构成,选项正确;
C、氦气是非金属气体单质,由氦原子直接构成,选项错误;
D、干冰是固体二氧化碳,是由非金属元素组成的化合物,由分子构成的,选项错误。
故选B。
2.关于分子、原子、离子的叙述中,正确的是
A.原子是实心球体,不可再分B.分子可分,原子不可分
C.离子都是带电的原子D.分子、原子、离子都是构成物质的粒子
【答案】D
【详解】A.原子由原子核与核外电子构成,原子核由质子和中子构成,所以原子不是实心球体,可以再分,A错误,不符合题意;
B.根据A的分析,原子可以再分,B错误,不符合题意;
C.带电的原子或原子团是离子,C错误,不符合题意;
D.分子、原子、离子都是构成物质的粒子,D正确,符合题意;
故选D
3.下列物质是由离子构成的是
A.氯化钠B.氨气C.金刚石D.汞
【答案】A
【详解】A、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项A正确;
B、氨气是由非金属元素组成的化合物,是由氨分子构成的,故选项B错误;
C、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项C错误;
D、汞属于金属单质,是由汞原子直接构成的,故选项D错误;
故选:A。
4.下列关于原子、分子、离子的说法中正确的是
A.原子都是由质子、中子和电子构成的B.分子构成物质而原子不能构成物质
C.分子的质量一定大于原子的质量D.金属原子失去电子后会形成阳离子
【答案】D
【详解】A、原子一般是由质子、中子、和电子构成的,但并不是所有原子都是由质子、中子、电子构成的,例如,氢原子中不含有中子,故A说法错误;
B、分子和原子都能够直接构成物质,例如水是由水分子构成的,铁是由铁原子构成的,故B说法错误;
C、分子的质量一定大于组成它的原子的质量,笼统的分子和原子不能比较质量大小,有的分子质量比有的原子的质量大,有的分子的质量比有的原子的质量小,故C说法错误;
D、原子失电子形成阳离子,得电子形成阴离子,金属原子的最外层电子数一般少于4,在化学反应中易失去最外层的电子而形成阳离子,故D说法正确;
5.“宏观错误与微观探析”是化学学科的核心素养之一,下列说法中正确的个数
①化学变化中,原子核不发生改变
②气球吹爆过程中分子本身发生了变化
③同种分子构成的物质是纯净物
④、、表示的微粒都是离子
A.1个B.2个C.3个D.4个
【答案】B
【详解】①原子是化学变化中的最小粒子,则化学变化中,原子核不发生改变,该说法正确;
②气球吹爆过程中没有新物质生成,则分子本身不发生变化,该说法不正确;
③同种分子构成的物质中只含有一种物质,属于纯净物,该说法正确;
④圆圈内的数字表示为质子数,圆圈外的数字表示核外电子数,中质子数=核外电子数,该微粒为原子,而另两种微粒的质子数均不等于核外电子数,为离子,该说法不正确;
则正确的说法有两个,故选B。
6.下列是几种微粒的结构示意图,有关说法错误的是
A.微粒③易失去电子
B.微粒④带两个单位正电荷
C.微粒②和④核外电子排布相同,但不属于同种元素
D.微粒①属于阴离子
【答案】D
【详解】A、微粒③最外层电子为1,易失去电子形成稳定结构,说法正确;
B、微粒④的质子数=12,核外电子数为10,质子数-核外电子数=2,所以带两个单位正电荷,说法正确;
C、微粒②的质子数为9,微粒④的质子数为12,所以虽然核外电子排布相同,但不属于同种元素,说法正确;
D、微粒①的质子数=核外电子数,所以微粒①是氟原子,说法错误。
故选D。
7.锶的原子结构示意图及在元素周期表中某些信息如图所示,下列说法正确的是
A.x的值为8
B.锶的相对原子质量为87.62g
C.锶原子的中子数为38
D.锶原子在化学反应中易失去电子
【答案】D
【详解】A、原子中,核内质子数=核外电子数=核电荷数=原子序数,故锶原子的电子数应该为38,故2+8+x+8+2=38,x=18,故A错误,不符合题意;
B、根据元素周期表信息图可知:锶的相对原子质量为87.62,单位为“1”,不为g,故B错误,不符合题意;
C、原子中,质子数+中子数≈相对原子质量,故锶原子的中子数=88-38=50,故C错误,不符合题意;
D、根据锶原子的原子结构示意图可知:锶原子最外层电子数为2,故锶原子在化学反应中易失去2个电子,故D正确,符合题意。
故选:D。
8.2023央视春晚首次实现“5G+8K超高清+三位菁彩声”,5G的实现离不开新材料氮化镓(GaN)。下图为镓在元素周期表中的相关信息及其原子结构示意图。下列说法正确的是
A.镓的离子符号为Ga+3B.镓原子结构示意图中x=3
C.镓原子易得到电子D.镓原子的相对原子质量为69.72g
【答案】B
【详解】A、原子中,质子数=核外电子数,则x=31-2-8-18=3,则镓原子在化学变化中易失去3个电子形成带3个单位正电荷的镓离子,而元素符号右上角的数字表示离子个数,且数字在前,符号在后,则镓离子的符号为Ga3+,该选项说法不正确;
B、由前面分析可知,x=3,该选项说法正确;
C、由前面分析可知,镓原子最外层电子数为3,小于4,易失去电子,该选项说法不正确;
D、相对原子质量的单位为“1”,而不是“g”,该选项说法不正确。
故选B。
9.下列关于Mg和Mg2+ 两种粒子的说法不正确的是
A.质子数相同B.核外电子数不相同C.电子层数不相同D.化学性质相同
【答案】D
【详解】A、Mg和Mg2+的质子数相同,都是12个,此选项正确;
B、Mg和Mg2+的核外电子数分别为12个、10个,所以它们的核外电子数不相同,此选项正确;
C、Mg核外有3个电子层,Mg2+核外有2个电子层,它们的核外电子层数不相同,此选项正确;
D、最外层电子个数相等,化学性质相同,Mg和Mg2+的最外层电子个数不相等,所以化学性质不相同,此选项错误。
故选D。
10.在①分子、②原子、③质子、④中子、⑤电子、⑥离子等微粒中(填序号):
(1)能构成物质的微粒是______;
(2)不显电性的微粒是______;
(3)原子核中一定含有的微粒是______;
(4)带正电荷的微粒是______;
(5)带负电的微粒是______;
(6)可能带正电也可能带负电的微粒是______。
【答案】(1)①②⑥
(2)①②④
(3)③
(4)③
(5)⑤
(6)⑥
【详解】(1)构成物质的微粒有分子、原子和离子,故能构成物质的微粒选①②⑥;
(2)原子是由位于原子中心带正电的原子核和核外带负电的电子构成的,其中原子核又由带正电的质子和不带电的中子构成,由于原子核所带正电与核外电子所带负电电量相等、电性相反,故原子对外不显电性,分子是由原子构成的,故分子对外也不显电性,故不显电性的微粒是中子、原子、分子,选①②④;
(3)通常情况下,原子核是由带正电的质子和不带电的中子构成的,但普通氢原子的原子核内中子数为0,故原子核中一定含有的微粒是质子,选③;
(4)原子是由位于原子中心带正电的原子核和核外带负电的电子构成的,其中原子核又由带正电的质子和不带电的中子构成,故带正电荷的微粒是质子,选③;
(5)原子是由位于原子中心带正电的原子核和核外带负电的电子构成的,故带负电荷的微粒是电子,选⑤;
(6)离子是原子得失电子后形成的微粒,当原子得到电子时形成带负电的阴离子,当原子失去电子时形成带正电的阳离子,故可能带正电也可能带负电的微粒是离子,选⑥。
11.某粒子(原子或离子)的结构示意图如右图所示,请回答下列问题:
(1)若M=13,则该粒子所对应的元素的符号为______。
(2)若N=2,且该粒子不显电性,则其所对应元素的原子序数为________。
(3)若该粒子带一个单位负电荷,且N=8,则该粒子的符号为________。
【答案】(1)Al
(2)12
(3)Cl-
【详解】(1)若M=13,则该粒子所对应的元素为铝元素,铝的元素符号为Al;
(2)若N=2,且该粒子不显电性,则该粒子核内质子数等于核外电子数,则M=2+8+2=12,根据原子序数=核内质子数,故其所对应元素的原子序数为12;
(3)若N=8,则该粒子的核外电子数等于2+8+8=18,又该粒子带一个单位的负电荷,则M=18-1=17,则该粒子是氯离子,符号为Cl-。
12.在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)从宏观角度分析,氧气是由氧_____(填“元素”或“原子”)组成的。
(2)中国科学院院士张青莲教授于1983年当选为国际原子量委员会委员,他主持测定了多种元素相对原子质量的新值,其中相对原子质量确定为152的铕元素的原子序数为63,则铕原子的核外电子数为_____。
(3)根据下列粒子的结构示意图,回答下列问题:
①属于非金属元素的有_____(填数字)种。
②与氧元素具有相似化学性质的是_____(填元素符号)。
③由镁和氯两种元素组成化合物的化学式为_____。
【答案】(1)元素 (2)63
(3)3 S MgCl2
【详解】(1)从宏观角度分析,物质是由元素组成的,氧气是由氧元素组成的;
(2)相对原子质量确定为152的铕元素的原子序数为63,根据在原子中,质子数=核外电子数=原子序数,则铕原子的核外电子数为63;
(3)①图示元素分别为氧、钠、镁、硫、氯,其中钠元素与镁元素属于金属元素,氧、硫、氯属于非金属元素,故属于非金属元素的有3种;
②氧和硫(S)两种元素的原子最外层电子数相同,都是6个,所以它们具有相似的化学性质;
③镁原子的最外层电子数为2<4,在化学反应中易失去最外层的2个电子形成带有2个单位正电荷的镁离子,故镁元素在化合物中显示+2价,氯原子的最外层电子数为7>4,在化学反应中易得到1个电子形成带有1个单位负电荷的氯离子,故氯元素在化合物中显示-1价,故由镁和氯两种元素组成化合物的化学式为MgCl2。
13.学习化学要形成基本的化学观念,如:元素观、微粒观、变化观等。请按要求回答下列问题:
(1)由图A可知,铈元素的原子序数是__________。
(2)图B、C、D、E是四种粒子结构示意图,其中元素化学性质相似的是__________(填图片下方字母)。
(3)E在化学变化中易__________电子(填“得”或“失”),变成阴离子,E的阴离子可以与C相互作用形成化合物_________(填物质名称)。
【答案】(1)58
(2)BD
(3)得 氯化钠
【详解】(1)由图A可知,铈元素的原子序数是58(左上角数字)。
(2)原子的最外层电子数相同,元素的化学性质相似,故图B、C、D、E是四种粒子结构示意图,其中元素化学性质相似的是BD,最外层电子数均为6。
(3)原子的最外层电子数小于4时,在化学变化中易失电子变成阳离子,大于4时,在化学变化中易得电子变成阴离子。E的最外层电子数为7,故在化学变化中易得变成阴离子,E的阴离子为氯离子,C表示钠离子,故E的阴离子可以与C相互作用形成化合物为氯化钠。原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35.5
铁
26
30
26
56
元素分类
金属元素
非金属元素
稀有气体元素
最外层电子数
较少(一般少于4个)
较多(一般4~7个)
8个(氦是2个)
得失电子倾向
易失去最外层电子
易得到电子
相对稳定、不易得失电子
化学性质
不稳定
不稳定
稳定
粒子种类
原子
离子
阳离子
阴离子
区 别
粒子结构
质子数=电子数
质子数>电子数
质子数<电子数
粒子电性
不显电性
显正电性
显负电性
符号
用元素符号表示
用阳离子符号表示
用阴离子符号表示
举 例
联 系
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
______
1
碳
______
6
6
12
氧
8
8
8
______
钠
11
④_______
11
23
铁
______
30
26
______
第13讲 物质的组成-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国): 这是一份第13讲 物质的组成-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国),文件包含第13讲物质的组成-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国原卷版docx、第13讲物质的组成-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国解析版docx等2份学案配套教学资源,其中学案共32页, 欢迎下载使用。
第12讲 组成物质的化学元素-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国): 这是一份第12讲 组成物质的化学元素-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国),文件包含第12讲组成物质的化学元素-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国原卷版docx、第12讲组成物质的化学元素-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国解析版docx等2份学案配套教学资源,其中学案共42页, 欢迎下载使用。
第10讲 构成物质的基本微粒(1)-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国): 这是一份第10讲 构成物质的基本微粒(1)-【暑假弯道超车】2023年新九年级化学暑假讲义(沪教版·全国),文件包含第10讲构成物质的基本微粒1-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国原卷版docx、第10讲构成物质的基本微粒1-暑假弯道超车2023年新九年级化学暑假讲义沪教版·全国解析版docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。












