









所属成套资源:2024年高考化学大一轮复习
第08讲 金属材料- 2024年高考化学大一轮复习【精讲精练】
展开这是一份第08讲 金属材料- 2024年高考化学大一轮复习【精讲精练】,文件包含第08讲金属材料讲-2024年高考化学大一轮复习精讲精练原卷版docx、第08讲金属材料练-2024年高考化学大一轮复习精讲精练原卷版docx、第08讲金属材料练-2024年高考化学大一轮复习精讲精练解析版docx、第08讲金属材料讲-2024年高考化学大一轮复习精讲精练解析版docx等4份试卷配套教学资源,其中试卷共57页, 欢迎下载使用。
A.电冶金工业中,加冰晶石降低熔融温度
B.炼钢工业中,将炽热的钢水注入留有水的模具
C.电子工业中,以溶液作为覆铜板腐蚀液
D.硝酸工业中,通过氨的催化氧化实现人工固氮
【答案】A
【解析】电解熔融Al2O3生成Al和氧气,氧化铝熔点较高,加入冰晶石作熔剂时能降低熔融温度,从而减少能源浪费,A正确; 由反应3Fe+4H2O(g)Fe3O4+4H2可知炼钢工业中,将炽热的钢水注入没有水的模具中,否则将影响钢的质量,B错误;由反应Cu+2FeCl3=CuCl2+2FeCl2可知,电子工业中,以FeCl3溶液作为覆铜板腐蚀液,C错误;氮的固定是指由游离态的氮转化为化合态的氮的过程,故硝酸工业中,通过氨的催化氧化不能实现人工固氮,D错误;故选A。
2.下图为铝的生产原理示意图,下列相关说法不正确的是
A.冰晶石做助熔剂
B.氧化铝属于过渡晶体
C.金属铁、铜的冶炼方法与铝类似
D.铝在工业上是一种很好的还原剂
【答案】C
【解析】冰晶石在电解铝工业中常用作助熔剂,A正确;氧化铝的晶体结构具有某些过渡金属的特征,因此被称为过渡晶体,B正确;工业上用电解熔融的氧化铝,得到金属铝和氧气,而工业上用热还原法来冶炼金属铁、铜,C错误;Al为活泼金属,冶金工业中常作还原剂,D正确;故选C。
3.不能使悬浊液变澄清的是
A.硫酸溶液B.盐酸C.氢氧化钠溶液D.氨水
【答案】D
【解析】和硫酸反应生成硫酸铝和水,溶液变澄清,故不选A; 和盐酸反应生成氯化铝和水,溶液变澄清,故不选B; 和氢氧化钠溶液反应生成偏铝酸钠,溶液变澄清,故不选C;
和氨水不反应,氨水不能使悬浊液变澄清,故选D;故选D。
4.下列反应的离子方程式不正确的是
A.Na2SO3溶液中滴入少量氯水:SO+Cl2+H2O=SO+2H++2Cl-
B.Mg(OH)2溶于NH4Cl的浓溶液:Mg(OH)2+2NH=Mg2++2NH3•H2O
C.Al(OH)3溶于NaOH溶液:Al(OH)3+OH-=[Al(OH)4]-
D.足量Cu与稀硝酸反应:3Cu+8H++2NO=3Cu2++NO↑+4H2O
【答案】A
【解析】Na2SO3溶液中滴入少量氯水,由于氯水少量,离子方程式为 3SO+Cl2+H2O=SO+2HSO+2Cl-,故A错误;Mg(OH)2溶于NH4Cl的浓溶液,生成氯化镁和一水合氨,离子方程式为:Mg(OH)2+2NH=Mg2++2NH3•H2O,故B正确;Al(OH)3为两性化合物,可与NaOH溶液反应,离子方程式为:Al(OH)3+OH-=[Al(OH)4]-,故C正确;足量Cu与稀硝酸反应生成NO,离子方程式为3Cu+8H++2NO=3Cu2++NO↑+4H2O,故D正确;故选A。
5.对下列劳动项目的解释错误的是
【答案】A
【解析】SO2漂白性是化合性漂白,而不是氧化还原漂白,故用SO2漂白纸浆是由于SO2具有漂白性,而不是由于SO2具有还原性,A符合题意;常温下铝遇浓硝酸钝化,在铝表面形成致密的氧化物保护膜,阻止内部金属继续反应,故能用铝制容器贮运浓硝酸,B不合题意;铁与H2O在高温下会反应,方程式为:3Fe+4H2O(g)Fe3O4+4H2,故模具注入熔融钢水之前必须干燥,C不合题意;固体管道疏通剂的主要成分由金属铝和氢氧化钠组成,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故与铝粉和NaOH溶液反应产生气体有关,D不合题意;故选A。
6.常温下,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:K+、Na+、、
B.c(Fe3+)=0.1ml•L-1的溶液中:K+、ClO-、、SCN-
C.与铝反应生成氢气的溶液中:Na+、NH4+、、Cl-
D.无色溶液中:Na+、Al3+、Cl-、
【答案】C
【解析】pH=1的溶液呈酸性,在酸性溶液中发生氧化还原反应,不能大量共存,A项错误;
与反应,不能大量共存,B项错误;与铝反应生成氢气的溶液呈酸性或强碱性,之间不反应,都不与反应,能够大量共存,C项正确;之间发生双水解反应,不能大量共存,D项错误;故选C。
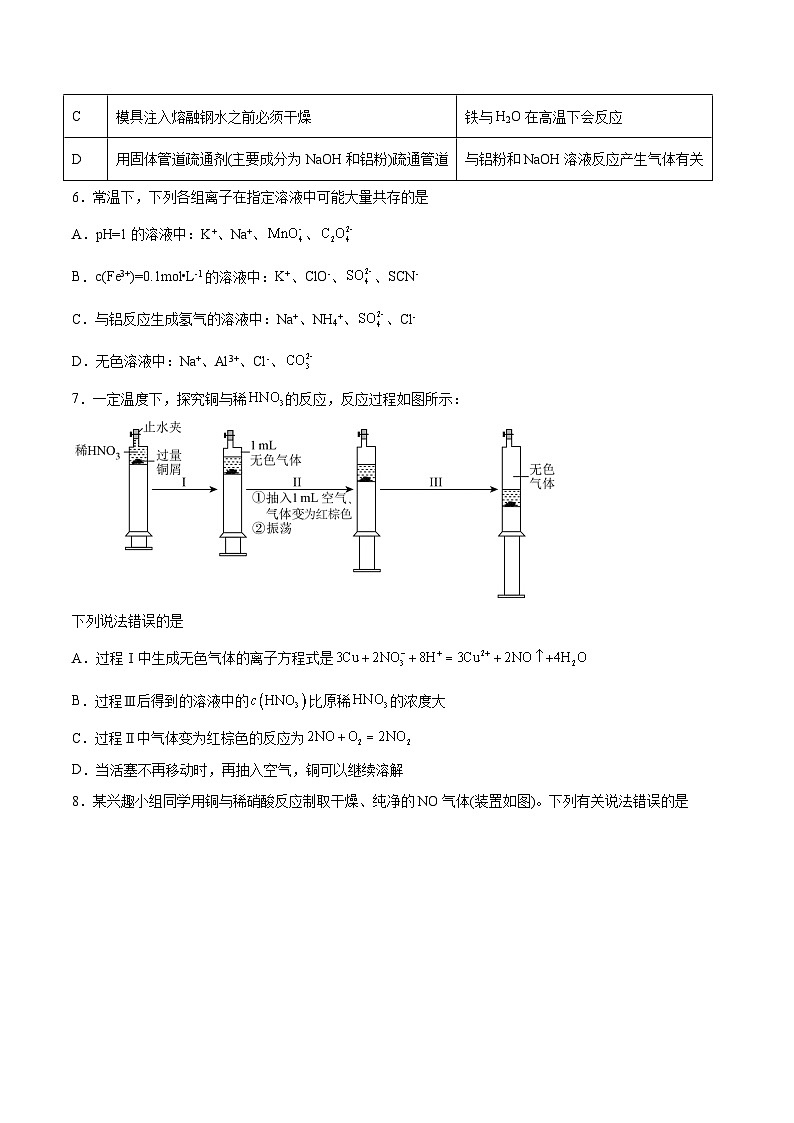
7.一定温度下,探究铜与稀的反应,反应过程如图所示:
下列说法错误的是
A.过程Ⅰ中生成无色气体的离子方程式是
B.过程Ⅲ后得到的溶液中的比原稀的浓度大
C.过程Ⅱ中气体变为红棕色的反应为
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
【答案】B
【分析】铜与稀硝酸反应生成硝酸铜和一氧化氮、水,得到的无色气体是一氧化氮,抽入空气后发生反应2NO+O2=2NO2,振荡后,反应速率加快,说明二氧化氮对反应具有催化作用,据此分析。
【解析】过程Ⅰ中生成无色气体的离子方程式为,A项正确;随着反应的进行,一部分转化为,根据氮原子守恒,可知过程Ⅲ后得到的溶液中的应比原稀的浓度要小,B项错误;过程Ⅱ中气体变为红棕色,发生反应的化学方程式为,C项正确;当活塞不再移动时,再抽入空气,与、反应生成,铜可以继续溶解,D项正确;故选B。
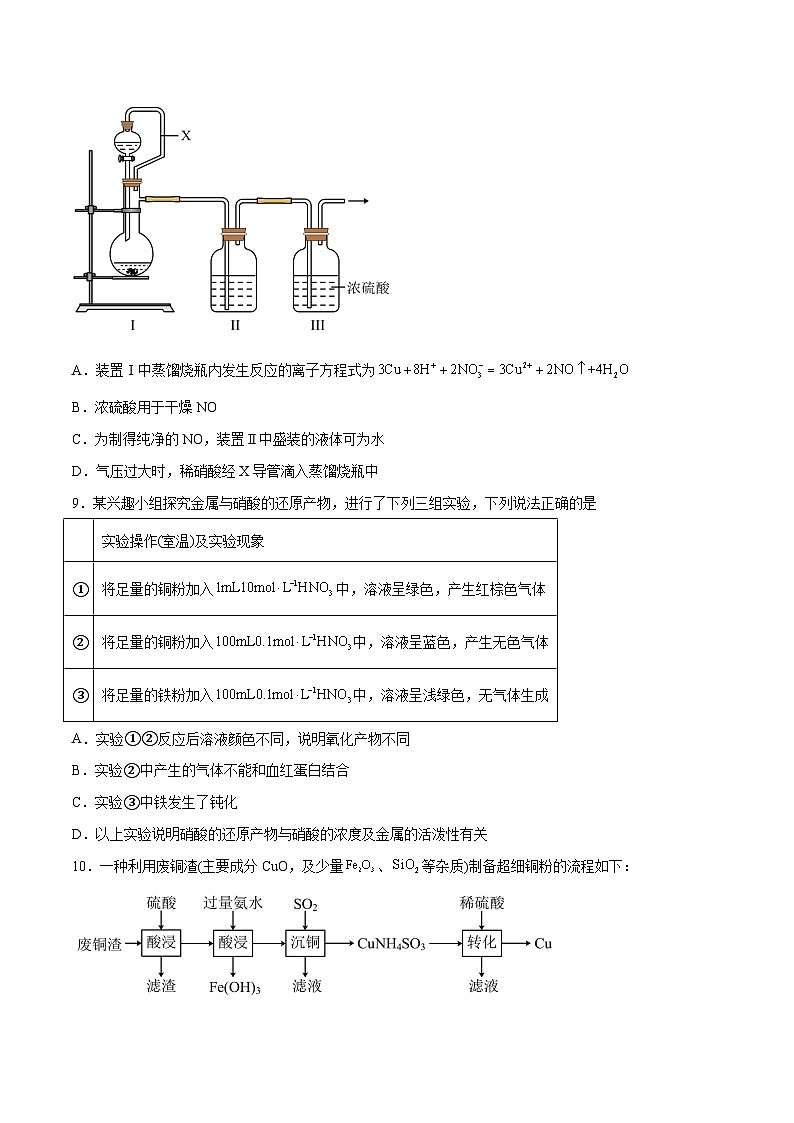
8.某兴趣小组同学用铜与稀硝酸反应制取干燥、纯净的NO气体(装置如图)。下列有关说法错误的是
A.装置Ⅰ中蒸馏烧瓶内发生反应的离子方程式为
B.浓硫酸用于干燥NO
C.为制得纯净的NO,装置Ⅱ中盛装的液体可为水
D.气压过大时,稀硝酸经X导管滴入蒸馏烧瓶中
【答案】D
【解析】用铜与稀硝酸反应制取干燥、纯净的NO气体,装置Ⅰ是发生装置,发生反应的离子方程式为,故A正确;浓硫酸不与NO反应,可用于干燥NO,故B正确;
蒸馏烧瓶内可能有氧气,很容易把生成的NO氧化为NO2,装置Ⅱ中盛装的液体可为水,会发生反应,可制得纯净的NO,故C正确;气压过大时,X导管可以平衡气压,使稀硝酸顺利从分液漏斗中滴入蒸馏烧瓶中,故D错误;故选D。
9.某兴趣小组探究金属与硝酸的还原产物,进行了下列三组实验,下列说法正确的是
A.实验①②反应后溶液颜色不同,说明氧化产物不同
B.实验②中产生的气体不能和血红蛋白结合
C.实验③中铁发生了钝化
D.以上实验说明硝酸的还原产物与硝酸的浓度及金属的活泼性有关
【答案】D
【解析】实验①②反应后溶液颜色相同都是蓝色,氧化产物都是硝酸铜溶液,A项错误;②产生的气体是一氧化氮,一氧化氮会和血红蛋白结合,B项错误;将足量的铁粉加入100mL,中,溶液呈浅绿色,无气体生成,可能发生反应生成了硝酸亚铁和硝酸铵,常温下铁在浓硝酸下发生钝化,C项错误;
实验①②可知,浓硝酸和铜反应生成二氧化氮,铜和稀硝酸反应生成一氧化氮,硝酸的还原产物与硝酸的浓度有关,与金属活泼性有关,D项正确;答案选D。
10.一种利用废铜渣(主要成分CuO,及少量、等杂质)制备超细铜粉的流程如下:
下列说法正确的是
A.“酸浸”所得滤渣的主要成分为
B.若向“沉铁”后所得滤液中加入乙醇,析出的深蓝色晶体为
C.“沉铜”发生的反应为复分解反应
D.“转化”后所得滤液中含有的主要阳离子:、、
【答案】D
【分析】废铜渣(主要成分CuO,及少量、等杂质) “酸浸”时CuO、少量与H2SO4反应生成硫酸铜、硫酸铁,SiO2不溶于H2SO4,所以滤渣的成分是SiO2,滤液中加过量氨水沉铁除去Fe3+,铜离子转化为,所得滤液通二氧化硫沉铜,过滤出产生的CuNH4SO3沉淀,加稀硫酸转化,+1价铜发生歧化反应,得到铜离子、和Cu。
【解析】 据分析,“酸浸”所得滤渣的主要成分为SiO2,A错误;若向“沉铁”后所得滤液中加入乙醇,析出的深蓝色晶体为,B错误;“沉铜”时含有和过量氨水的混合溶液中通入二氧化硫生成CuNH4SO3沉淀,铜元素化合价降低,则发生氧化还原反应,不为复分解反应,C错误;转化时,CuNH4SO3在稀硫酸中发生歧化反应,得到铜离子、和Cu,结合元素守恒可知, “转化”后所得滤液中含有的主要阳离子:、、,D正确;答案选D。
11.甲、乙两烧杯中分别盛有浓度均为的盐酸与溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得同温同压下生成气体的体积之比为,则加入铝粉的质量为
A.B.C.D.
【答案】A
【解析】根据铝和盐酸以及氢氧化钠溶液反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑、2NaOH+2Al+2H2O
=2NaAlO2+3H2↑,若铝少量,则产生等量的氢气,若铝过量,则产生的氢气的体积比为1:3。若反应结束后测得生成的气体体积比为甲:乙=1:2,就要求在和盐酸的反应中,铝是过量的,在和氢氧化钠的反应中,铝是少量的。0.3mlHCl完全反应,生成氢气0.15ml,所以铝和氢氧化钠反应生成氢气0.3ml,需要铝的物质的量为0.2ml,即5.4g;故选A。
12.某固体混合物可能含有Al、、、、、NaCl中的一种或几种,现对该混合物做如图实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积)。下列说法不正确的是
A.步骤①中发生了氧化还原反应
B.步骤②和步骤③中反应消耗的的物质的量之比为3∶1
C.混合物中一定不存在,可能含有NaCl、AlCl3
D.混合物中一定含有,且物质的量为0.2ml
【答案】B
【分析】由题干可知,加过量氢氧化钠溶液产生的白色沉淀久置无明显变化,则固体不含FeCl2,11.60g是氢氧化镁沉淀,,;Al与氢氧化钠溶液产生的氢气为,根据电子得失守恒,; 浓硫酸吸收氨气,,,则固体含Al、(NH4)2SO4、MgCl2的质量为,则余下是AlCl3和NaCl中的一种或两种。
【解析】根据分析,固体含Al,步骤①中Al与氢氧化钠溶液产生氢气为氧化还原反应,A正确;步骤②为H++OH-=H2O和 ,步骤③为,二者反应消耗的H+的物质的量之比因过量氢氧根离子未知而不能计算,B错误;根据分析,混合物中一定不存在FeCl2,可能含有NaCl、AlCl3中的一种或两种,C正确;根据分析,混合物中一定含有MgCl20.2ml,D正确;故选B。
13.某稀硫酸和稀硝酸的混合溶液,平均分成两份。向第一份中逐渐加入铜粉,最多能溶解铜粉;第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为气体)。下列分析或结果错误的是
A.B.产生的气体:段是,BC段是氢气
C.原溶液中浓度为D.第二份溶液中最终溶质为
【答案】A
【分析】由图可知,OA段发生反应:Fe++4H+= Fe3+ +2H2O+ NO↑,反应铁0.3ml;AB段发生反应:2Fe3++Fe=3Fe2+,反应铁0.15ml;BC段发生反应:Fe+2H+=Fe2++H2↑,反应铁0.15ml;C后铁过量;则溶液中氢离子共0.3ml×4+0.15ml×2=1.5ml、硝酸根离子共0.3ml;
【解析】铜和稀硫酸不反应、和稀硝酸反应生成一氧化氮和铜离子,反应为3Cu+8H++2NO=3Cu2++
2NO↑+4H2O,反应中氢离子过量、硝酸根离子完全反应消耗铜0.45ml,质量为28.8g,A错误; 由分析可知,产生的气体:段是,BC段是氢气,B正确;反应最终生成硫酸亚铁,共消耗铁0.6ml,根据FeSO4化学式及硫酸根守恒可知,每份溶液中0.6ml,浓度为0.6ml÷0.1L=,C正确;反应中铁过量,最终生成硫酸亚铁,第二份溶液中最终溶质为,D正确;故选A。
14.将41.2g由Al、Fe、Cu组成的合金等分为两份,将其中一份合金溶于足量的NaOH溶液中,产生气体6.72L(标准状况);另一份合金溶于过量的稀硝酸中,得到VL(标准状况下)NO气体,向反应后的溶液中加入过量的NaOH溶液,过滤得到滤液X和25.4g的沉淀Y(HNO3的还原产物仅为NO),则下列说法正确的是
A.41.2g的合金中含铁5.6gB.滤液X中的溶质只有硝酸钠
C.V为8.96D.沉淀Y中含氢氧化铜9.8g
【答案】C
【解析】每一份合金质量为,其中一份合金溶于足量的NaOH溶液中,只有Al参与反应生成氢气,,根据电子转移守恒可知:,则每一份中;另一份合金溶于过量的稀硝酸中,生成Al3+、Fe3+、Cu2+离子,还有剩余的硝酸,再向反应后的溶液中加入过量的NaOH溶液,生成Fe(OH)3、Cu(OH)2沉淀,则沉淀中,则,设每一份中Fe、Cu的物质的量分别为xml、yml,根据二者总质量、电子转移守恒有,,解得x=0.1,y=0.15,故41.2g的合金中含铁的质量为,A错误;另一份合金溶于过量的稀硝酸中,生成Al3+、Fe3+、Cu2+离子,还有剩余的硝酸,再向反应后的溶液中加入过量的NaOH溶液,滤液中含有偏铝酸钠、硝酸钠、氢氧化钠,B错误;由A中计算知,合金与硝酸反应失去电子为,根据电子转移守恒可知,则标准状况下,C正确;由A中计算知,,则沉淀Y中,D错误;故选C。
15.向含xmlHNO3和ymlH2SO4的混合稀溶液中缓慢加入铁粉,其氧化产物与所加铁粉的物质的量关系如图所示:
下列有关说法正确的是
A.x=0.2,y=0.1
B.a点之前的反应离子方程式为3Fe+8H++2NO=3Fe2++2NO↑+4H2O
C.向b点所得溶液中加入Cu粉,最多可溶解1.92g
D.反应至c点,可收集到气体4.48L(标准状况)
【答案】C
【分析】铁粉加入后,首先和HNO3反应,被氧化成Fe3+,故a段生成0.1 ml Fe3+,a点过后,Fe3+量开始减少,说明此时发生反应Fe+2Fe3+=3Fe2+,当Fe3+完全反应后,Fe2+物质的量仍然在增加,说明发生反应Fe+2H+=Fe2++H2↑,说明a点过后,H+仍然有剩余,故硝酸根在a段完全反应。
【解析】由分析知,硝酸根在a段完全反应转化为NO,由得失电子守恒,得3n(NO)=3n(Fe3+,a),故n(NO)=0.1 ml,由N元素守恒知,n(HNO3)=n(NO)=0.1 ml,由Fe3+反应生成的Fe2+物质的量n1=,则由H+与Fe反应生成的Fe2+物质的量n2=0.2 ml-0.15 ml=0.05 ml,对应H+物质的量=2n2=0.1 ml,a段反应为:Fe++4H+=Fe3++NO↑+2H2O,知该段消耗的H+物质的量=4n(Fe3+,a)=0.4 ml,故溶液中原来共有H+物质的量=0.4 ml+0.1 ml=0.5 ml,则n(H2SO4)=,故x=0.1,y=0.2,A错误;由分析知,a点之前,Fe被氧化为Fe3+,对应离子方程式为Fe++4H+=Fe3++NO↑+2H2O,B错误;b点对应溶液中Fe2+与Fe3+物质的量相等,设反应的Fe3+为x ml,由反应比例2Fe3+~3Fe2+,知此时生成的Fe2+物质的量为1.5x ml,则1.5x=0.1-x,解得x=0.04 ml,故此处溶液中还剩Fe3+物质的量=0.1 ml-0.04 ml=0.06 ml,由反应Cu+2Fe3+=2Fe2++Cu2+,知此时最多可溶解的Cu物质的量=,对应质量=0.03 ml×64 g/ml=1.92 g,C正确;a段生成气体NO物质的量n(NO)=0.1 ml,由A选项分析知,由H+与Fe反应生成的Fe2+物质的量n2=0.2 ml-0.15 ml=0.05 ml,生成H2的物质的量n(H2)=n(Fe2+)=0.05 ml,故整个过程共产生气体0.15 ml,对应体积=0.15 ml×22.4 L/ml=3.36 L,D错误;故选C。
16.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2的一种或几种物质组成。现进行下图实验:
(已知:Cu2O+2H+=Cu+Cu2++H2O且每步反应都充分)下列说法正确的是
A.根据上述步骤可以判断矿物X中n(Cu2O)/n(Fe2O3)>1
B.步骤1中减少的固体一定是混合物
C.根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02ml
D.根据步骤1、2可以判断出X中氧化铁的质量分数为50%
【答案】A
【分析】该矿物12.8g用过量NaOH溶液碱浸,得到10.4g固体,Al2O3 和SiO2能溶于NaOH溶液,则固体可能是Fe2O3、Cu2O,Fe2O3可溶于盐酸,将此固体用过量盐酸酸浸,得到Cu2+蓝色溶液和1.92g铜单质固体。
【解析】最终产物有铜单质固体,结合已知和 ,根据,则判断矿物X中n(Cu2O)/n(Fe2O3)>1,A正确;Al2O3 和SiO2能溶于NaOH溶液,步骤1中减少的固体可能是Al2O3 和SiO2,或是其中一种,B错误;根据Cu2O +2H+=Cu+Cu2++H2O,步骤2得到1.92g铜单质物质的量是0.03ml,又0.03ml的Cu2O质量4.32g,则步骤1得到10.4g固体肯定含有Fe2O3,因,现铜单质剩余,则蓝色溶液n(Cu2+)>0.03ml,C错误;设步骤1得到10.4g固体中Fe2O3xml、Cu2Oyml,则有等式①160x+144y=10.4,根据得到等式②y-x=0.03,联合①②,解得x=0.02,y=0.05,则Fe2O3的质量为0.02×160=3.2(g),可以判断出X中氧化铁的质量分数为,D错误;故选A。
17.CuCl用于石油工业脱硫与脱色,还可用作CO吸附剂和脱氧剂。CuCl是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。
Ⅰ.利用以下装置可制备CuCl
已知:为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
(1)制取:A中发生的反应氧化剂和还原剂的物质的量之比为_______,为吸收尾气,C中可选用试剂_______(填标号)。
A.溶液 B.饱和食盐水 C.溶液 D.浓
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,B中依次发生反应的离子方程式为:
①
②_______
③
观察到_______时停止反应。将B中溶液倾入盛有_______的烧杯中,立即得到白色CuCl沉淀。过滤得CuCl粗品。
(3)洗涤CuCl:洗涤时最好用_______(填序号)洗涤滤饼3~4次,其目的是_______。
a. b.稀硫酸 c.95%的乙醇
Ⅱ.工业上常用CuCl作、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、、和的含量。
已知:和KOH的混合溶液也能吸收氧气。
(4)装置的连接顺序应为_______。
(5)用D装置测含量,若读数时右侧量气管液面高于左侧液面,则测得含量_______(填“偏大”“偏小”或“不变”)。
【答案】(1) 1:5 AC
(2)Cu2++Cu+2Cl-=2CuCl 溶液中蓝色褪去变为无色 蒸馏水
(3)c 乙醇挥发可带走CuCl表面的水分防止其被氧化
(4)C→B→A→D
(5)偏小
【分析】浓盐酸和高锰酸钾反应生成氯气,氯气进入B中与铜粉、NaCl反应生成Na2[CuCl3],C为尾气处理装置,用于吸收多余的氯气。
【解析】(1)A中高锰酸钾和HCl反应生成氯气,化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2
+8H2O,该反应中氧化剂为KMnO4,还原剂为HCl,其中16个HCl中有10个HCl是还原剂,则氧化剂和还原剂的物质的量之比为1:5。
A.亚硫酸钠可被氯气氧化从而吸收氯气,A正确;
B.氯气在饱和食盐水中溶解度小,无法用饱和食盐水吸收氯气,B错误;
C.氯化亚铁可被氯气氧化从而吸收氯气,C正确;
D.浓硫酸不与氯气反应,不能用浓硫酸吸收氯气,D错误;
故答案选AC。
(2)铜离子、氯离子和铜可反应生成氯化亚铜,离子方程式为Cu2++Cu+2Cl-=2CuCl。Na2[CuCl3]为无色溶液,CuCl为白色固体,故当溶液中蓝色褪去变为无色时停止反应。Na2[CuCl3]为无色溶液,加水稀释即析出CuCl,将B中溶液倾入盛有蒸馏水的烧杯中,立即得到白色CuCl沉淀,过滤得到CuCl粗品。
(3)CuCl不溶于水和乙醇,但是在潮湿的空气中可被迅速氧化,因此最好使用95%的乙醇洗涤,乙醇挥发可带走CuCl表面的水分防止其被氧化。
(4)用KOH溶液吸收CO2,然后用Na2S2O4和KOH的混合溶液吸收O2,再用A吸收CO,最后用排水法测量氮气的体积,则装置的连接顺序为C→B→A→D。
(5)若右侧量气管液面高于左侧,则左侧气体压强大于大气压,气体受到压迫测得的N2含量偏小。
18.工业上常以黄铁矿烧渣(主要成分为Fe2O3, 含有少量FeO、SiO2、 Al2O3、 CaO、MgO等杂质)为原料制备水处理剂聚合硫酸铁,n>2、m<10},其工艺流程如图所示:
已知: Ksp[Fe(OH)3]= 1.0×10- 38、Ksp[Fe(OH)2]=8×10-16、 Ksp[Mg(OH)2]=1.0×10-11;当某离子浓度≦1.0×10-5ml·L-1时,认为该离子沉淀完全。
回答下列问题:
(1)为了提高黄铁矿烧渣的“碱浸”速率,可以采取的措施有__________(至少 答两条)。
(2)“碱浸”过程中,杂质与NaOH反应的离子方程式为_____________。
(3)“酸溶1”所得滤渣的主要成分为________(填化学式),在实验室中分离出滤渣的操作名称为___________。
(4)“氧化”工序中加入H2O2溶液的目的是________________________。
(5)若“氧化”后的溶液中Mg2+浓度为0.1 ml·L-1, 则常温下“沉铁”时需满足的pH范围是_______________。
【答案】(1)将烧渣粉碎、搅拌、适当升温、适当增大NaOH溶液浓度
(2)SiO2+2OH- =+H2O ,Al2O3+2OH-= 2 +H2O或Al2O3+2OH- +3H2O=2[Al(OH)4] -
(3) CaSO4 过滤
(4)将Fe2+氧化为Fe3+, 提高聚合硫酸铁产品的产量
(5)3≦pH<9
【分析】黄铁矿烧渣(主要成分为Fe2O3, 含有少量FeO、SiO2、 Al2O3、 CaO、MgO等杂质)加入氢氧化钠溶液,氧化铝和二氧化硅溶解,生成偏铝酸钠和硅酸钠,经过过滤进入到滤液中,滤渣中加入硫酸,金属氧化物都溶解,分别生成硫酸铁和硫酸亚铁,硫酸钙和硫酸镁,硫酸钙不溶于水,过滤形成滤渣,滤液中加入过氧化氢溶液,亚铁离子被氧化生成铁离子,通入氨气调节pH,生成氢氧化铁沉淀,沉淀中加入硫酸形成硫酸铁溶液,最后得到聚合硫酸铁。据此解答。
【解析】(1)为了提高碱浸速率,可以将烧渣粉碎、搅拌、适当升温、适当增大NaOH溶液浓度。
(2)碱浸过程中氧化铝和二氧化硅与氢氧化钠反应,反应的离子方程式为:SiO2+2OH- =+H2O ,Al2O3+2OH-= 2 +H2O或Al2O3+2OH- +3H2O=2[Al(OH)4] -。
(3)酸溶1所得滤渣为硫酸钙,分离滤渣的操作为过滤。
(4)加入过氧化氢将亚铁离子氧化为铁离子,便于与其他离子进行分离,提高聚合硫酸铁产品的产量。
(5)铁离子完全沉淀时浓度为≦1.0×10-5ml·L-1,则ml·L-1,对应的pH为3,镁离子开始沉淀时ml·L-1,对应的pH为9,则常温下“沉铁”时需满足的pH范围是3≦pH<9。
19.FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验,回答下列问题:
I.铁粉制备FeCl3(实验装置如图所示)
(1)仪器a盛装的物质是为_______(填试剂的名称);装置中F的作用:_______。
(2)硬质玻璃管直接接入收集器的优点是_______。
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1ml/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______(填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______(填“反应i”或“反应ii”)。小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______。
【答案】(1) 浓盐酸 尾气吸收,并防止空气中的水蒸气进入收集器
(2)不易因为FeCl3固体积聚而造成堵塞
(3)抑制Fe3+的水解
(4)2Fe3++Cu=Cu2+ +2Fe2+
(5) CuSCN 反应i
(6)Cu2+ +Fe2+ +SCN-=CuSCN↓+Fe3+
【分析】FeCl3易升华、易潮解,实验室制备FeCl3,根据图示可知,D为FeCl3的发生装置,E为收集装置,A装置用二氧化锰和浓盐酸加热反应制取氯气,由于HCl易挥发,且该实验需干燥氯气,则B中盛饱和食盐水,用于除去氯气中的HCl,C中盛浓硫酸,用于干燥氯气;F装置中的碱石灰用于尾气吸收,并防止空气中的水蒸气进入E,据此分析解答。
【解析】(1)①由分析可知用二氧化锰和浓盐酸加热反应制取氯气;
②尾气吸收,并防止空气中的水蒸气进入收集器;
(2)与细导管相比,硬质玻璃管直接接入收集器可以防止堵塞;
(3)FeCl3为强酸弱碱盐,Fe3+易发生水解,配制溶液时加入少量盐酸,可使水解平衡逆向移动,抑制水解;
(4)向FeCl3溶液中滴加几滴KSCN溶液,生成红色的配合物,,再加入过量Cu粉,2Fe3++Cu=Cu2+ +2Fe2+,Fe3+浓度减小,平衡逆向移动,使溶液的红色褪去,故答案为:2Fe3++Cu=Cu2+ +2Fe2+;
(5)①向4 mL 0.1 ml·L-1FeCl3溶液中加入过量Cu粉,溶液中生成了Fe2+和Cu2+,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成,则发生的反应为2Cu2+ + 4SCN- = 2CuSCN↓+ (SCN)2,即可确定此白色沉淀为CuSCN;
②在盛有2 mL 0.1ml·L-1 CuSO4溶液的试管中滴加KSCN溶液,溶液很快由蓝色变为绿色,说明有淡黄色的[ Cu(SCN)4]2 –生成,24h后,溶液绿色变浅,试管底部有白色沉淀,说明有CuSCN生成,由此现象可知,反应速率较快的为反应i,说明反应ii不是CuSCN产生的主要原因;
(6)Cu2+、 Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,Cu元素化合价从+2价降低到+1价,Fe元素化合价从+2价升高到+3价,根据得失电子守恒、电荷守恒和原子守恒,写出反应的离子方程式为:Cu2+ +Fe2+ +SCN-=CuSCN↓+Fe3+。
20.某实验小组在研究硝酸与铜的反应时,发现稀硝酸和铜反应后的混合液为蓝色,而浓硝酸和铜反应后的混合液为绿色,为此对产生绿色的原因开展探究。按要求完成下列问题:
[猜想假设]
(1)假设1:___________
假设2:硝酸铜溶液中溶解了
[实验操作及现象分析]
实验一:向蒸馏水中不断加入硝酸铜晶体,最终配成饱和溶液。配制过程中溶液颜色始终是蓝色,未见绿色出现。
甲同学根据实验一的现象证明了假设1不成立,请补全假设。
实验二:
(2)甲同学在实验一的基础上继续开展了实验二,并初步验证了假设2成立,他的实验操作及现象是___________。
乙同学认为假设2不严谨,用以下实验对假设2进行了深入探究:
实验三:
(3)结合实验三,乙同学认为假设2不严谨的证据是___________
(4)乙同学查阅资料发现:
①铜与浓硝酸反应后溶液呈现绿色是由于HNO2(或)与铜离子作用的结果。
②金属和浓HNO3的反应一旦发生后速率不断加快。原因是过程中有HNO2生成。如和浓HNO3反应,开始生成的NO2溶于水形成HNO2,它再和反应,速率就大大加快。
请依据资料完成以下离子反应方程式。
i.;___________
ii.;___________
iii.
实验四:乙同学通过以下实验证实了反应过程中HNO2的生成。
(5)结合化学用语,解释实验3产生该现象的原因是___________。
【答案】(1)硝酸铜溶液颜色与溶液浓度有关
(2)加热硝酸铜溶液,温度升高,放出红棕色气体,溶液颜色变为蓝色
(3)向混合溶液中通入氮气会将溶液中溶解的二氧化氮气体带出,而溶液仍保持一段时间绿色
(4) 2NO2+H2O=HNO2+H++NO Cu+2HNO2+2H+=Cu2++2H2O+2NO↑
(5)过氧化氢具有强氧化性,和亚硝酸反应生成硝酸,导致溶液中亚硝酸的浓度降低
【解析】(1)结合实验一操作可知,实验探究的是硝酸铜溶液浓度对溶液颜色的影响,故假设1:硝酸铜溶液颜色与溶液浓度有关;
(2)猜想2为硝酸铜溶液中溶解了NO2且甲同学初步验证了假设2成立,则实验设计可以为:加热硝酸铜溶液,温度升高二氧化氮气体溶解度减小而逸出,放出红棕色气体,溶液颜色变为蓝色,说明颜色的变化与溶解了二氧化氮气体有关;
(3)实验三向混合溶液中通入氮气会将溶液中溶解的二氧化氮气体带出,而溶液仍保持一段时间绿色,说明绿色的产生不是溶解二氧化氮气体的原因,假设2不严谨;
(4)由资料可知,NO2溶于水形成HNO2,反应中氮元素化合价降低则必须有元素化合价升高,则部分氮元素化合价升高生成硝酸,反应i为:2NO2+H2O=HNO2+H++NO3-;由反应iii可知,一氧化氮参与可反应,则在反应ii中生成了一氧化氮气体,故反应ii为:Cu+2HNO2+2H+=Cu2++2H2O+2NO↑;
(5)已知:①铜与浓硝酸反应后溶液呈现绿色是由于HNO2(或NO2-)与铜离子作用的结果;②金属和浓HNO3的反应一旦发生后速率不断加快,原因是过程中有HNO2生成。实验3中反应较慢,溶液变为蓝色的原因是过氧化氢具有强氧化性,和亚硝酸反应生成硝酸,导致溶液中亚硝酸的浓度降低,反应速率减慢,溶液变蓝。
选项
劳动项目
解释
A
用SO2漂白纸浆
SO2具有还原性
B
用铝制容器贮运浓硝酸
铝遇浓硝酸钝化
C
模具注入熔融钢水之前必须干燥
铁与H2O在高温下会反应
D
用固体管道疏通剂(主要成分为NaOH和铝粉)疏通管道
与铝粉和NaOH溶液反应产生气体有关
实验操作(室温)及实验现象
①
将足量的铜粉加入中,溶液呈绿色,产生红棕色气体
②
将足量的铜粉加入中,溶液呈蓝色,产生无色气体
③
将足量的铁粉加入中,溶液呈浅绿色,无气体生成
操作
现象
在盛有2mL0.1ml·L-1CuSO4溶液的试管中滴加KSCN溶液
溶液很快由蓝色变为绿色,未观察到白色沉淀;
2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀
操作及试剂
现象
向浓硝酸和铜反应后的混合液中通入
大量红棕色气体放出,短时间内溶液仍保持绿色。长时间后变成蓝色
实验
操作
现象
1
向试管a中加入lmL浓硝酸,再插入铜丝
快速产生红棕色气体,溶液变为绿色
2
向试管b中加入1mL浓硝酸,3滴蒸馏水,再插入铜丝
快速产生红棕色气体溶液变为绿色
3
向试管c中加入1mL浓硝酸,3滴,再插入铜丝
反应较慢,溶液变为蓝色
相关试卷
这是一份第33讲 烃的衍生物- 2024年高考化学大一轮复习【精讲精练】,文件包含第33讲烃的衍生物讲-2024年高考化学大一轮复习精讲精练原卷版docx、第33讲烃的衍生物练-2024年高考化学大一轮复习精讲精练原卷版docx、第33讲烃的衍生物讲-2024年高考化学大一轮复习精讲精练解析版docx、第33讲烃的衍生物练-2024年高考化学大一轮复习精讲精练解析版docx等4份试卷配套教学资源,其中试卷共55页, 欢迎下载使用。
这是一份第32讲 烃的性质- 2024年高考化学大一轮复习【精讲精练】,文件包含第32讲烃的性质讲-2024年高考化学大一轮复习精讲精练原卷版docx、第32讲烃的性质练-2024年高考化学大一轮复习精讲精练原卷版docx、第32讲烃的性质练-2024年高考化学大一轮复习精讲精练解析版docx、第32讲烃的性质讲-2024年高考化学大一轮复习精讲精练解析版docx等4份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。
这是一份第19讲 化学平衡- 2024年高考化学大一轮复习【精讲精练】,文件包含第19讲化学平衡讲-2024年高考化学大一轮复习精讲精练原卷版docx、第19讲化学平衡练-2024年高考化学大一轮复习精讲精练原卷版docx、第19讲化学平衡讲-2024年高考化学大一轮复习精讲精练解析版docx、第19讲化学平衡练-2024年高考化学大一轮复习精讲精练解析版docx等4份试卷配套教学资源,其中试卷共62页, 欢迎下载使用。












