

专题讲座(四)反应速率、平衡图像题解题策略(练)- 2024年高考化学大一轮复习【专题讲座】
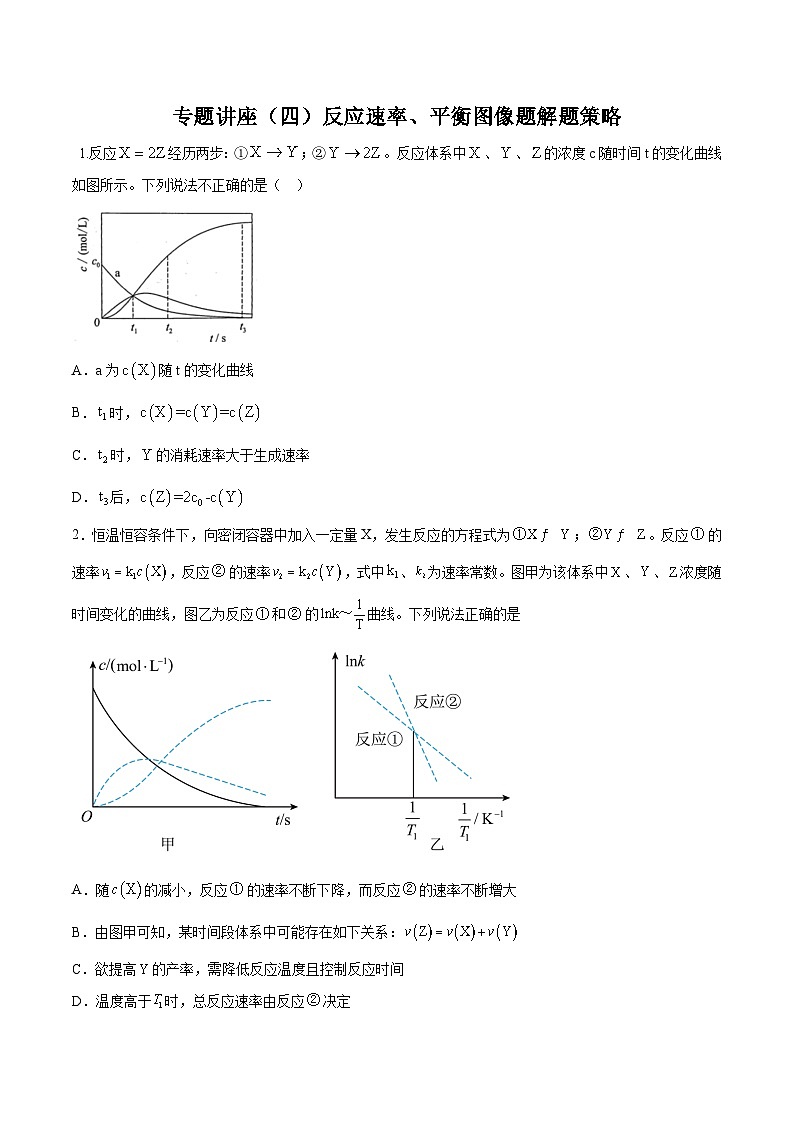
展开A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
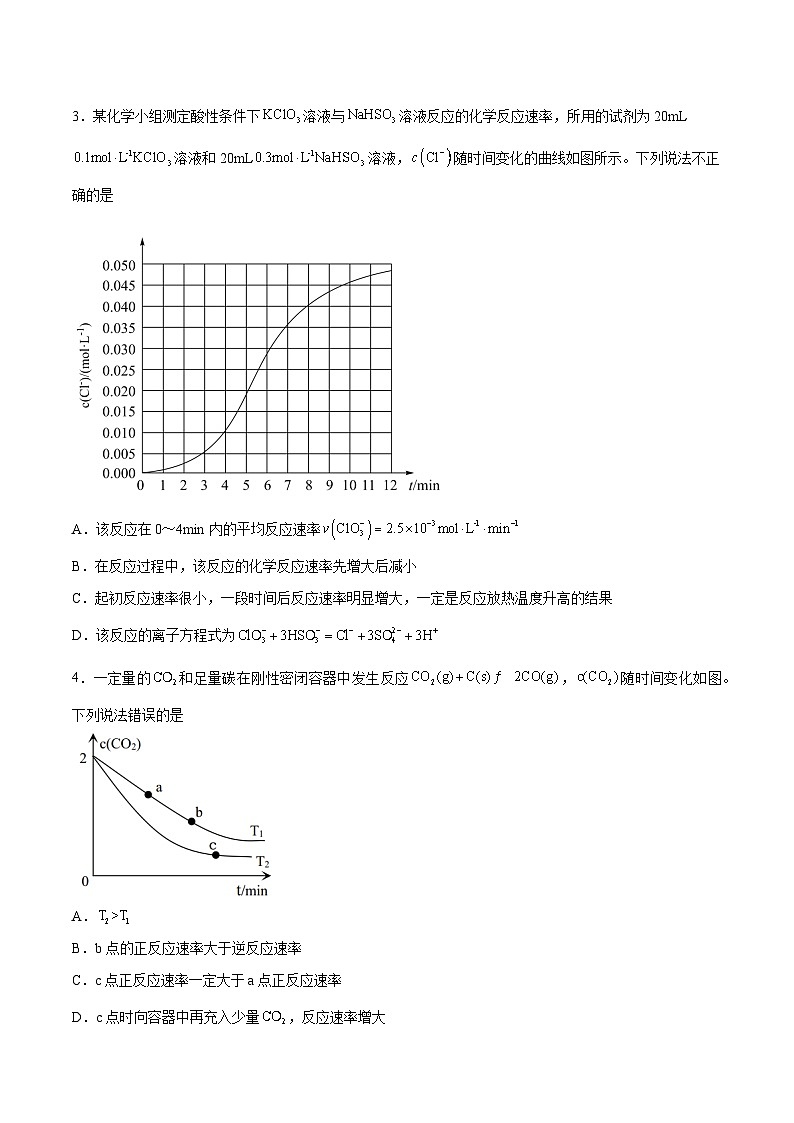
2.恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为;。反应的速率,反应的速率,式中、为速率常数。图甲为该体系中、、浓度随时间变化的曲线,图乙为反应和的曲线。下列说法正确的是
A.随的减小,反应的速率不断下降,而反应的速率不断增大
B.由图甲可知,某时间段体系中可能存在如下关系:
C.欲提高的产率,需降低反应温度且控制反应时间
D.温度高于时,总反应速率由反应决定
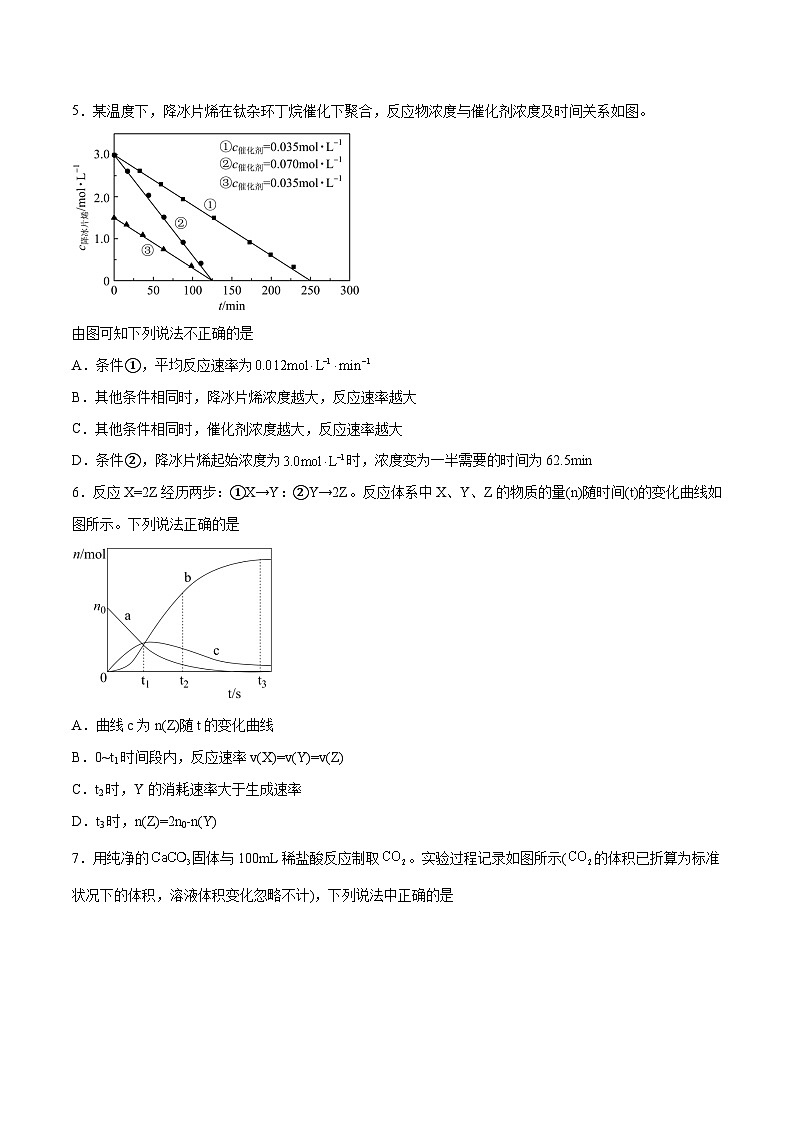
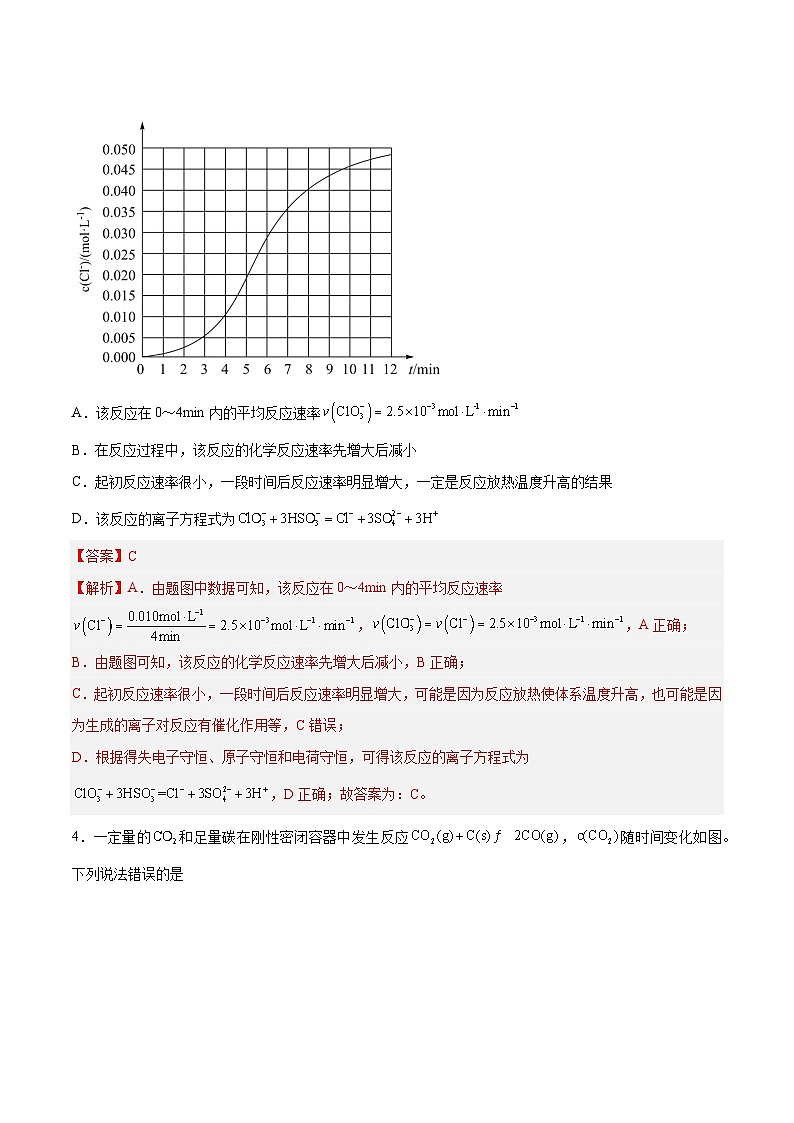
3.某化学小组测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为20mL溶液和20mL溶液,随时间变化的曲线如图所示。下列说法不正确的是
A.该反应在0~4min内的平均反应速率
B.在反应过程中,该反应的化学反应速率先增大后减小
C.起初反应速率很小,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
D.该反应的离子方程式为
4.一定量的和足量碳在刚性密闭容器中发生反应,随时间变化如图。下列说法错误的是
A.
B.b点的正反应速率大于逆反应速率
C.c点正反应速率一定大于a点正反应速率
D.c点时向容器中再充入少量,反应速率增大
5.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。
由图可知下列说法不正确的是
A.条件①,平均反应速率为
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.其他条件相同时,催化剂浓度越大,反应速率越大
D.条件②,降冰片烯起始浓度为时,浓度变为一半需要的时间为62.5min
6.反应X=2Z经历两步:①X→Y:②Y→2Z。反应体系中X、Y、Z的物质的量(n)随时间(t)的变化曲线如图所示。下列说法正确的是
A.曲线c为n(Z)随t的变化曲线
B.0~t1时间段内,反应速率v(X)=v(Y)=v(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3时,n(Z)=2n0-n(Y)
7.用纯净的固体与100mL稀盐酸反应制取。实验过程记录如图所示(的体积已折算为标准状况下的体积,溶液体积变化忽略不计),下列说法中正确的是
A.OE段表示的平均反应速率最大
B.EF段,用盐酸表示该反应的平均反应速率为0.04ml/(L·min)
C.FG段温度对反应速率的影响比浓度大
D.OE、EF、FG三段中,用表示的平均反应速率之比为2:4:1
8.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8ml•L-1•min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
9.在相同条件下研究催化剂Ⅰ、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图所示。下列说法正确的是
A.无催化剂时,反应不能进行
B.催化剂Ⅱ比催化剂Ⅰ效率更高
C.a曲线表示使用催化剂Ⅰ时A的浓度随t的变化
D.使用催化剂Ⅱ时,0~2min内,
10.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)===2H2(g)+2CO(g) ΔH=+247.1 kJ·ml-1
H2(g)+CO2(g)===H2O(g)+CO(g) ΔH=+41.2 kJ·ml-1
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线A表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
11.工业上可以利用水煤气(、)合成二甲醚(),同时生成。合成过程中,主要发生三个反应,℃时,有关反应及相关数据如下。
保持原料气组成、压强、反应时间等因素不变,进行实验,测得转化率随温度变化曲线如下图。下列说法不正确的是
A.℃时,水煤气合成二甲醚的热化学方程式:
B.℃时,增大压强、加入催化剂均可提高的平衡转化率
C.220℃~240℃时,温度升高反应速率加快,转化率升高
D.温度高于240℃时,温度升高转化率降低的原因可能是平衡逆向移动
12.观察图:对合成氨反应中,下列叙述错误的是
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达t1时,正反应速率与逆反应速率相等,反应停止
D.反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
13.向绝热恒容密闭容器中通入A和B,在一定条件下发生反应,正反应速率随时间的变化关系如图所示,下列结论正确的是
A.气体A的浓度:a点小于b点
B.若,则气体C的生成量:ab段大于bc段
C.c点时:
D.体系压强不再变化,说明反应达到平衡状态
14.汽车尾气净化的主要原理为 。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确并能说明反应在时刻才达到平衡状态的是
A.B.
C.D.
15.恒温恒容密闭容器中充入1 ml CO2和3 ml H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图。下列说法错误的是
A.该密闭容器的体积为1 L
B.反应达平衡,氢气的转化率为75%
C.反应达平衡,氢气平均反应速率0.075 ml/(L·min)
D.CO2或H2O物质的量不再改变时反应达平衡
16.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量的变化如图所示,下列对该反应的推断不合理的是
A.在0~6s内,C的化学反应速率约为0.067 ml·L-1·s-1
B.6s后,反应停止了
C.该反应的化学方程式为3B+4C⇌6A+2D
D.在0~4s内,v(A)=3v(D)
17.若在绝热、恒容的密闭容器中充入一定量的SO2Cl2(g)和SCl2(g),发生反应: SO2Cl2(g)+SCl2(g) 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是
A.a和cB.b和dC.c和dD.b和c
18.已知X(g)和Y(g)可以相互转化:2X(g)⇌Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30 min内用X表示的平均化学反应速率是0.08 ml·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
19.近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacn发明的直接氧化法为:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)。如图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(300 ℃)______K(400 ℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400 ℃)=______(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是________、________。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是___________________________。(写出2种)
20.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅱ:3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH=-254 kJ·ml-1
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2________p1(填“>”或“<”),得出该结论的理由是_________________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+________===________+________+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=________。
②比较A、B、C,可得出的结论是________________________________________________。
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:__________________________________________________________________________________。
序号
A
B
C
D
试剂组成
0.4 ml·L-1 KI
a ml·L-1 KI
0.2 ml·L-1 H2SO4
0.2 ml·L-1 H2SO4
0.2 ml·L-1 KI
0.0002 ml I2
实验现象
溶液变黄,一段时间后出现浑浊
溶液变黄,出现浑浊较A快
无明显现象
溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快
专题讲座(三)“位-构-性”综合推断题的解题方法(练)- 2024年高考化学大一轮复习【专题讲座】: 这是一份专题讲座(三)“位-构-性”综合推断题的解题方法(练)- 2024年高考化学大一轮复习【专题讲座】,文件包含专题讲座三“位-构-性”综合推断题的解题方法练-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座三“位-构-性”综合推断题的解题方法练-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
专题讲座(4)反应速率、平衡图像题解题策略(练)- 2024年高考化学大一轮复习【讲义+练习+专题】: 这是一份专题讲座(4)反应速率、平衡图像题解题策略(练)- 2024年高考化学大一轮复习【讲义+练习+专题】,文件包含专题讲座四反应速率平衡图像题解题策略练-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座四反应速率平衡图像题解题策略练-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
专题讲座(4)反应速率、平衡图像题解题策略(讲)- 2024年高考化学大一轮复习【讲义+练习+专题】: 这是一份专题讲座(4)反应速率、平衡图像题解题策略(讲)- 2024年高考化学大一轮复习【讲义+练习+专题】,文件包含专题讲座四反应速率平衡图像题解题策略讲-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座四反应速率平衡图像题解题策略讲-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。












