

所属成套资源:2024年高考化学大一轮复习
专题讲座(七)晶胞的分析与计算(讲)- 2024年高考化学大一轮复习【专题讲座】
展开
这是一份专题讲座(七)晶胞的分析与计算(讲)- 2024年高考化学大一轮复习【专题讲座】,文件包含专题讲座七晶胞的分析与计算讲-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座七晶胞的分析与计算讲-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
1.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
【必备知识解读】
一、晶体结构与性质
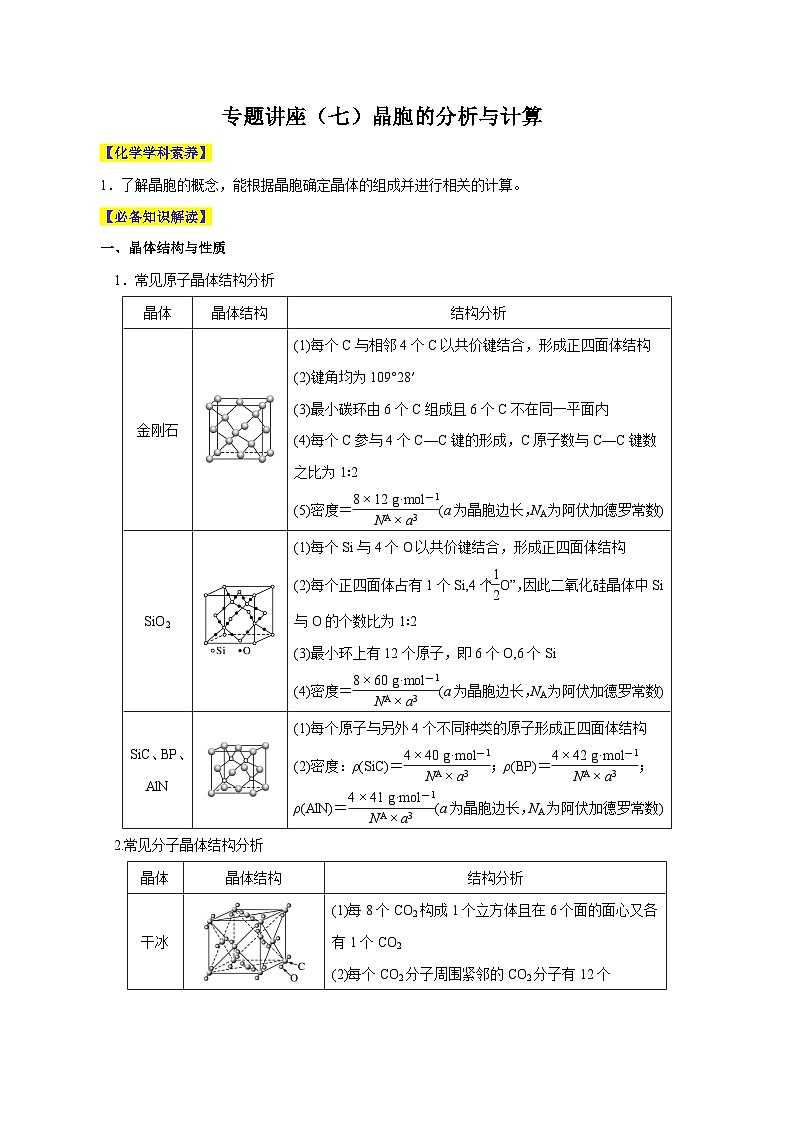
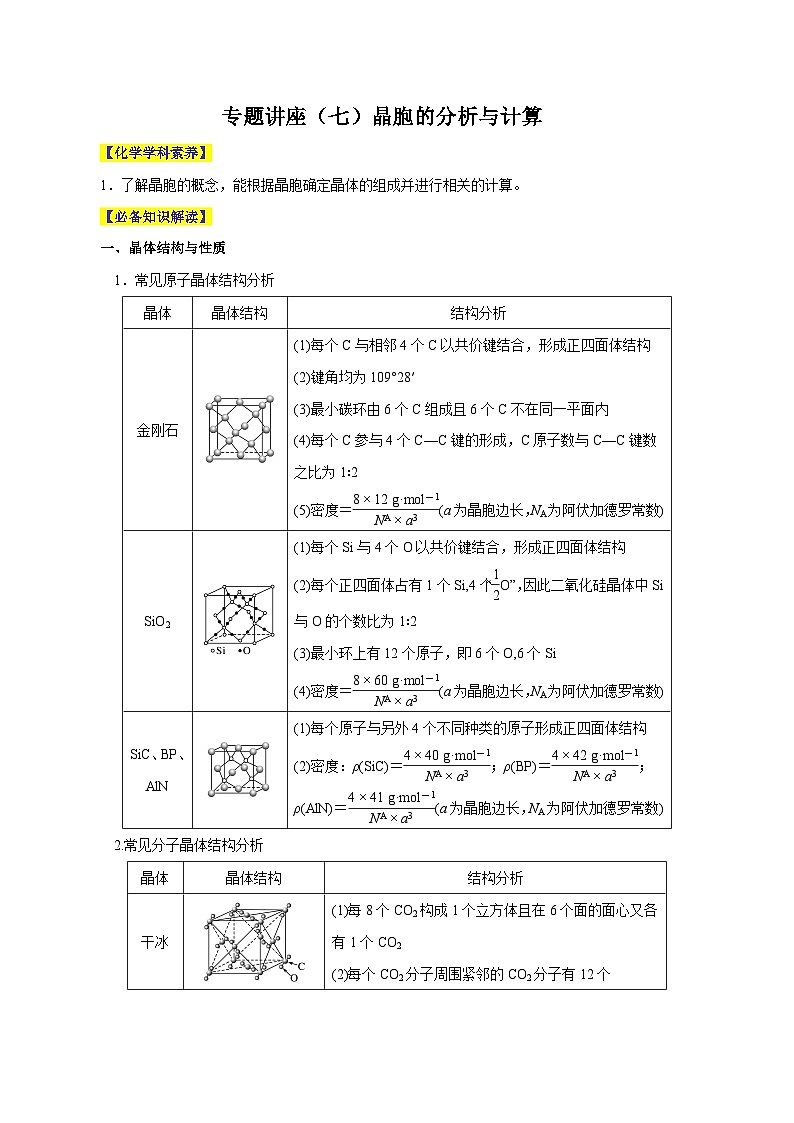
1.常见原子晶体结构分析
2.常见分子晶体结构分析
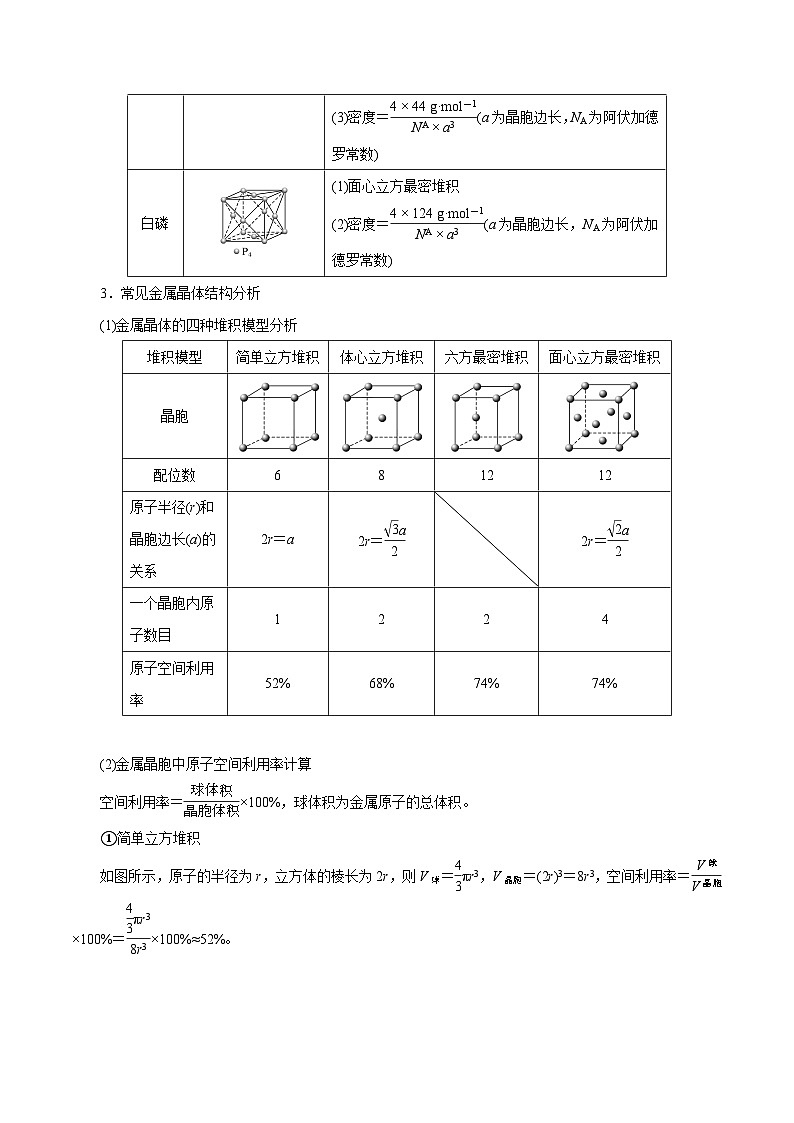
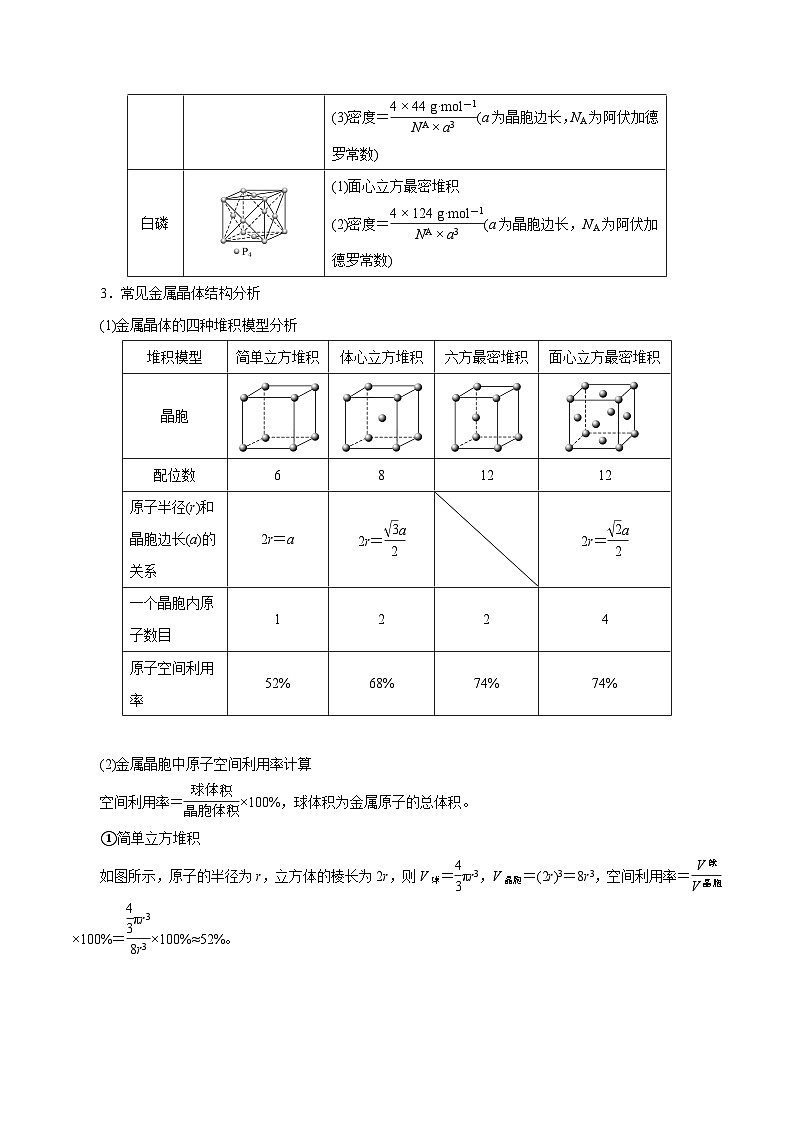
3.常见金属晶体结构分析
(1)金属晶体的四种堆积模型分析
(2)金属晶胞中原子空间利用率计算
空间利用率=eq \f(球体积,晶胞体积)×100%,球体积为金属原子的总体积。
①简单立方堆积
如图所示,原子的半径为r,立方体的棱长为2r,则V球=eq \f(4,3)πr3,V晶胞=(2r)3=8r3,空间利用率=eq \f(V球,V晶胞)×100%=eq \f(\f(4,3)πr3,8r3)×100%≈52%。
②体心立方堆积
如图所示,原子的半径为r,体对角线c为4r,面对角线b为eq \r(2)a,由(4r)2=a2+b2得a=eq \f(4,\r(3))r。1个晶胞中有2个原子,故空间利用率=eq \f(V球,V晶胞)×100%=eq \f(2×\f(4,3)πr3,a3)×100%=eq \f(2×\f(4,3)πr3,\f(4,\r(3))r3)×100%≈68%。
③六方最密堆积
如图所示,原子的半径为r,底面为菱形(棱长为2r,其中一个角为60°),则底面面积S=2r×eq \r(3)r=2eq \r(3)r2,h=eq \f(2\r(6),3)r,V晶胞=S×2h=2eq \r(3)r2×2×eq \f(2\r(6),3)r=8eq \r(2)r3,1个晶胞中有2个原子,则空间利用率=eq \f(V球,V晶胞)×100%=eq \f(2×\f(4,3)πr3,8\r(2)r3)×100%≈74%。
④面心立方最密堆积
如图所示,原子的半径为r,面对角线为4r,a=2eq \r(2)r,V晶胞=a3=(2eq \r(2)r)3=16eq \r(2)r3,1个晶胞中有4个原子,则空间利用率=eq \f(V球,V晶胞)×100%=eq \f(4×\f(4,3)πr3,16\r(2)r3)×100%≈74%。
(3)晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 ml该晶胞中含有x ml 微粒,其质量为xM g(M为微粒的相对分子质量);若该晶胞的质量为ρa3 g(a3为晶胞的体积),则1 ml晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
4.常见离子晶体结构分析
(1)典型离子晶体模型
(2)晶格能
①定义:气态离子形成1摩离子晶体释放的能量。晶格能是反映离子晶体稳定性的数据,可以用来衡量离子键的强弱,晶格能越大,离子键越强。
②影响因素:晶格能的大小与阴阳离子所带电荷、阴阳离子间的距离、离子晶体的结构类型有关。离子所带电荷越多,半径越小,晶格能越大。
③对离子晶体性质的影响:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
二、晶胞的相关计算
晶胞计算的思维方法
(1)“均摊法”原理
特别提醒:
①在使用“均摊法”计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可以用“均摊法”。
(2)晶胞中各线段之间的关系
(3)晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 ml该晶胞中含有x ml微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 ml晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
三、宏观晶体密度与微观晶胞参数的关系
【核心题型例解】
高频考点一 晶胞粒子和化学式的计算
【例1】(2023·辽宁卷第14题)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A. 图1晶体密度为g∙cm-3 B. 图1中O原子的配位数为6
C. 图2表示的化学式为 D. 取代产生的空位有利于传导
【答案】C
【解析】根据均摊法,图1的晶胞中含Li:8× EQ \f(1,4)+1=3,O:2× EQ \f(1,2)=1,Cl:4× EQ \f(1,4)=1,1个晶胞的质量为g=g,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为g÷(a3×10-30cm3)=g/cm3,A项正确;图1晶胞中,O位于面心,与O等距离最近的Li有6个,O原子的配位数为6,B项正确;根据均摊法,图2中Li:1,Mg或空位为8× EQ \f(1,4)=2。O:2× EQ \f(1,2)=1,Cl或Br:4× EQ \f(1,4)=1,Mg的个数小于2,根据正负化合价的代数和为0,图2的化学式为LiMgOClxBr1-x,C项错误;进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料,说明Mg2+取代产生的空位有利于Li+的传导,D项正确;故选C。
【变式探究】(2023·湖北卷第15题)镧La和H可以形成一系列晶体材料,在储氢和超导等领域具有重要应用。,属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是( )
A. 晶体中La的配位数为8
B. 晶体中H和H的最短距离:
C. 在晶胞中,H形成一个顶点数为40的闭合多面体笼
D. 单位体积中含氢质量的计算式为
【答案】C
【解析】由LaH2的晶胞结构可知,La位于顶点和面心,晶胞内8个小立方体的中心各有1个H原子,若以顶点La研究,与之最近的H原子有8个,则La的配位数为8,故A正确;
由LaHX晶胞结构可知,每个H结合4个H形成类似CH4的结构,H和H之间的最短距离变小,则晶体中H和H的最短距离:,故B正确;由题干信息可知,在LaHX晶胞中,每个H结合4个H形成类似CH4的结构,这样的结构有8个,顶点数为4×8=32,且不是闭合的结构,故C错误;1个LaHX晶胞中含有5×8=40个H原子,含H质量为g,晶胞的体积为(484.0×10-10cm)3=(4.84×10-8)3cm3,则LaHX单位体积中含氢质量的计算式为,故D正确;故选C。
【变式探究】(2023·浙江选考第17题)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________,该化合物的化学式为___________。
【答案】共价晶体 SiP2
【解析】 Si与P形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有个Si,8个P,故该化合物的化学式为SiP2。
【变式探究】(2023·全国乙卷第35题)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有_______个。该物质化学式为_______,B-B最近距离为_______。
【答案】3 MgB2
【解析】由硼镁化合物的晶体结构、晶胞沿c轴的投影图可知,Mg位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有个Mg,B在正六棱柱体内共6个,则该物质的化学式为MgB2;由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为,因此B-B最近距离为。
高频考点二 晶胞密度计算
【例2】(2023·湖南卷第11题)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为NA。下列说法错误的是
A.晶体最简化学式为KCaB6C6
B. 晶体中与K+最近且距离相等的Ca2+有8个
C. 晶胞中B和C原子构成的多面体有12个面
D. 晶体的密度为
【答案】C
【解析】根据晶胞结构可知,其中K个数:8× EQ \f(1,8)=1,其中Ca个数:1,其中B个数:12× EQ \f(1,2)=6,其中C个数:12× EQ \f(1,2)=6,故其最简化学式为KCaB6C6,A正确;根据晶胞结构可知,K+位于晶胞体心,Ca位于定点,则晶体中与K+最近且距离相等的Ca2+有8个,B正确;根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,C错误;根据选项A分析可知,该晶胞最简化学式为KCaB6C6,则1个晶胞质量为:,晶胞体积为a3×10-30cm3,则其密度为,D正确;故选C。
【变式探究】(2023·全国甲卷第35题)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为_______。的熔点为,远高于的,由此可以判断铝氟之间的化学键为_______键。结构属立方晶系,晶胞如图3b所示,的配位数为_______。若晶胞参数为,晶体密度_______(列出计算式,阿伏加德罗常数的值为)。
【答案】sp3 离子 2
【解析】由Al2Cl6的空间结构结合相关元素的原子结构可知,Al原子价层电子对数是4,其与其周围的4个氯原子形成四面体结构,因此,二聚体中A1的轨道杂化类型为sp3。AlF3的熔点为1090℃,远高于AlCl3的192℃,由于F的电负性最大,其吸引电子的能力最强,因此,可以判断铝氟之间的化学键为离子键。由AlF3的晶胞结构可知,其中含灰色球的个数为,红色球的个数为,则灰色的球为,距最近且等距的有2个,则的配位数为2。若晶胞参数为a pm,则晶胞的体积为,晶胞的质量为,则其晶体密度。
高频考点三 晶胞计算的综合应用
【例2】(2023·山东卷第16题)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)时,与冰反应生成利。常温常压下,为无色气休,固态的晶体类型为_____,水解反应的产物为_____(填化学式)。
(2)中心原子为,中心原子为,二者均为形结构,但中存在大键。中原子的轨道杂化方式_____;为键角_____键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因_____。
(3)一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为+2。上述反应化学方程式为_____。若阿伏加德罗常数的值为,化合物的密度_____(用含的代数式表示)。
【答案】(1)分子晶体 HF 、和
(2) > 分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)
【解析】
(1)常温常压下,为无色气体,则的沸点较低,因此,固态HOF的晶体类型为分子晶体。分子中F显-1价,其水解时结合电离的生成HF,则结合电离的,两者反应生成,不稳定,其分解生成,因此,水解反应的产物为HF 、和。
(2)中心原子为,中心原子为,二者均为V形结构,但中存在大键()。由中存在可以推断,其中原子只能提供1对电子,有一个原子提供1个电子,另一个原子提供1对电子,这5个电子处于互相平行的轨道中形成大键,提供孤电子对与其中一个形成配位键,与另一个形成的是普通的共价键(σ键,这个只提供了一个电子参与形成大键), 的价层电子对数为3,则原子的轨道杂化方式为;中心原子为,根据价层电子对的计算公式可知,因此,的杂化方式为;根据价层电子对互斥理论可知,时,价电子对的几何构型为正四面体,时,价电子对的几何构型平面正三角形,杂化的键角一定大于的,因此,虽然和均为形结构,但键角大于键角,孤电子对对成键电子对的排斥作用也改变不了这个结论。分子中键的键长小于中键的键长,其原因是:分子中既存在σ键,又存在大键,原子轨道重叠的程度较大,因此其中键的键长较小,而只存在普通的σ键。
(3)一定条件下,、和反应生成和化合物X。已知X属于四方晶系,其中Cu化合价为+2。由晶胞结构图可知,该晶胞中含有黑球的个数为、白球的个数为、灰色球的个数为,则X中含有3种元素,其个数比为1:2:4,由于其中Cu化合价为+2、的化合价为-1、K的化合价为+1,根据化合价代数和为0,可以推断X为,上述反应的化学方程式为。若阿伏加德罗富数的值为,晶胞的质量为,晶胞的体积为,化合物X的密度。
【变式探究】(2022·广东卷)硒()是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光()效应以来,在发光材料、生物医学等领域引起广泛关注。一种含的新型分子的合成路线如下:
(1)与S同族,基态硒原子价电子排布式为_______。
(2)的沸点低于,其原因是_______。
(3)关于I~III三种反应物,下列说法正确的有_______。
A.I中仅有σ键
B.I中的键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______。
(5)硒的两种含氧酸的酸性强弱为_______(填“>”或“”“
相关试卷
这是一份专题讲座(六)化学实验设计与探究(讲)- 2024年高考化学大一轮复习【专题讲座】,文件包含专题讲座六化学实验设计与探究讲-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座六化学实验设计与探究讲-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共59页, 欢迎下载使用。
这是一份专题讲座(三)“位-构-性”综合推断题的解题方法(练)- 2024年高考化学大一轮复习【专题讲座】,文件包含专题讲座三“位-构-性”综合推断题的解题方法练-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座三“位-构-性”综合推断题的解题方法练-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
这是一份专题讲座(二)阿伏加德罗常数的突破(讲)- 2024年高考化学大一轮复习【专题讲座】,文件包含专题讲座二阿伏加德罗常数的突破讲-2024年高考化学大一轮复习精讲精练+专题讲座原卷版docx、专题讲座二阿伏加德罗常数的突破讲-2024年高考化学大一轮复习精讲精练+专题讲座解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。









