






化学九年级下册课题2 酸和碱的中和反应教课课件ppt
展开1中和反应(1)概念:___________作用生成___________的反应。 (2)实质:中和反应的实质是酸中的_______和碱中的_________结合生成_______的过程。 (3)中和反应在实际中的应用①利用中和反应可以改变土壤的___________,如农业上常用___________来改良酸性土壤。 ②利用中和反应可以处理工厂的_________,如可用熟石灰中和硫酸厂的污水,其化学方程式为__________________________________。 ③中和反应常用于医药,如服用含氢氧化铝的药物可治疗胃酸过多,其化学方程式为________________________________。
Ca(OH)2+H2SO4===CaSO4+2H2O
Al(OH)3+3HCl===AlCl3+3H2O
2盐的概念盐是由________________________和_____________构成的化合物,在水溶液中能解离出________________________和_____________。 【易错提醒】中和反应会生成盐和水,但生成盐和水的反应,不一定是中和反应。如2NaOH+CO2===Na2CO3+H2O。
金属离子(或铵根离子)
知识点一 中和反应及其探究1硫酸铜是一种白色固体,易溶于水,溶液为蓝色且呈酸性,从物质分类看,它属于( )A.氧化物B.酸C.盐D.碱【解析】硫酸铜是由铜离子和硫酸根离子构成的化合物,属于盐。
2根据如图,判断以下说法错误的是( )A.取液后的滴管不能倒置B.用玻璃棒搅拌使反应充分C.该反应过程会释放热量D.溶液变成无色说明两者恰好完全反应【解析】取液后的滴管不能倒置,以防止药品腐蚀胶头,A正确。用玻璃棒搅拌使反应充分,B正确。氢氧化钠和盐酸反应生成氯化钠和水,放热,C正确。溶液变成无色说明两者恰好完全反应或稀盐酸过量,D不正确。
3下列反应中属于中和反应的是( )A.Mg(OH)2+2HCl===MgCl2+2H2OB.AgNO3+HCl===AgCl↓+HNO3C.Zn+2HCl===ZnCl2+H2↑D.2NaOH+SO3===Na2SO4+H2O【解析】中和反应指的是酸和碱反应生成盐和水的反应,B反应物中无碱,C反应物中无碱,D反应物中无酸,故只有A符合。
4有关中和反应的叙述错误的是( )A.一定有沉淀生成B.一定有水生成C.一定是酸和碱反应D.一定放热【解析】中和反应不一定生成沉淀,如氢氧化钠与盐酸之间发生的中和反应没有生成沉淀,A错误。中和反应一定生成水,B正确。中和反应一定是酸和碱反应,C正确。中和反应都放出热量,D正确。
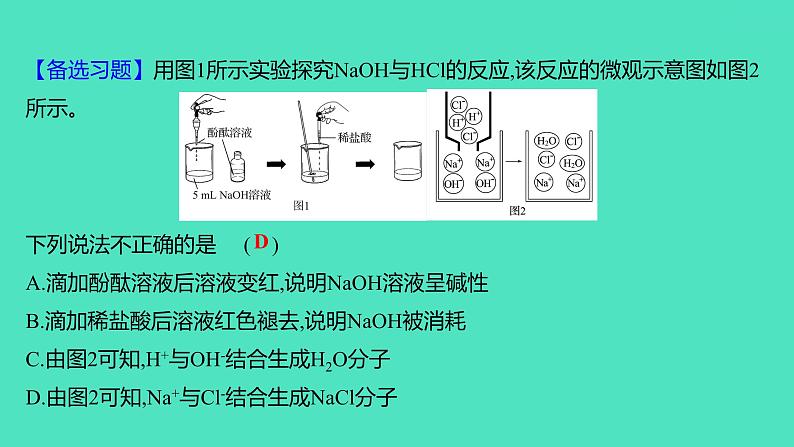
【备选习题】用图1所示实验探究NaOH与HCl的反应,该反应的微观示意图如图2所示。下列说法不正确的是( )A.滴加酚酞溶液后溶液变红,说明NaOH溶液呈碱性B.滴加稀盐酸后溶液红色褪去,说明NaOH被消耗C.由图2可知,H+与OH-结合生成H2O分子D.由图2可知,Na+与Cl-结合生成NaCl分子
【解析】无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红;滴加酚酞溶液后溶液变红,说明NaOH溶液呈碱性,A正确。滴加稀盐酸后溶液红色褪去,说明NaOH被消耗,B正确。由图2可知,反应的实质是H+与OH-结合生成H2O分子,C正确。由图2可知,Na+与Cl-没有发生改变,氯化钠是由钠离子和氯离子构成的,D错误。
5向盛有酚酞和NaOH溶液的烧杯中滴加稀硫酸,直至液体呈无色。为探究反应后溶液中溶质的组成,所选试剂不正确的是( )A.紫色石蕊试液B.锌粒C.大理石D.稀盐酸【解析】向盛有酚酞和NaOH溶液的烧杯中滴加稀硫酸,直至液体呈无色,溶液可能含有硫酸。紫色石蕊试液遇到稀硫酸会变红;锌粒和稀硫酸反应有气泡生成;大理石和稀硫酸反应有气泡生成;稀盐酸和稀硫酸不反应,因此无明显现象。
6向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中滴加稀硫酸时,观察到烧杯中的溶液由红色变为无色。(1)请写出有关反应的化学方程式:__________________________________。 (2)烧杯中无色溶液的溶质可能只有Na2SO4,也可能还有H2SO4。要确定该溶质的成分,请写出一种可选用的试剂:____________________________________________。 【解析】(1)稀硫酸和氢氧化钠反应生成硫酸钠和水。(2)酚酞溶液在酸性和中性条件下呈无色,所以烧杯中溶液变为无色时,溶液中的溶质可能只有Na2SO4,也可能是H2SO4和Na2SO4,要检验是否含有稀硫酸,可加入紫色石蕊试液,看是否变为红色;或加入能与稀硫酸反应产生明显现象的物质,如Zn、CuO等。
H2SO4+2NaOH===Na2SO4+2H2O
紫色石蕊试液(或Zn、Mg、CuO、Fe2O3
7如图是小明同学在实验室进行的酸碱中和反应的实验探究,回答下列问题。(1)写出该反应的化学方程式为____________________________。 (2)A2试管中的盐酸是否有剩余?请结合小明的实验说明理由:_______________________________________________________________________________________________________________________________。
HCl+NaOH===NaCl+H2O
溶液显无色,加入氢氧化钠溶液后,溶液仍显无色,说明加入的氢氧化钠溶液与稀
盐酸发生了反应,则A2试管中的盐酸有剩余
【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水。(2)滴有酚酞的氢氧化钠溶液显红色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,A2试管中溶液显无色,说明溶液显酸性或中性,加入氢氧化钠溶液,溶液仍显无色,说明加入的氢氧化钠溶液与稀盐酸发生了反应,则A2试管中的盐酸有剩余。
8向NaOH溶液中滴入HCl溶液至恰好完全反应。(1)如图表示该反应前后溶液中存在的主要离子,在下面横线上写出每种图形表示的离子(填离子符号)。(2)下列物质中只有一种能与KOH溶液发生上述类似反应,应是_______(填序号)。 ①HNO3 ②CuSO4 ③CaCl2
【解析】(1)向NaOH溶液中滴入HCl溶液至恰好完全反应,氢氧化钠是由钠离子和氢氧根离子构成的,盐酸是由氢离子和氯离子构成的,反应的实质是氢离子结合氢氧根离子生成水分子,故横线上图形表示的离子从左到右分别是氢氧根离子(OH-)、钠离子(Na+)。(2)氢氧化钠与稀盐酸反应生成氯化钠和水,属于中和反应,硝酸属于酸,能与氢氧化钾发生中和反应。
知识点二 中和反应的应用9辣椒中含有辣椒碱,易使切辣椒的手产生火辣痛感,为缓解疼痛可在皮肤上涂抹的物质是( )A.牙膏B.肥皂水C.食醋D.食盐水【解析】辣椒中含有辣椒碱,显碱性,应涂抹显酸性的物质,四种物质中只有食醋显酸性。
10如图是一种医用药品瓶上的标签,试根据标签上的内容回答有关问题。(1)请叙述嚼碎后咽下的好处(答出一点即可):_____________________________________________________________________________________。 (2)服用该药片后,在胃中可能发生的化学反应为(用化学方程式表示):__________________________________。 【解析】嚼碎后药物与胃酸的接触面积增大,反应速度加快;氢氧化铝与盐酸反应生成氯化铝与水。
[适应症]抗溃疡药,适用于胃溃疡[主要成分]每片含有氢氧化铝250 mg[注意事项]嚼碎后吞服
嚼碎后服用疗效快(或嚼碎后药物
与胃酸的反应快;或反应物的接触面积增大,化学反应加快)
2Al(OH)3+6HCl===2AlCl3+6H2O
11中和反应在日常生活和工农业生产中有广泛的应用。下列关于中和反应的说法正确的是( )A.核心概念:生成盐和水的反应都属于中和反应B.微观实质:中和反应的实质是氢分子和氧分子反应生成水分子C.反应现象:中和反应都能观察到溶液颜色发生改变D.实际应用:氢氧化镁用于治疗胃酸过多症是利用中和反应原理
【解析】生成盐和水的反应不一定属于中和反应,如二氧化碳和氢氧化钠反应生成碳酸钠和水,不属于中和反应,A错误;中和反应的实质是氢离子和氢氧根离子结合生成水分子,B错误;中和反应不一定能观察到溶液颜色发生改变,如氢氧化钠与硫酸反应生成硫酸钠和水,不存在溶液颜色的改变,C错误;氢氧化镁能与胃液中的盐酸反应生成氯化镁和水,所以氢氧化镁用于治疗胃酸过多症是利用中和反应原理,D正确。
12物质X可发生下列所示的两个反应,则X可能是( )①X+碱→盐+H2O②X+金属氧化物→盐+H2OA.CaO (OH)2 D.HCl【解析】A.氧化钙与碱、金属氧化物均不反应,错误;B.二氧化碳能与碱反应生成盐和水,但不能与金属氧化物反应,错误。C.氢氧化钙不与碱反应,错误;D.盐酸能与碱发生中和反应生成盐和水,能与金属氧化物反应生成盐和水,X可能是盐酸,正确。
13下列各组物质间的反应,需要借助酸碱指示剂才能判断出反应发生的是( )A.锌与稀盐酸B.氢氧化钠稀溶液与稀硫酸C.氧化铜与稀硫酸D.澄清的石灰水和二氧化碳气体【解析】A.锌和稀盐酸反应生成氢气,有气泡冒出;B.氢氧化钠和稀硫酸反应没有明显现象,所以必须借助酸碱指示剂;C.氧化铜为黑色固体,可以和稀硫酸反应生成硫酸铜,而硫酸铜为蓝色溶液;D.澄清的石灰水和二氧化碳气体反应生成碳酸钙沉淀和水,会观察到澄清的石灰水变浑浊。
14实验课上,老师演示了如图所示的实验。向烧杯中缓缓滴加稀硫酸,观察到小灯泡的亮度变化情况为亮→暗→熄→亮。下列说法中正确的是( )A.将Ba(OH)2溶液换成NaOH溶液,小灯泡会一直亮B.当观察到灯泡熄灭时,此时烧杯中的溶液不存在粒子C.灯泡亮度发生变化只因为溶液中的H+、OH-的浓度改变D.将稀硫酸换成稀盐酸,小灯泡也会出现亮→暗→熄→亮
【解析】将氢氧化钡溶液换成氢氧化钠溶液,稀硫酸和氢氧化钠反应生成硫酸钠和水,小灯泡会一直发亮,A正确。氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,当观察到灯泡熄灭时,此时烧杯中的溶液存在水分子等粒子,B错误。灯泡发亮是因为溶液中存在能自由移动的离子,灯泡亮度发生变化不只是因为溶液中的H+、OH-的浓度改变,还因为钡离子和硫酸根离子的浓度发生了变化,C错误。将稀硫酸换成稀盐酸,氢氧化钡和盐酸反应生成氯化钡和水,溶液中始终存在能自由移动的离子,小灯泡始终是发亮的,小灯泡不会出现亮→暗→熄→亮,D错误。
1540 g溶质质量分数为2%的氢氧化钠溶液和40 g溶质质量分数为2%的稀盐酸混合,向所得溶液中滴加少量紫色石蕊试液,试液显示的颜色是( )A.红色B.紫色C.蓝色D.不确定【解析】40 g溶质质量分数为2%的氢氧化钠溶液和40 g溶质质量分数为2%的稀盐酸中所含溶质的质量相等。反应中消耗氯化氢与氢氧化钠的质量比关系如下:HCl+NaOH===NaCl+H2O36.540可知,36.5份质量的氯化氢与40份质量的氢氧化钠恰好完全反应,则40 g溶质质量分数为2%的氢氧化钠溶液和40 g溶质质量分数为2%的稀盐酸混合,稀盐酸有剩余,溶液显酸性,最终混合后的液体呈红色。
16(2023·贵港一模)向一定量的氢氧化钠溶液中逐滴加入稀硫酸。溶液中氢氧化钠的质量、水的质量、硫酸钠的质量随稀硫酸的质量的变化关系如图所示。下列说法不正确的是( )A.乙代表水的质量,丙代表硫酸钠的质量B.加入N g稀硫酸时,两者恰好完全反应C.a点对应的溶液中含有三种溶质D.b点对应的溶液中含有的阳离子只有H+、Na+
【解析】氢氧化钠和稀硫酸反应生成硫酸钠和水,开始溶液中没有硫酸钠,随着反应的发生生成硫酸钠,反应完全后质量不变,丙代表硫酸钠的质量;氢氧化钠被慢慢消耗,直至消耗完毕,甲代表氢氧化钠的质量,乙代表水的质量。氢氧化钠溶液中有水,加入的稀硫酸中有水,同时反应过程生成水,所以开始有一定质量的水,反应过程中水的质量逐渐增大,反应完全后水增加的质量只来自稀硫酸,所以加入N g稀硫酸后水增加速度减缓,表示二者已经反应完全。根据分析,乙代表水的质量,丙代表硫酸钠的质量,A正确;根据分析,加入N g稀硫酸时,两者恰好完全反应,B正确;根据分析,加入N g稀硫酸时,两者恰好完全反应,a点时加入的稀硫酸只反应掉一部分氢氧化钠,所以溶质有未反应完全的氢氧化钠、生成物硫酸钠,共两种溶质,C错误;根据分析,加入N g稀硫酸时,两者恰好完全反应,b点时氢氧化钠已经反应完全,加入的稀硫酸过量,所以溶液中的溶质是生成物硫酸钠和过量的稀硫酸,则阳离子只有Na+和H+,D正确。
17(2023·崇左一模节选)《天工开物》中记载“石灰淹苗足”,利用了中和反应的原理,如果土壤呈酸性是因为有硝酸,写出氢氧化钙与其反应的化学方程式:_____________________________________。 下列应用原理与其不同的是______(填字母)。 A.服用含Al(OH)3的药物治疗胃酸过多B.用熟石灰处理硫酸厂的酸性废水C.用稀盐酸除去钢铁表面的铁锈D.用稀氨水处理蚊虫叮咬处(含蚁酸)
Ca(OH)2+2HNO3===Ca(NO3)2+2H2O
【解析】氢氧化钙和硝酸反应生成硝酸钙和水,该反应的化学方程式为Ca(OH)2+2HNO3===Ca(NO3)2+2H2O。A、氢氧化铝和盐酸反应生成氯化铝和水,利用的是中和反应原理;B、熟石灰是氢氧化钙的俗称,氢氧化钙和硫酸反应生成硫酸钙和水,利用的是中和反应原理;C、铁锈的主要成分是氧化铁,氧化铁和稀盐酸反应生成氯化铁和水,不属于中和反应;D、氨水(NH3·H2O)是常见的碱,蚁酸属于酸,氨水和蚁酸反应属于中和反应。
【自我挑战】18(2023·南宁二模)观察下列三幅微观结构示意图,并按要求填空:
(1)图1和图2分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图。请你结合已有的酸、碱知识,判断溴化氢的水溶液显_________(填“酸性”“中性”或“碱性”)。 (2)乙醇的水溶液是否导电:_______(填“是”或“否”)。 (3)图3代表氢氧化钠和盐酸反应的微观过程,反应的微观本质是______________________________________。 类比图3的反应实质写出溴化氢的水溶液和氢氧化钠反应的化学方程式:____________________________。
氢氧根离子结合生成水分子
NaOH+HBr===NaBr+H2O
初中化学课题2 酸和碱的中和反应评优课ppt课件: 这是一份初中化学课题2 酸和碱的中和反应评优课ppt课件,文件包含第1课时中和反应课件pptx、第1课时中和反应导学案doc、第1课时中和反应教案doc、中和反应酚酞溶液mp4、中和反应实质H+OH-swf等5份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
人教版九年级下册课题2 酸和碱的中和反应习题ppt课件: 这是一份人教版九年级下册课题2 酸和碱的中和反应习题ppt课件,共22页。PPT课件主要包含了是否恰好完全反应,红色刚刚褪去,熟石灰,中和反应,氯化钠,HCl,OH-,H2O,Na2SO4等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 酸和碱的中和反应教学ppt课件: 这是一份初中化学人教版九年级下册课题2 酸和碱的中和反应教学ppt课件,文件包含人教版九年级化学下册第十单元课题2酸和碱的中和反应第1课时中和反应课件pptx、人教版九年级化学下册第十单元课题2酸和碱的中和反应第1课时中和反应教案docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。













