
河北新乐市第一中学2024届高三上学期开学测试化学试卷(含答案)
展开
这是一份河北新乐市第一中学2024届高三上学期开学测试化学试卷(含答案),共15页。试卷主要包含了单选题,实验题,填空题等内容,欢迎下载使用。
一、单选题
1.化学与生产、生活、科技、环境等关系密切。下列说法正确的是( )
A.汽车尾气催化转化器可有效减少的排放,实现“碳中和”
B.制造焊锡时,把铅加入锡,形成原电池,从而增加锡的抗腐蚀能力
C.2022年冬奥会衣物采用石墨烯纺织物柔性发热材料,石墨烯属于混合型晶体
D.聚氯乙烯塑料通过加聚反应制得,可用于制作不粘锅的耐热涂层
2.下列说法正确的是( )
A.Al的核外电子有7种运动状态
B.酸性强弱:三氟乙酸>乙酸>甲酸
C.水汽化和水分解都破坏了共价键
D.表示第二能层沿x轴方向的p轨道
3.有八种物质:①甲烷、②甲苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯、⑧聚氯乙烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
A.③④⑤⑧B.④⑤⑦C.④⑤D.③④⑤⑦⑧
4.五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
下列说法不正确的是( )
A.Z中含氧官能团有三种:羟基、羧基、酯基
B.Y在浓硫酸作催化剂加热条件下发生消去反应
C.Z在酸性条件下水解生成两种有机物,1ml Z最多能与8ml NaOH 发生反应
D.可以用溶液检验X是否完全转化为Y
5.被称为万能还原剂(其中H为-1价),能溶于水且与水发生反应:,关于该反应的说法正确的是( )
A.既是氧化剂又是还原剂
B.是氧化剂,是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比1:1
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在新制饱和氯水中:、、、
B.在能使酚酞变红的溶液中:、、、
C.在加入铝粉能产生的溶液中:、、、
D.在水电离出的的溶液中:、、、
7.下列相应反应的离子方程式正确的是( )
A.向NaClO溶液中滴加少量溶液:
B.常温下铜与浓硝酸反应:
C.将四氧化三铁投入到稀硝酸中:
D.氢氧化铁溶于氢碘酸中:
8.下列有关共价键和键参数的说法不正确的是( )
A.1个乙烯()分子中含有5个键和1个键
B.C—H键比Si—H键的键长更短,故比更稳定
C.、、三种分子的键角依次增大
D.N与3个H结合形成分子,体现了共价键的饱和性
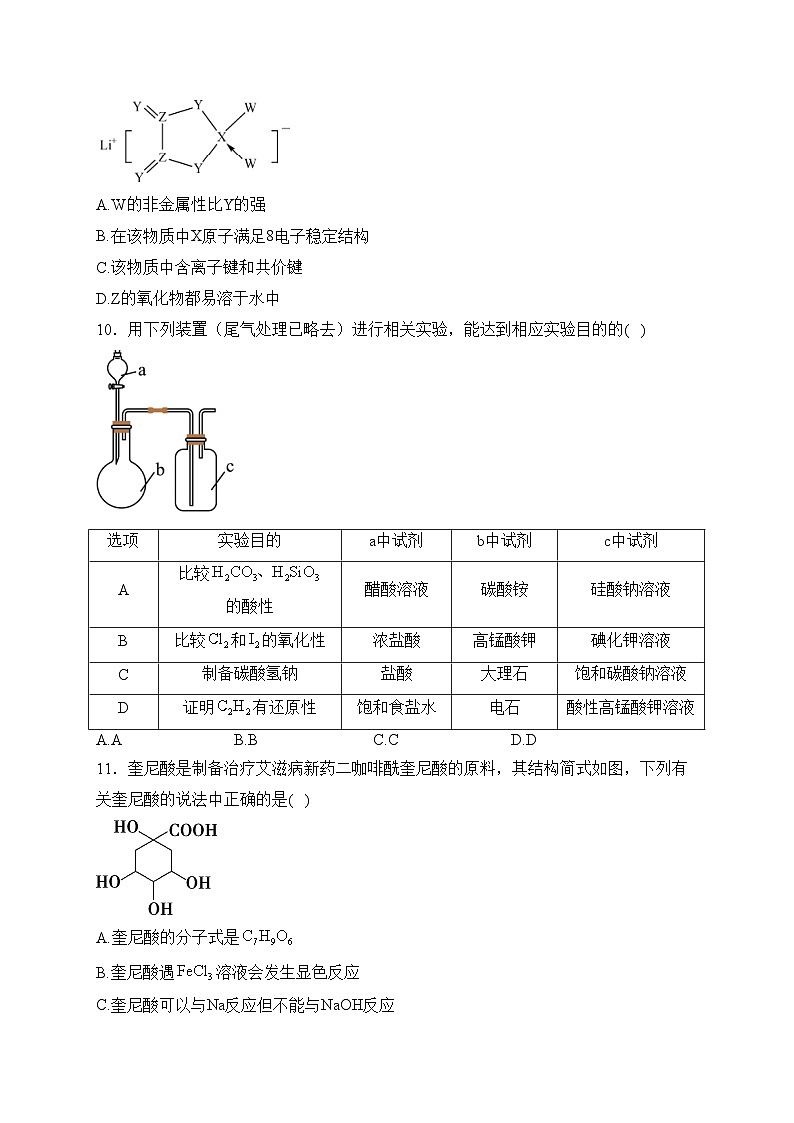
9.W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
A.W的非金属性比Y的强
B.在该物质中X原子满足8电子稳定结构
C.该物质中含离子键和共价键
D.Z的氧化物都易溶于水中
10.用下列装置(尾气处理已略去)进行相关实验,能达到相应实验目的的( )
A.AB.BC.CD.D
11.奎尼酸是制备治疗艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
A.奎尼酸的分子式是
B.奎尼酸遇溶液会发生显色反应
C.奎尼酸可以与Na反应但不能与NaOH反应
D.奎尼酸能发生氧化反应和取代反应
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含的溶液为例)。下列说法错误的是( )
A.负极反应为
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 ml电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
13.高铁酸钾是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述错误的是( )
A.用溶液吸收反应Ⅰ中尾气后的产物可在反应Ⅱ中再利用
B.反应Ⅱ中氧化剂与还原剂的物质的量之比为2∶3
C.操作1和操作2中都要用到漏斗、玻璃棒
D.对饮用水有杀菌消毒和净化的作用
14.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的气体和672 mL的气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为17.02 g。则x等于( )
15.下列说法正确的是( )
A.p轨道电子能量一定高于s轨道电子能量
B.每个能层(K、L、M……)上所有轨道数对应为1、3、5……
C.在氢原子基态电子的概率分布图中,小黑点的疏密程度表示电子在该区空间出现机会的大小
D.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
16.光气()是一种重要的有机中间体。反应可用于制备光气。下列有关叙述错误的是( )
A.氧原子的结构示意图为
B.的电子式为
C.为极性分子
D.中碳原子的轨道杂化类型为杂化
17.下列各组物质性质的比较,结论正确的是( )
A.在水中的溶解度:
B.沸点:>
C.分子的极性:
D.溶液酸性:
18.三硫化磷()是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为,下列有关的说法中不正确的是( )
A.中磷元素为+3价
B.属于共价化合物
C.充分燃烧的化学方程式为
D.1ml分子中含有9ml共价键
19.钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的结构如图(b)所示,晶胞边长为a cm,其中A为,另两种离子为和。b的分子量为620,下列说法正确的是( )
A.钛酸钙晶体中距离最近的有6个
B.图(b)中,X为
C.图(b)该晶体密度为
D.钛酸钙晶胞中距离最近的形成了正八面体,位于其中心
20.下列关于杂化轨道的叙述中,不正确的是
A.C分子中所有碳原子均采取杂化成键
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
C.和分子中的中心原子S和C是通过杂化轨道成键
D.中心原子通过杂化轨道成键时,该分子一定为四面体结构
二、实验题
21.二氧化氯()和臭氧()均具有强氧化性,可用于水处理。是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以作还原剂,在硫酸介质中还原制备,同时得到,该反应的化学方程式为________。
(2)以过氧化氢作还原剂,在硫酸介质中还原制备,并将制得的处理含废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
①反应容器B应置于30℃左右的水浴中,目的是________。
②通入氮气的目的除了有利于将排出,还有________。
③处理含废水的离子方程式为________。
装置D的作用是________。
三、填空题
22.某硫与锌元素组成的化合物M不溶于水、易溶于酸,见阳光色变暗。若在该化合物中加入微量的Cu、Mn、Ag做活化剂,经光照后,能发出不同颜色的荧光。回答下列问题:
(1)基态铜原子的价电子排布图为_____。第一电离能介于Si、P之间的第三周期元素为_____(填元素符号)。
(2)SO2中S的杂化类型为_____,该分子的空间构型为_____。
(3)1ml中含有σ键的数目为_____,分子在独立存在时H-N-H键角为107°,中H-N-H键角变大的原因:________。
(4)M的晶胞结构如图。
①观察图形推测,该晶体中每个周围距离相等且最近的数目为___个,M的化学式__。
②Zn的第三电离能大于Cu的第三电离能的原因是_____。
23.化合物H是一种合成精神类药物盐酸舍曲林的中间体,其合成路线如下:
已知:①ArH++(Ar指芳香化合物)
②
(1)B的化学名称为________,B→C的反应类型是________,C中含氧官能团的名称为________。
(2)D→E反应的化学方程式为________。
(3)G的结构简式为________。
(4)符合下列条件的的同分异构体结构简式(包括顺反异构)有________种。
①能与溶液反应产生气体
②可以发生银镜反应
参考答案
1.答案:C
解析:A.汽车尾气催化转化器将一氧化碳和一氧化氮转化为二氧化碳和氮气,不能减少的排放,不能实现“碳中和”,故A错误;B.锡比铅活泼,两者形成原电池,锡作负极,加速锡的腐蚀,故B错误;C.石墨烯可导电,具有金属晶体的性质,石墨烯内原子间形成共价键,具有共价晶体的性质,石墨烯属于混合型晶体,故C正确;D.聚氯乙烯塑料中加入增塑剂会释放有毒物质,不可用于制作不粘锅的耐热涂层,故D错误;故选:C。
2.答案:D
解析:A.每个电子有一种运动状态,Al原子有13个电子,所以Al的核外电子有13种运动状态,故A错误;B.卤素原子是吸电子基团,烃基是推电子基团,乙酸分子-属于斥电子基团,能减弱-OH上H原子的活性而使该物质的酸性减弱,则甲酸酸性比乙酸强,故B错误;C.水为分子晶体,汽化时克服分子间作用力,水分解破坏了共价键,故C错误;D.p能级有3个轨道,沿x、y、z三个不同的方向延伸,2p为第二能层的p轨道,所以表示第二能层沿x轴方向的p轨道,故D正确;故选:D。
3.答案:B
解析:①甲烷、③聚乙烯、⑥环己烷、⑧聚氯乙烯分子中均为单键,不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色;②甲苯与酸性高锰酸钾溶液反应使其褪色,可以因为萃取而使溴水褪色,但不是因为反应,②不符合题意;④聚异戊二烯中含有碳碳双键,⑤2-丁炔含有碳碳三键,⑦环己烯含有碳碳双键,都能使酸性高锰酸钾溶液褪色,也使溴水因反应而褪色;
综上④⑤⑦,符合题意,故选B。
4.答案:C
解析:A.Z中含氧官能团有三种:羟基、羧基、酯基,故A正确;
B.Y中连接羟基的邻位碳上有H原子,在浓硫酸做催化剂加热条件下可发生消去反应,故B正确;
C.Z在酸性条件下酯基发生水解反应生成有机物为 、 ,它们是同一物质,Z中酚羟基、羧基、酯基水解生成的-COOH和酚-OH都能和NaOH以1:1反应,Z中含有5个酚羟基、1个羧基、1个酯基水解生成1个羧基和1个酚羟基,所以1mlZ最多能和8mlNaOH反应,故C错误;
D.酚羟基与溶液发生显色反应,由于Y不含有酚羟基,加入溶液后若没有紫色,说明X完全转化了,若有紫色说明未完全转化,能根据溶液颜色确定X未完全转化,故D正确;
故选:C。
5.答案:D
解析:反应中是还原剂,是氧化剂;硼元素化合价未发生变化,氢元素既被氧化又被还原,被氧化的氢原子与被还原的氢原子个数分别为4、4,其质量之比为1:1。
6.答案:B
解析:
7.答案:D
解析:D.具有强氧化性,自能将氧化成,因此离子方程式为,故D正确。
8.答案:C
解析:
9.答案:D
解析:由上述分析可知,W为F、X为B、Y为O、Z为C,A.同周期从左向右非金属性增强,W的非金属性比Y的强,故A正确;B.X形成3个共价键和1个配位键,X原子满足8电子稳定结构,故B正确;C.阴阳离子形成离子键,非金属元素之间形成共价键,故C正确;D.Z的氧化物为CO时,不溶于水,故D错误;故选:D。
10.答案:B
解析:A.醋酸易挥发,应除去再与硅酸钠反应,故A错误;B.浓盐酸与高锰酸钾反应生成氯气,氯气能置换碘化钾中的碘单质,可比较氧化性,故B正确;C.盐酸易挥发,氯化氢能与碳酸钠反应生成氯化钠,引入杂质,故C错误;D.电石不纯,与水反应生成乙炔的同时也生成硫化氢、磷化氢等,都可与高锰酸钾溶液反应,应先除杂,故D错误。故选:B。
11.答案:D
解析:
12.答案:B
解析:A项,结合题给微生物脱盐电池装置可知,a极的电极反应式为,故a极为负极,b极为正极,正确。B项,a极区有产生,阳离子增多,为保证溶液呈电中性,需定向迁移到a极区,隔膜1为阴离子交换膜;同理,b极的电极反应式为,需定向迁移到b极区,隔膜2为阳离子交换膜,错误。C项,当电路中转移1 ml电子时,有和发生定向迁移,故理论上除盐58.5 g,正确。D项,结合电极反应式,得,故电池工作一段时间后,正、负极产生的气体的物质的量之比为2:1,正确。
13.答案:B
解析:用溶液吸收氯气后得到氯化铁,可在反应Ⅱ中再利用,故A正确;反应2中氧化剂是次氯酸钠,还原剂是氯化铁,根据得失电子相等,氧化剂与还原剂物质的量之比是3:2,故B错误;操作1和操作2都是过滤操作,故C正确;具有强氧化性,具有消毒杀菌的作用,还原产物水解得到氢氧化铁胶体,吸附杂质净化水,故D正确。
14.答案:C
解析:8.960 L的气体的物质的量为,0.672 L的气体的物质的量为,所以金属提供的电子的物质的量为,所以沉淀中含有氢氧根的物质的量为0.46 ml,氢氧根的质量为,所以金属的质量为,故选C。
15.答案:C
解析:A.在基态多电子原子中,p轨道电子能量可能高于s轨道电子能量,如3p电子能量高于1s电子能量,也可能低于s轨道电子能量,如2p电子能量低于4s电子能量,故A错误;B.每个能层上所包含的轨道数等于该层个能级的轨道数之和,而能级上的轨道有1、3、个,相加为,故B错误;C.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现机会的多少,即概率的大小,不表示电子,密的地方出现机会多、疏的地方出现机会少,故C正确;D.在多电子的原子中,电子填充在不同的能层,能层又分不同的能级,同一能级又有不同的原子轨道,每个轨道中最多可以填充两个电子,自旋相反,在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子,故D错误;故选C。
16.答案:A
解析:A.氧原子的结构示意图为,故A错误。
17.答案:B
解析:B.形成分子间氢键,形成分子内氢键,所以沸点,故B正确。
18.答案:A
解析:A.由图可知P与S形成3个共价键,S形成2个共价键,则中S为-2价,磷元素分别为+3价、+1价,故A错误。
19.答案:D
解析:
A.钙离子位于晶胞的顶点,钛离子位于晶胞的中心,故每个顶点为八个晶胞共用,所以晶体中距离钙离子最近的钛离子有8个,A错误;
B.图(b)中,X的个数为,根据A为,另两种离子为和分析,X为碘离子,B错误;
C.该晶体中表示的化学式为,该晶体的密度为,C错误;
D.从图分析,钛酸钙晶胞中位于中心,氧离子位于晶胞的面心,故距离最近的形成了正八面体,位于其中心,D正确;
故选D。
20.答案:D
解析:D.分子的中心原子通过杂化轨道成键时,杂化轨道的空间构型一定为正四面体结构,但分子的空间构型不一定为正四面体结构,如分别为三角锥形和V形,N和O原子均为杂化,故D错误故选:D。
21.答案:(1)
(2)提高化学反应速率,同时防止受热分解;稀释,防止其发生爆炸;;吸收等气体,防止污染大气
解析:(1)中+2价铁元素被氧化为,-1价硫元素被氧化为,中+5价氯元素被还原为+4价。根据化合价升降守恒和元素守恒配平,其化学方程式;
(2)①反应容器B应置于30℃左右的水浴中,目的是提高化学反应速率,同时防止受热分解;②氮气很稳定,通入氮气从溶液中赶出,氮气稀释了气体,防止浓度过高发生爆炸;③具有较强氧化性,被还原为具有较强还原性,+2价碳元素被氧化为,-3价氨元素被氧化为,由此写离子方程式为:;装置D吸收尾气中的等污染大气的气体。
22.答案:(1);S
(2);V形
(3)9;分子中N原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的作用变为成键电子对间的排斥,排斥作用减弱
(4)12;ZnS;的3d能级全排满
解析:(1)Cu是29号元素,基态铜原子的价电子排布式为,排布图为。
(2)中S价层电子对数为2+=3,杂化类型为,且含有1个孤电子对,该分子的空间构型为V形。
(3)在1ml中,与间为离子键,Ag与之间为配位键,含有2mlσ键,2ml内部含有6mlσ键,内部O、H间为σ键,共9mlσ键,数目为9。
(4)①取右上角的顶点(),与它距离最近的位于面心,则ZnS晶体中离锌离子最近且距离相等的锌离子个数为×8=12;在晶胞M中,含有个数为8×+6×=4,含个数为4,所以化学式为ZnS;
②锌为30号元素,基态的电子排布式:,3d能级全排满,所以Zn的第三电离能大于Cu的第三电离能。
23.答案:(1)邻二氯苯;取代反应;羰基(或酮羰基)、羧基
(2)
(3)
(4)3;的不饱和度为3;能与碳酸氢钠溶液反应放出气体,有羧基;可以发生银镜反应,有醛基;剩余的不饱和度为碳碳双键,、、
解析:
选项
实验目的
a中试剂
b中试剂
c中试剂
A
比较的酸性
醋酸溶液
碳酸铵
硅酸钠溶液
B
比较和的氧化性
浓盐酸
高锰酸钾
碘化钾溶液
C
制备碳酸氢钠
盐酸
大理石
饱和碳酸钠溶液
D
证明有还原性
饱和食盐水
电石
酸性高锰酸钾溶液
相关试卷
这是一份河北新乐市第一中学2022-2023学年高二下学期3月月考化学试卷(含答案),共19页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份河北省邯郸市2023届高三上学期开学摸底考试化学试卷(含答案),共16页。试卷主要包含了单选题,多选题,实验题,填空题等内容,欢迎下载使用。
这是一份河北省新乐市重点中学2023-2024学年高三上学期第一次月考化学试题(Word版含答案),文件包含化学试题docx、参考答案docx等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。









