






所属成套资源:2024年广东省中考化学一轮知识点梳理复习
2024年广东省中考化学一轮知识点梳理复习课时30---以化工流程为基础的综合能力题课件PPT
展开
这是一份2024年广东省中考化学一轮知识点梳理复习课时30---以化工流程为基础的综合能力题课件PPT,共60页。PPT课件主要包含了题型分析及解题指导,典例赏析,反应更充分,HCl,O2↑,玻璃棒,纯碱或苏打,CO2,浓硫酸,氧化铝或水等内容,欢迎下载使用。
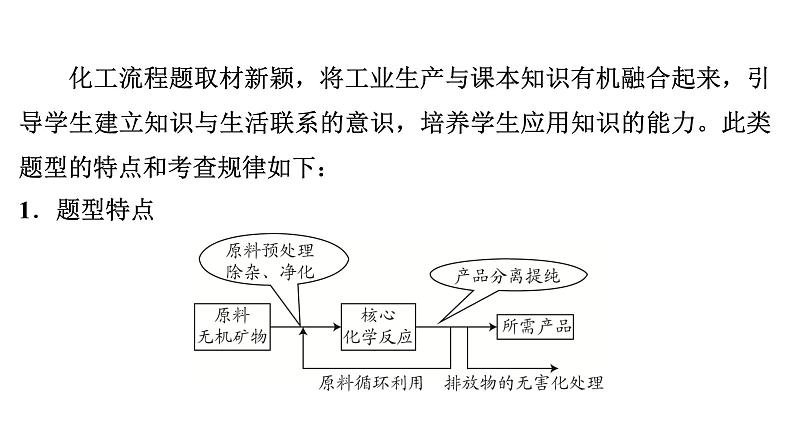
化工流程题取材新颖,将工业生产与课本知识有机融合起来,引导学生建立知识与生活联系的意识,培养学生应用知识的能力。此类题型的特点和考查规律如下:1.题型特点
2.考查规律生产过程中涉及的物质一般是初中化学常见物质(以酸、碱、盐、金属、氧化物为主),主要考查它们的转化关系和分离方法。若是陌生反应,题中必有信息提示。考查点主要有:(1)原料到产品的生产原理。①粉碎(研磨):增大反应物的接触面积,加快反应速率,使反应更充分。②灼烧(煅烧):使固体在高温下分解或使杂质在高温下氧化、分解等。③搅拌:使反应物充分接触,加快反应速率。
(2)除杂试剂的选择及除杂原理。(书写化学式、化学方程式,判断基本反应类型或除杂目的)(3)分离操作。(书写操作名称、仪器名称)①过滤。适合于固体和液体分离。②结晶。区分蒸发结晶和降温结晶。先进行加热浓缩的目的是将溶液变成热的饱和溶液,然后降温,这样可以提高结晶率。蒸发浓缩→降温结晶。
(4)判断可回收利用或循环利用的物质。①回收利用:除主产物以外的副产物。②循环利用:某一步的产物可作为前面某一步的反应物。(5)陌生化学方程式的书写。①找反应物与生成物:箭头进入的是反应物,出去的是生成物。②查漏补缺:若无法配平,需考虑溶液中的水或空气中的成分是否参与反应。(6)对生产工艺的评价。(是否环保、低能耗;原料利用率高还是低等)
3.解题方法答题时要充分挖掘题干信息,结合物质的性质及转化关系,综合应用物质分离提纯等知识做出合理分析和判断。常见解题步骤为①审题,弄清流程目的,在流程中圈出原料和产品;②结合流程思考原料是如何提纯、如何转变为产品,理顺流程。必要时可在流程中写出关键反应的化学方程式,分析中间产物的成分;③规范解答题尾的相关问题。
类型1 物质的制备 某铝业集团利用铝土矿(主要成分为Al2O3,杂质不溶于水也不参与反应)冶炼金属铝的流程如图所示:已知:①一水合氨(NH3·H2O)为弱碱,可沉淀溶液中的Cu2+、Zn2+、Al3+等离子。②Al(OH)3遇NaOH会发生反应生成NaAlO2。
(1)将矿石粉碎的目的是__________________________________________________。(2)操作Ⅰ、Ⅱ的名称是______。(3)滤液A中的溶质是____________(填化学式)。(4)补充该流程核心反应的化学方程式:2Al2O3 4Al+_______。(5)此工艺流程中不能用“过量NaOH溶液”代替“过量氨水”的原因是_______________________________________________________。
增大反应物的接触面积,加快反应速率,使
过量的NaOH会与Al(OH)3反应生成NaAlO2,得不到Al(OH)3
(2022·广东模拟)我国科学家侯德榜创立了联合制碱法生产纯碱。某海边工厂利用贝壳等生产纯碱的主要工艺流程如下:(1)反应①属于______反应(填基本反应类型);反应②的化学方程式为____________________________________。
(2)操作a的名称是______,该操作用到的玻璃仪器有烧杯、漏斗和________。(3)下列做法能减少二氧化碳排放的是____(多选,填字母)。a.焚烧秸秆b.发展太阳能c.大力使用清洁能源(4)CO2与氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为____________________________。
(5)先进的联合制碱法使原料NaCl的利用率从70%提高到96%。①“侯氏制碱法”所制得“碱”(碳酸钠)的俗称:______________(填一种)。②“制碱”过程中,先向饱和食盐水中通入氨气,制成饱和氨盐水,其目的是使溶液呈______(填“酸性”“中性”或“碱性”)。
(2020·深圳)下列流程可用于制备硫酸铵。Ⅰ.制硫酸:(1)反应①的化学方程式为________________。(2)反应②为SO3+H2O===H2SO4,该反应属于______反应(填基本反应类型)。
Ⅱ.合成氨:(3)“原料气”中N2的制备:N2约占空气体积的五分之____,可通过分离液态空气的方法得到。(4)“原料气”中H2的制备:高温时,CH4和水蒸气在催化剂作用下反应得到H2和CO2,该反应的化学方程式为____________________________。(5)NH3溶于水时形成氨水。室温下,氨水的pH____7(填“>”或“<”)。
Ⅲ.制备硫酸铵:(6)将NH3通入稀释后的硫酸溶液中,得到硫酸铵。用水稀释浓硫酸时,需将________缓慢地加入____中。(7)(NH4)2SO4在农业生产中常被用作____(填标号)。A.氮肥 B.磷肥 C.钾肥
类型2 物质的分离提纯 (2022·广东模拟)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如图。(1)“酸浸”中使用的酸是____(填字母序号)。A.HCl B.H2SO4 C.Na2SO4
(2)写出“酸浸”的化学方程式:________________________________。(3)流程中涉及的氧化物有______________(写出1种即可)。(4)过滤过程中需要用到的玻璃仪器有____________________。(5)“煅烧”过程发生反应的化学方程式为________________________________。(6)该工艺的价值在于____________。
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(2023·广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如下:(1)“除杂1”应依次加入的两种试剂是_________________________、__________________,“除杂2”应加入的试剂是_______。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
氢氧化钙[或Ca(OH)2]
碳酸钠(或Na2CO3)
(2)将“溶液A”在80 ℃蒸发浓缩,至有少量固体析出。①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释:____________________________________________________。②该小组停止蒸发浓缩,经__________、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是____________________________________________________。
溶液中硫酸钠的含量比氯化钠高,
加热蒸发溶剂至有较多晶
体析出,趁热过滤,洗涤,干燥
(3)设计由硫黄(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式:_______________________________________________________________________。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
+O2===2Na2SO4
常用回收废品中的粗铜提炼金属铜、铁和铝,其部分流程如图所示。
【查阅资料】①溶液中Fe2+易被O2氧化为Fe3+;②常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示。
(1)操作1的名称是______,金属A的化学式是_____。(2)写出粗铜加入过量稀硫酸发生反应的化学方程式:___________________________________________________________(写出一条即可)。(3)为获得更纯的沉淀M,加入氢氧化钠溶液时控制pH的最佳取值范围为___________________________。(4)从生产流程中______(填“能”或“不能”)判断出金属C是什么,理由:________________________。
Fe+H2SO4===
FeSO4+H2↑(或2Al+3H2SO4===Al2(SO4)3+3H2↑)
3.2~3.7(或3.2<pH<3.7)
滤液中含有两种金属元素
类型3 工业三废的处理(物质的回收利用) 用硫酸渣吸收含氯废气来制备氯化铁晶体,不仅能解决环境污染问题,还具有较好的经济效益,其工艺流程如下:(查阅资料:硫酸渣主要成分为SiO2、Fe2O3、FeO、CaO等;含氯废气主要含有HCl和Cl2)
(1)浆料吸收含氯废气后pH______(填“增大”“不变”或“减小”),该吸收过程中,硫酸渣发生的主要化学反应如下:①金属氧化物与酸反应,其中氧化铁发生反应的化学方程式为______________________________。②2FeCl2+Cl2===2______。(2)操作I的名称是______,此操作需要用到的玻璃仪器有烧杯、漏斗和________,滤液1中除了H+、Cl-外,还存在较多的离子是Fe3+和______(填离子符号)。
Fe2O3+6HCl===2FeCl3+3H2O
(3)根据10 ℃时CaSO4的溶解度为0.24 g,在降低含钙量的过程中加入硫酸铁发生复分解反应,该反应的化学方程式为________________________________________。(4)经操作Ⅲ可以从滤液2中获得FeCl3晶体,操作方法是:在酸性条件下进行蒸发浓缩、__________、过滤、洗涤、干燥。
Fe2(SO4)3+3CaCl2
===2FeCl3+3CaSO4↓
水的软化通常是指除去水中可溶性钙、镁离子,从而降低水的硬度。下图是某燃煤电厂产生的脱硫废水(含有CaCl2、MgCl2、MgSO4等物质)进行软化的一种工艺流程:
(1)“沉淀”步骤需要不断搅拌,目的是______________。(2)写出“一级沉淀”中生成氢氧化镁的化学方程式:___________________________________________________________________________ (任写一个)。
Ca(OH)2+MgCl2
===Mg(OH)2↓+CaCl2[或Ca(OH)2+MgSO4===Mg(OH)2↓+CaSO4]
(3)“二级沉淀”中固体Y的化学式为__________;加入稀盐酸的目的是_____________________________。(4)软化处理过程中,碳酸钠和熟石灰的添加顺序不能颠倒,原因是_____________________________________________。(5)生活中检验是否为软水一般可选用的试剂为________。
除去溶液中的NaOH和Na2CO3
顺序颠倒,则Ca2+除不尽,不能达到软化的目的
电石渣[主要成分为Ca(OH)2,还含有MgO等杂质]是一种工业废渣,以它为原料可生产纳米碳酸钙。已知:①NH4Cl溶液显酸性:②“浸取”时的主要反应为Ca(OH)2+2NH4Cl===CaCl2+2NH3·H2O③“碳化”时的主要反应为CaCl2+2NH3·H2O+CO2===CaCO3↓+2NH4Cl+H2O
(1)制备方案中“操作1”是______。(2)在“浸取”步骤中,用不同质量分数的NH4Cl溶液浸取电石渣时,Ca元素提取率和Mg元素去除率的数值如图所示,你认为较适宜的NH4Cl质量分数是______。
(3)在“碳化”步骤中,为了增大溶液与二氧化碳的接触面积,需要在碳化塔(图)中进行喷雾碳化,为使碱化的溶液与二氧化碳充分反应,CO2应从碳化塔的____处通入(填“A”或“B”)。
类型4 混合物成分分析 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、NaCl和KOH中的一种或几种。为探究其组成,某小组进行的实验流程和现象记录如下:
(1)依据步骤①的现象可得出该固体物质中一定不含__________(填化学式)。(2)步骤②中发生反应的化学方程式为____________________________________。步骤③中发生反应的化学方程式为____________________________________________。
BaCl2+Na2CO3===BaCO3↓+
BaCO3+2HNO3===
Ba(NO3)2+H2O+CO2↑
(3)根据上述实验现象可得出该固体物质中一定含有________________(填化学式,下同)。(4)该固体物质中可能含有______。取无色溶液B,依次滴加AgNO3溶液和稀HNO3,有白色沉淀产生且沉淀不溶解,能否说明该固体物质中可能含有的物质存在,并说明理由:______________________________________________________________。
不能,因为步骤②中加入的
BaCl2溶液引入了Cl-,会影响检验
类型5 拓展实际工业生产设备 (2020·东营)下图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
(1)用高炉冶铁的主要反应原理是_____________________________(用化学方程式表示)。(2)分析流程图,三脱装置中发生反应的基本反应类型为__________。(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中________(填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性____(填“>”“=”或“<”)镍,判断依据是___________________________(用化学方程式表示)。(5)通过以上信息,得出白铜的成分是__________________,其硬度比纯铜____(填“大”或“小”)。
Fe+NiSO4===Ni+FeSO4
Ni、Cu(或镍、铜)
氨基钠(NaNH2)是合成维生素A的原料。工业上生产氨基钠的流程如图1:(1)人体补充维生素A可以预防________。(2)碳化塔中发生反应的基本类型是__________。
(3)工业上常用液化分离法将沸点不同的气体分开。根据表中数据分析,合成塔中要将产物NH3与N2、H2分开,温度应控制在____(填序号)。①-253 ℃≤t<-33.5 ℃②-253 ℃≤t<-196 ℃③-196 ℃≤t<-33.5 ℃
(4)加热条件下,反应釜中发生反应的化学方程式为__________________________________。(5)为研究温度、金属钠的投加量对产物中氨基钠含量的影响,每次取120 mL液氨做了系列实验结果如图2所示,分析可知,用120 mL液氨制备氨基钠的最佳条件是____________________________________。(6)上述生产过程中,可循环利用的物质是______________(水除外)。
温度为50 ℃,金属钠的投加量为2.5 g
1.(2023·广东)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图1所示。(1)传统方法:CaCO3在900℃以上完全分解生成CaO和_______(填化学式)。
(2)新方法:ⅰ.电解水属于______反应(填基本反应类型),反应前后氢元素的化合价______(填“升高”“降低”或“不变”)。
ⅱ.反应器1:一定的H2环境及较低温度下CaCO3可与H2反应生成CaO、CO和H2O。CO与H2O的分子个数比为______。CaCO3还可以直接分解。反应器1中CO、CO2的含量随反应温度的变化如图2所示。_____ ℃时,抑制CO2生成的效果最好。ⅲ.反应器2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为__________________________。
(3)与传统方法相比,新方法的优点有____________________________________________(写两条)。
减少二氧化碳排放,减缓温室
2.(2021·广东)牙膏中常用碳酸钙粉末作摩擦剂。利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。(1)反应①的化学方程式为__________________________;操作Ⅰ的名称是______。
(2)反应②的化学方程式为__________________________________,该反应属于________反应(填基本反应类型)。(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由:___________________________________________________________。(4)大气中CO2含量不断上升,会导致__________。我国在联合国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施:__________。
Na2CO3+CaCl2===CaCO3↓+2NaCl
有影响,生成的硫酸钙微溶于水,使溶液B中钙离子减少,
3.(2020·广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:(1)该废酸液的pH____7(填“<”或“>”)。操作Ⅰ的名称为______。
(2)电石渣转化为石灰乳的过程会______(填“吸收”或“放出”)热量。(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是__________和____________(填化学式)。(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为_______。
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为_____。pH较低时产率较低的主要原因是____________________________________________。
pH较低时,磁性铁会与酸反应被消耗,产率较低
4.(2019·广东)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:已知:Zn(OH)2溶于强碱形成可溶性盐。(1)滤渣Ⅰ中一定有____。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是______________________。此过程中Zn还能起到除铜作用,除铜的化学方程式为_________________________,此反应为________(填基本反应类型)。(3)调节pH可用NaOH,但不能过量,其原因是________________________________________________。(4)焙烧Zn(OH)2发生分解反应的化学方程式为__________________________。
Zn+CuSO4===ZnSO4+Cu
Zn(OH)2和NaOH反应
生成可溶性盐,导致产率降低
5.(2018·广东)孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。请回答:(1)滤渣b的化学式为________。
(2)溶液c中的溶质有:H2SO4、________、___________(写化学式)。(3)盐溶液d的颜色为______;实验室蒸发溶液时用到的玻璃仪器有__________________(写1种)。(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O===CaCO3↓+2X,X的名称为________;孔雀石与稀硫酸反应生成气体a的化学方程式为___________________________________________________。
Cu2(OH)2CO3+2H2SO4===2CuSO4+
6.(2014·广东)Na2SO4是制造纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图1所示。
(1)加入NaOH溶液可除去的阳离子是________(填离子符号),其反应的化学方程式为____________________________________。若添加的NaOH溶液和Na2CO3溶液过量,可加入适量________(填名称)除去。(2)操作a的名称是______,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、______。
2NaOH+MgCl2===Mg(OH)2↓+2NaCl
(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察图2的溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤。降温结晶的最佳温度范围是____ ℃以下,因为Na2SO4的溶解度_______________________________________________________。
在30 ℃以下比氯化
钠小(或30 ℃以下受温度影响比氯化钠大)
7.(2023·岳阳)为解决温室效应加剧问题,科学家正在研究如图所示的二氧化碳新的循环体系。
(1)罐装液化石油气是经加压后压缩到钢瓶中的,请你从分子的角度分析并解释:________________________________;
压强增大,气体分子间的间隔减小
相关试卷
这是一份2024年广东省中考化学一轮知识点梳理复习专项训练3---溶解度及其曲线课件PPT,共15页。PPT课件主要包含了典例赏析,T1℃,甲>乙>丙,降温结晶,蒸发结晶,升温结晶,乙>甲,丙>乙,强化训练,C2H5OH等内容,欢迎下载使用。
这是一份2024年广东省中考化学一轮知识点梳理复习专项训练1:化学用语课件PPT,共15页。PPT课件主要包含了要点归纳,O2-,Na+,Ag+,S2-,Ca2+,Mg2+,Al3+,OH-,常见物质的化学式等内容,欢迎下载使用。
这是一份2024年广东省中考化学一轮知识点梳理复习课时32---实验探究题(二)课件PPT,共36页。PPT课件主要包含了典例赏析,有蓝色絮状沉淀生成,溶液由红色变,成无色,+2H2O,锌或碳酸钠或紫色,石蕊溶液,水溶液中都解,离出氢氧根离子,O2和CO2等内容,欢迎下载使用。









