

高中苏教版 (2019)专题3 微粒间作用力与物质性质第四单元 分子间作用力 分子晶体课后测评
展开
这是一份高中苏教版 (2019)专题3 微粒间作用力与物质性质第四单元 分子间作用力 分子晶体课后测评,共16页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
一、单选题
1.下列说法中错误的有
①晶体中有阳离子就一定会存在阴离子②离子键是阴、阳离子间的相互吸引作用③分子晶体的熔点一定比金属晶体低④共价键的强弱决定分子晶体熔、沸点的高低⑤含有离子的晶体一定是离子晶体⑥由同种元素组成的晶体一定是同一类型的晶体
A.3个B.4个C.5个D.6个
2.下列变化规律正确的是
A.KCl、MgCl2、MgO的熔点由低到高
B.H2O、H2S、H2Se的分解温度及沸点都由高到低
C.O2、I2、Hg、NaCl、SiO2的熔点由低到高
D.碳化硅、晶体硅、金刚石、石墨的熔点由低到高
3.下面有关晶体的叙述中,不正确的是
A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个周围距离相等的共有6个
C.干冰晶体中,每个分子周围紧邻12个分子
D.金属铜属于面心立方最密堆积结构,金属镁属于六方最密堆积结构
4.下列物质的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.C3F8(全氟丙烷)与C3H8
C.Na与K
D.邻羟基苯甲酸()与对羟基苯甲酸()
5.短周期主族元素W、X、Y、Z的原子序数依次增大,W原子中有2个未成对电子,X原子的K层与M层电子数相等,W原子的最外层电子数等于X与Y原子的最外层电子数之和,Z单质常温下为气体。下列说法正确的是
A.原子半径B.X的第一电离能比同周期相邻元素的大
C.W与Y形成的化合物不能与酸反应D.Z的简单氢化物的熔沸点比W的高
6.下列叙述与范德华力无关的是
A.气体物质加压或降温时能凝结或凝固
B.熔、沸点高低:
C.干冰易升华,固体不易升华
D.氯化钠的熔点较高
7.下列各组中的两种固态物质熔化或升华时,克服微粒间相互作用力属于同种类型的是
A.冰和冰醋酸B.金刚石和胆矾C.二氧化硅和干冰D.碘和氯化钾
8.化学处处呈现美。下列说法正确的是
A.晶莹剔透的大块水晶是由熔融态的二氧化硅快速冷却得到的
B.冰雪融化需要破坏氢键和范德华力
C.舞台上的白雾给人仙气飘飘的视角效果,是干冰升华时共价键断裂所致
D.无水硫酸铜吸水后变成蓝色胆矾,发生了物理变化
9.第28届国际地质大会提供的资料显示,海底蕴藏着大量的天然气水合物,俗称“可燃冰”。“可燃冰”是一种晶体,晶体中平均每46个分子构建成8个笼,每个笼可容纳1个分子或1个游离的分子。若晶体中每8个笼有6个容纳了分子,另外2个笼被游离分子填充,则“可燃冰”的平均组成可表示为
A.B.C.D.
10.几种晶体的晶胞(或晶体结构)如图所示,下列说法正确的是
A.中的配位数大于干冰中分子的配位数
B.晶胞中,分子的排列方式只有1种方向
C.若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D.石墨晶体层内是共价键,层间是范德华力,所以石墨是一种混合型晶体
二、判断题
11.都称为分子式。(_______)
12.分子间作用力是分子间相互作用力的总称,包括氢键与范德华力。(_______)
13.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 。
14.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 。
15.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 。
三、解答题
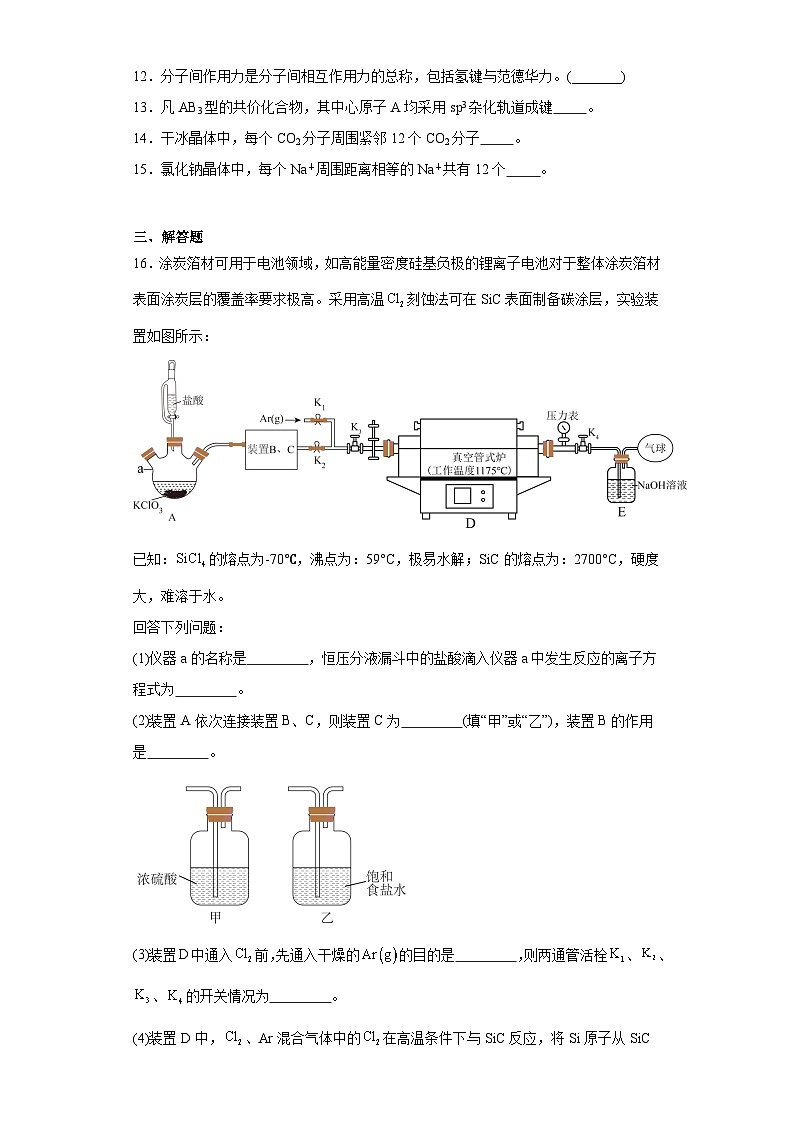
16.涂炭箔材可用于电池领域,如高能量密度硅基负极的锂离子电池对于整体涂炭箔材表面涂炭层的覆盖率要求极高。采用高温刻蚀法可在SiC表面制备碳涂层,实验装置如图所示:
已知:的熔点为-70℃,沸点为:59°C,极易水解;SiC的熔点为:2700°C,硬度大,难溶于水。
回答下列问题:
(1)仪器a的名称是 ,恒压分液漏斗中的盐酸滴入仪器a中发生反应的离子方程式为 。
(2)装置A依次连接装置B、C,则装置C为 (填“甲”或“乙”),装置B的作用是 。
(3)装置D中通入前,先通入干燥的的目的是 ,则两通管活栓、、、的开关情况为 。
(4)装置D中,、Ar混合气体中的在高温条件下与SiC反应,将Si原子从SiC中刻蚀掉,从而形成碳涂层,下列有关该反应的说法正确的是 (填字母)。
a.该反应为置换反应
b.该反应中氧化剂与还原剂的质量比为20∶71
c.该反应中C、Si、Cl的化合价均发生变化
d.、Ar混合气体中Ar起到稀释的作用,减少和C的反应
(5)、SiC的晶体类型依次为 、 。
(6)装置E中气球的作用是 。
17.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物。已知: 青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素 60℃以上易分解。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)从青蒿中提取青蒿素的流程如下:研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如下:
①分离残渣与提取液的实验操作是 ;操作Ⅱ的名称是 。
②提取青蒿素使用的溶剂最好选择 。
③研究发现,青蒿素分子中的某个基团受热不稳定,据此分析用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是 。
④操作Ⅲ的主要过程可能是 (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶 B.加 95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有 NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______ (填字母)具有相似的性质。
A.乙醇B.乙酸C.乙酸乙酯D.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中也含有过氧基团,请写出过氧基的电子式: 。青蒿素所属晶体类型为 晶体。
(4)研究还发现,将青蒿素通过下面反应转化为双氢青蒿素,治疗疟疾的效果更好。
该反应的反应类型是 反应。
(5)科学家对 H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:、乙: H—O—O—H,甲式中 O→O 表示配位键,在化学反应中 O→O 键遇到还原剂时易断裂。化学家 Baeyer 和 Villiyer 为研究 H2O2的分子结构,设计并完成了下列实验:
a.将 C2H5OH 与浓 H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与 H2O2反应,只生成 A 和 H2SO4;
c.将生成的 A 与 H2反应(已知该反应中 H2作还原剂)。
①如果 H2O2的结构如甲所示,实验 c 中化学反应方程式为(A 写结构简式) 。
②为了进一步确定 H2O2的结构,还需要在实验 c 后添加一步实验 d,请设计 d 的实验方案: 。
18.实验室利用和亚硫酰氯制备无水的装置如图所示(加热及夹持装置略)。已知沸点为,遇水极易反应生成两种酸性气体。回答下列问题:
(1)实验开始先通。一段时间后,先加热装置 (填“a”或“b”)。装置b内发生反应的化学方程式为 。装置c、d共同起到的作用是 。
(2)现有含少量杂质的,为测定n值,进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为,杂质和不参与反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则 ;若实验Ⅰ中,称重时样品发生了潮解,则n测量值 (填“偏大”、“偏小”或“无影响”)
(3)用上述装置,根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为:①⑨⑧ ⑩③⑤(填序号),先馏出的物质
溶剂
水
乙醇
乙醚
沸点/℃
100
78
34.5
提取效率
几乎为 0
35%
95%
参考答案:
1.D
【详解】①晶体中有阳离子不一定有阴离子,如金属晶体中存在金属阳离子和自由电子,没有阴离子,①错误;
②离子键是阴、阳离子间的静电作用,包括静电吸引和静电排斥,②错误;
③分子晶体的熔点不一定比金属晶体低,如分子晶体S的熔点高于金属晶体固态汞的熔点,③错误;
④分子晶体熔、沸点的高低取决于分子间作用力的强弱,与共价键的强弱无关,④错误;
⑤含有离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子,⑤错误;
⑥由同种元素组成的晶体不一定是同一类型的晶体,如金刚石、石墨、C60都是由C元素组成的,依次属于共价晶体、混合型晶体、分子晶体,⑥错误;
错误的有6个,答案选D。
2.A
【详解】A.离子半径越小,离子键越强,则晶格能越大,Cl、O的离子半径依次减小,K、Mg的离子半径依次减小,则晶格能由大到小的顺序为MgO>MgCl2>KCl,A项正确;
B.具有分子间氢键的分子晶体,与同族元素的氢化物相比,其熔、沸点较高,则晶体熔点由低到高的顺序为H2S分子晶体,但在常温下Hg为液体,I2是固体,则晶体的熔点体的熔点:SiO2>NaCl>I2>Hg>O2,故C错误;
D.键长越短,共价键越强,熔点越大,键长:C-C键
相关试卷
这是一份苏教版 (2019)第四单元 分子间作用力 分子晶体当堂达标检测题,共16页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子同步练习题,共13页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一节 原子结构巩固练习,共17页。试卷主要包含了1原子结构 同步练习等内容,欢迎下载使用。










