

高中化学鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第4节 分子间作用力课时训练
展开
这是一份高中化学鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第4节 分子间作用力课时训练,共18页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
一、单选题
1.氢键对物质的溶解度影响很大,下列物质在水中的溶解度跟氢键无关的是
A.Cl2 B.CH3CH2OH
C.HFD.HNO3
2.含Tp配体的钌(Ru)配合物催化氢化生成甲酸的机理如图所示。下列叙述错误的是
A.循环A中Ru的成键数目不变
B.循环A中物质所含氢键均为分子间氢键
C.图中涉及的CH3CN和HCOOH,碳原子有三种杂化方式
D.该催化反应的原子利用率为100%
3.下列物质的性质或相关数据与氢键无关的是
A.氨气极易溶于水
B.邻羟基苯甲酸( )的熔点为159℃,对羟基苯甲酸( )的熔点为213℃
C.二甲醚微溶于水,而乙醇可与水以任意比例混溶
D.分解时吸收的热量比分解时吸收的热量多
4.下列说法正确的是
A.的基态原子核外电子共占有8种不同的能级
B.邻羟基苯甲醛分子内氢键示意图:
C.第四周期元素的基态原子中,未成对电子数最多的是
D.分子中的键形状:
5.类比推理是化学中常用的思维方法,下列推理正确的是
A.的熔沸点高于,则的熔沸点也高于
B.是非极性分子,在水中的溶解度不大,则在水中的溶解度也很小
C.由于键能大而结构稳定,则键能也大结构也很稳定
D.分子的空间结构为三角锥形,则分子的空间结构也为三角锥形
6.下列关于物质结构的说法错误的是
A.I3AsF6晶体中存在I,I的几何构型为V形
B.CH4和NH都是正四面体结构键角均为109°28′
C.氨基氰(NH2CN)分子内σ键与π键数目之比为2:1
D.甲醛(HCHO)的键角约为120°,分子之间存在氢键
7.化合物T是一种用于合成药物的重要试剂,其结构简式如图所示。已知X、Y、Z、M、N为原子序数依次增大的前四周期主族元素,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关叙述正确的是
A.原子半径:M>N>Z
B.简单氢化物稳定性和沸点均为:Z>M
C.化合物YM2与YZM均为非极性分子
D.化合物T中所有原子均满足8电子相对稳定结构
8.下列物质变化,只与范德华力有关的是
A.干冰熔化B.乙酸汽化C.乙醇与丙酮混溶D.溶于水
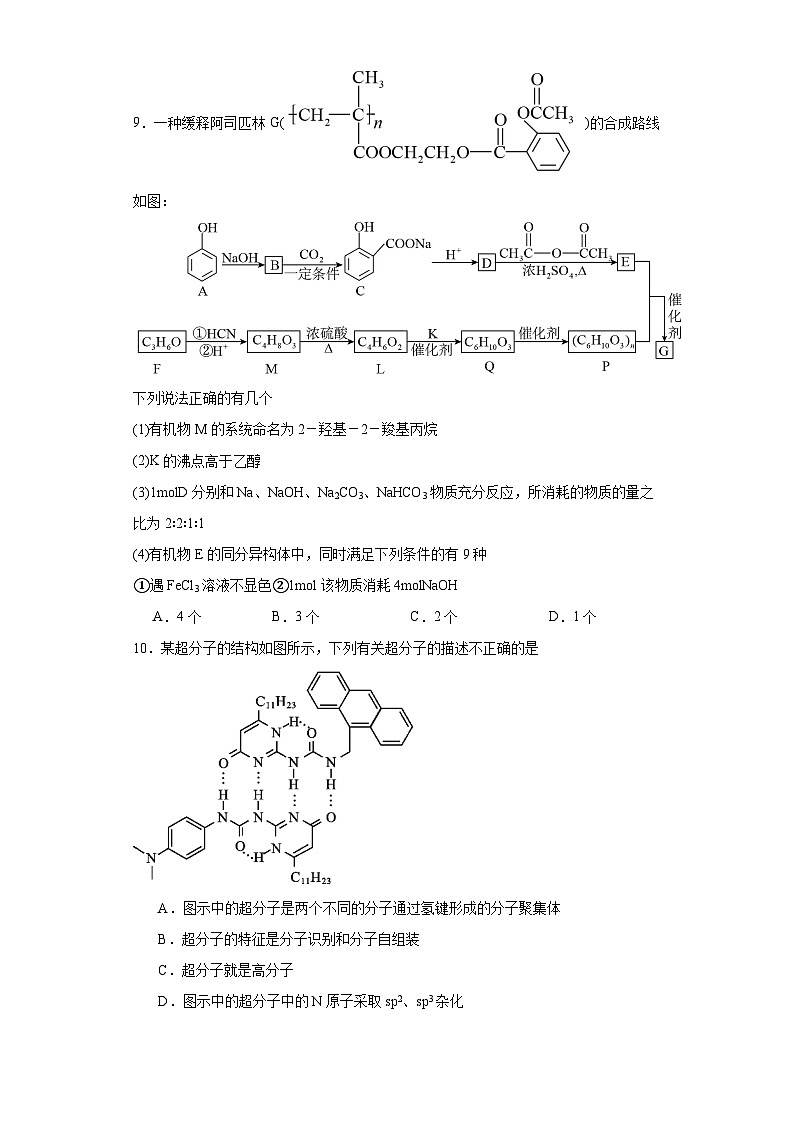
9.一种缓释阿司匹林G( )的合成路线如图:
下列说法正确的有几个
(1)有机物M的系统命名为2-羟基-2-羧基丙烷
(2)K的沸点高于乙醇
(3)1mlD分别和Na、NaOH、Na2CO3、NaHCO3物质充分反应,所消耗的物质的量之比为2∶2∶1∶1
(4)有机物E的同分异构体中,同时满足下列条件的有9种
①遇FeCl3溶液不显色②1ml该物质消耗4mlNaOH
A.4个B.3个C.2个D.1个
10.某超分子的结构如图所示,下列有关超分子的描述不正确的是
A.图示中的超分子是两个不同的分子通过氢键形成的分子聚集体
B.超分子的特征是分子识别和分子自组装
C.超分子就是高分子
D.图示中的超分子中的N原子采取sp2、sp3杂化
二、判断题
11.可燃冰()中甲烷分子与水分子间形成了氢键。( )
12.水与丙酮能完全互溶的原因是两种分子间能形成氢键。(_______)
13.氨水中氨分子与水分子间形成了氢键。( )
14.易溶于水,其水溶液呈碱性。(______)
15.氢键是化学键。
三、解答题
16.Ⅰ.某实验小组拟设计实验探究溶液导电性的影响因素。
(1)甲组同学利用教材实验装置图(如图所示)探究不同溶液的导电性。以硫酸为例,观察到的现象是:灯泡发光,且 。继续向该溶液中滴加等浓度的溶液,发现灯泡逐渐变暗至熄灭,然后又逐渐变亮。请写出加入溶液至灯泡熄灭时发生反应的离子方程式 。
Ⅱ.乙组同学认为教材实验设计过于简单,无法全面探究溶液导电性的影响因素。查阅资料后,该组同学利用数字化实验探究不同类型电解质溶液在浓度变化时的导电性。
已知:溶液导电性强弱可以用电导率表征,电导率越大,溶液的导电能力越强。
(2)实验用到的药品有:硫酸溶液、硫酸钠、硫酸钾、硫酸镁、硫酸铜。准确配制上述5种电解质溶液,每种电解质配制至的不同浓度的系列溶液待测。配制溶液过程中除了下列仪器外,还需要用到的玻璃仪器有 (填名称)。配制的硫酸溶液,需量取 70%的硫酸溶液()。
(3)利用所配制的硫酸盐溶液通过电导率传感器采集数据,得到下表(电导率符号,单位):
通过分析表格数据小组同学获得了以下结论:
①同种电解质溶液随浓度增大,电导率呈现出先增大后减小的变化规律。
②在一定浓度范围内,电解质溶液浓度相同、阴离子相同且阳离子所带电荷数相同时, 越小,电导率越大。
试解释结论①中浓度增大电导率反而减小的原因: 。
(4)实验测得同浓度硫酸溶液的电导率明显大于其对应盐溶液的电导率。
查阅资料发现,可以用格鲁萨斯电导机理解释:酸溶液的导电,本身不是像盐溶液中的金属离子一样从溶液的一端移动至另一端,而是沿着氢键从一个水分子传递给另一个水分子,所以电导率很大。如图(a)表示五个水分子之间的质子传递,箭头表示传递方向,“…”表示氢键。请在下图(b)中画出质子传递结束后的水分子示意图并标出氢键。(无需表达出水分子的真实键角)
Ⅲ.同一温度下,在两份完全相同的溶液中,分别滴入物质的量浓度相等的、溶液,其电导率随滴入溶液体积变化的曲线如下图所示。
(5)点溶液所含溶质主要为 。
(6)点溶液的电导率大于点的原因是 。
17.邻乙酰水杨酰氯()是制备贝诺酯(一种非甾体抗风湿解热镇痛药)的中间产物。实验室制备邻乙酰水杨酰氯的装置如下图所示:
步骤1:取18.0g阿司匹林()置于三颈烧瓶中,加入2~3滴DMF;
步骤2:向三颈烧瓶中滴加氯化亚砜(SOCl2);
步骤3:70℃下充分反应后,除去过量的SOCl2,经一系列操作即可得到邻乙酰水杨酰氯。
已知:①反应原理为+SOCl2+SO2↑+HCl↑
②有关物质的沸点如下表所示:
③氯化亚砜和邻乙酰水杨酰氯均易水解。
回答下列问题:
(1)仪器M的名称是 ,在本实验中使用它的原因是 。
(2)三颈烧瓶宜采用水浴加热,该加热方式的优点是 。
(3)实验中选用球形冷凝管而不选用直形冷凝管的原因是 ;干燥管中的无水CaCl2若更换为 试剂,则可省去尾气吸收的NaOH溶液及其装置。
(4)反应物SOCl2的空间结构名称是 。
(5)阿司匹林的沸点高于邻乙酰水杨酰氯的原因可能是 。
(6)反应温度适宜选取70℃的原因是 ;除去过量SOCl2宜采用 方法。
18.在空气中易被氧化。某小组探究绿矾()和莫尔盐在空气中的稳定性。
实验一:探究绿矾和莫尔盐溶液的稳定性。
分别配制A、B两种溶液[其中A表示,B表示],露置于空气中一段时间,并检验其中的含量,结果如表所示。
(1)新配制的A溶液,原因是发生了水解,离子方程式是 。
(2)常温时,溶液,则B溶液中水解程度: (填“>”“
(3)
(4)莫尔盐
(5)对比实验ⅳ,同样在密闭容器中,能被氧化
(6) 晶体逐渐变白 氢键
(7)分子较难进入晶体中与反应
【详解】(1)发生水解反应的离子方程式是,因此新配制的A溶液;
(2)由题意可知,等浓度的溶液的酸性比溶液的酸性强,说明B溶液中水解程度:;
(3)溶液均减小说明酸性增强,被空气氧化生成红褐色沉淀的离子方程式为,A、B溶液中的实验现象相同,则绿矾和莫尔盐溶液的稳定性相差不大;
(4)两种晶体在露置、盛有干燥剂的密闭容器的条件下实验现象不同(绿矾晶体逐渐变白,莫尔盐晶体无明显变化),的含量不同(绿矾晶体中多,莫尔盐晶体中少),可得出结论,相同条件下,两种晶体在空气中稳定性更强的是莫尔盐;
(5)对比实验ⅳ,同样在密闭容器中,能被氧化,则绿矾在实验ⅱ中含量少不是不足造成的;
(6)①绿矾晶体失去结晶水的实验现象是晶体逐渐变白;
②莫尔盐晶体中能与分子之间形成氢键,使结晶水不易失去;
(7)结合上述实验现象分析可得,莫尔盐晶体在空气中更稳定,可能的原因还有莫尔盐晶体中离子间的空隙较小,分子较难进入晶体中与反应。
相关试卷
这是一份鲁科版 (2019)选择性必修2第1章 原子结构与元素性质第1节 原子结构模型一课一练,共9页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
这是一份高中苏教版 (2019)专题3 微粒间作用力与物质性质第四单元 分子间作用力 分子晶体课后测评,共16页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第4节 分子间作用力课后练习题,共38页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。










