

高中化学鲁科版 (2019)选择性必修2第1节 共价键模型随堂练习题
展开
这是一份高中化学鲁科版 (2019)选择性必修2第1节 共价键模型随堂练习题,共13页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
一、单选题
1.X、Y、Z、W是原子序数依次增大的短周期元素,X是地壳含量最多的元素,Y的单质灼烧火焰为黄色,Z位于周期表ⅢA族,W与X属于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Z的最高价氧化物的水化物的碱性比Y的强
D.X的简单气态氢化物的热稳定性比W的强
2.类推是一种经常采用的科研和学习方法,下列类推结论合理的是
A.由钠在空气中燃烧产物是 Na2O2,推出锂在空气中燃烧产物是 Li2O2
B.由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应
D.由Cl2与水反应生成 HCl 和 HClO,推出F2 与水反应生成 HF 和 HFO
3.N原子核外能量最高的电子具有不同的
A.能级B.电子云伸展方向C.电子云形状D.自旋方向
4.W、X、Y和Z为原子序数依次增大的前三周期的四种主族元素。W和X可形成一种红棕色有刺激性气味的气体,,X与Z同族,且Z的原子序数是X的2倍;Y的周期序数等于主族序数3倍。下列说法错误的是
A.Y的氢化物为离子化合物
B.X、Z具有相同的最高价
C.简单离子半径大小
D.X与其他三种元素均可形成两种或两种以上的二元化合物
5.根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3
B.钠元素的金属性比镁元素的强
C.如图所示实验不能证明元素的非金属性:Cl>C>Si
D.铊(81Tl)与Al同主族,其单质既能与盐酸反应又能与氢氧化钠溶液反应
6.关于元素周期表,下列叙述中正确的是( )
A.H2S的稳定性比HCl强
B.Mg(OH)2碱性比Ca(OH)2强
C.X2+的核外电子数目为18,则X在第四周期第ⅡA族
D.在金属元素与非金属元素的分界线附近可以寻找制备超导体材料的元素
7.常温下,根据下列实验操作和现象得出的结论正确的是
A.AB.BC.CD.D
8.盐溶液经常用于滴定分析中。其制备反应的化学方程式为,下列说法正确的是
A.标准状况下每生成,转移电子
B.的溶液中含有
C.第一电离能由小到大的顺序为
D.中共含有电子
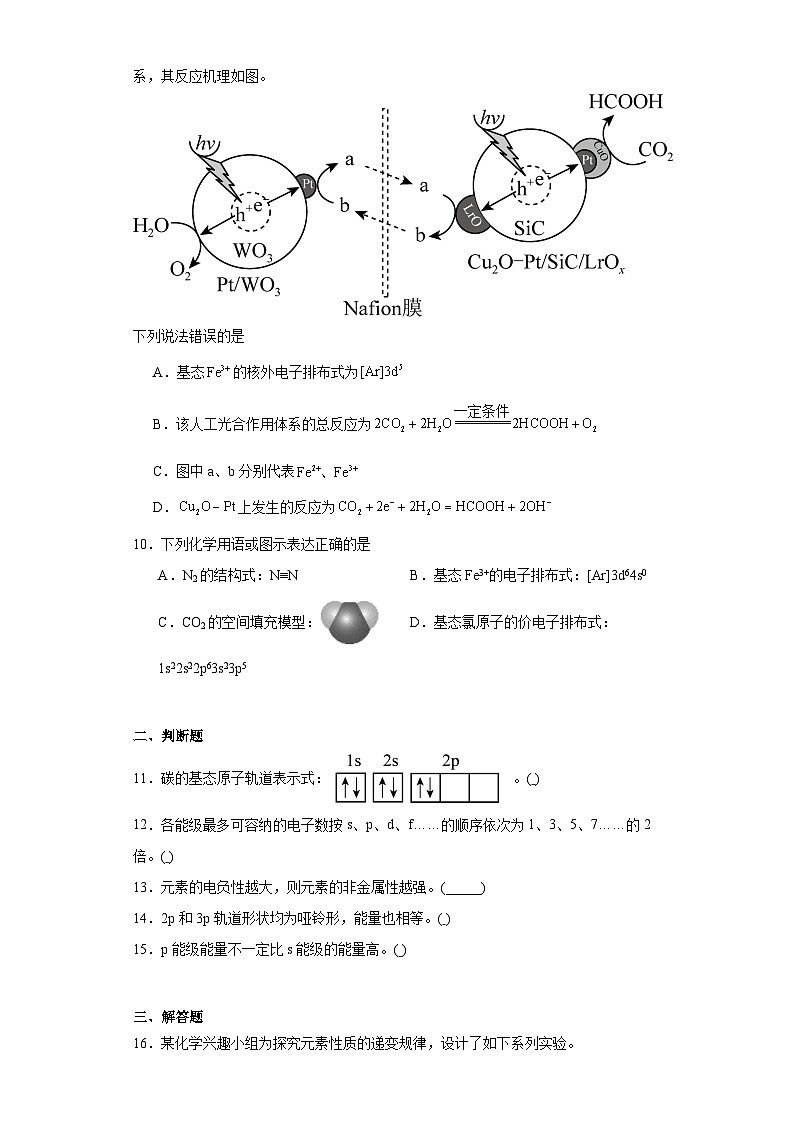
9.科研人员通过控制光沉积的方法构建型复合材料光催化剂,然后以和渗透Nafin膜构建了一个还原反应和氧化反应分离的人工光合作用体系,其反应机理如图。
下列说法错误的是
A.基态的核外电子排布式为
B.该人工光合作用体系的总反应为
C.图中a、b分别代表
D.上发生的反应为
10.下列化学用语或图示表达正确的是
A.N2的结构式:N≡NB.基态Fe3+的电子排布式:[Ar]3d64s0
C.CO2的空间填充模型:D.基态氯原子的价电子排布式:1s22s22p63s23p5
二、判断题
11.碳的基态原子轨道表示式: 。( )
12.各能级最多可容纳的电子数按s、p、d、f……的顺序依次为1、3、5、7……的2倍。( )
13.元素的电负性越大,则元素的非金属性越强。(_____)
14.2p和3p轨道形状均为哑铃形,能量也相等。( )
15.p能级能量不一定比s能级的能量高。( )
三、解答题
16.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 ml分别投入到足量的0.1 ml·L-1的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? ;说明理由: 。
Ⅱ、利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为 ,干燥管D的作用是 。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为 、 、 ,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 。
(5)已知C中是硅酸钠溶液,如要证明非金属性:C > Si,请选择相应的试剂,则A中加 、B中加 。
17.三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取的反应为,其实验装置如图所示:
已知:①(俗称光气)有毒,遇水发生水解;
②碱性条件下,可将氧化为;酸性条件下,将还原为。
回答下列问题:
(1)基态原子的简化核外电子排布式为 。
(2)无水的作用是 。
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可通过 (填操作方法)使实验继续进行。
(4)装置G中发生生成两种盐的反应的化学方程式为 。
(5)测定产品中质量分数的实验步骤如下:
I.取产品,在强碱性条件下,加入过量的溶液,小火加热使完全转化为,继续加热一段时间;
II.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使转化为,再加适量的蒸馏水将溶液稀释至;
III.取溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的的标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗标准溶液(已知被还原为)。
①该样品中的质量分数为 (保留小数点后两位,)
②下列操作将导致产品中质量分数测定值偏低的是 (填标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
18.某学生在做同一主族元素性质的递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管。
药品:新制的氯水、新制的溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在表中横线处填写相关内容):
(4)实验结论: 。
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为 、 。
②请用本章所学内容简单说明得出上述结论的原因 。
选项
实验操作和现象
实验结论
A
分别测量浓度均为0.1ml·L-1Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大
Al(OH)比CO更容易结合H+
B
将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀
亚硫酸钠样品已变质
C
将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液,
非金属性:Cl>C>Si
D
向BaCl2溶液中通入SO2和气体X,出现白色沉淀
气体X一定具有氧化性
序号
实验方案
实验现象
①
向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置
液体分为两层,下层呈 色
②
向盛有少量碘化钠溶液的试管中滴加少量新制的溴水,振荡,再加入少量四氯化碳,振荡后静置
液体分为两层,下层呈 色
参考答案:
1.D
【分析】X、Y、Z、W是原子序数依次增大的短周期元素,X是地壳含量最多的元素,则X为O元素;Y的单质灼烧火焰为黄色,则Y为Na元素;Z位于周期表ⅢA族,则Z为Al元素;W与X属于同一主族,则W为Cl元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则同周期元素Na、Al、Cl的原子半径为r(Na)>r(Al)>r(Cl),故A错误;
B.由O、Na组成的过氧化钠是离子化合物,化合物中含有离子键和共价键,则B错误;
C.元素的金属性越强,高价氧化物对应的水化物的碱性越强,钠的金属性强于铝,则氢氧化钠的碱性强于氢氧化铝,故C错误;
D.元素的非金属性越强,简单气态氯化物的热稳定性越强,氧元素的非金属性强于氯元素,则水比氯化氢稳定,故D正确;
故选D。
2.C
【详解】A.锂在空气中燃烧产物只有 Li2O,A错误;
B.碱金属元素单质熔点从上到下呈降低趋势,B错误;
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应,C正确;
D. F2 与水反应生成 HF 和 O2,D错误;
故选C。
3.B
【详解】A.N原子核外能量最高的电子是2p能级上有3个电子,这三个电子都在2p能级,故A不符合题意;
B.三个电子有三个伸展方向分别为px、py、pz,故B符合题意;
C.p轨道电子云形状为纺锤形,故C不符合题意;
D.p轨道三个电子自旋方向相同,故D不符合题意。
故答案选B。
4.B
【分析】Y的周期序数等于主族序数3倍,Y为Na元素, X与Z同族,且Z的原子序数是X的2倍,X是O元素,Z是S元素,W和X可形成一种红棕色有刺激性气味的气体, W是N元素。
【详解】A.Y的氢化物NaH是由Na+和H-构成的离子化合物,A正确;
B. S的最高价为+6价,O无最高正价,B错误;
C.O2-、Na+电子层结构相同,原子序数越大,离子半径越小,离子半径:O2-大于Na+,O2-、Na+有2个电子层, S2-有3个电子层,S2-半径较大,简单离子半径大小,C正确
D.O与N、S、Na可形成NO、NO2、N2O4、SO2、SO3、Na2O、Na2O2的二元化合物,D正确;
故答案选B。
5.D
【详解】A.元素的非金属性越强,其简单气态氢化物的稳定性越强,O元素的非金属性强于N元素,所以气态氢化物的稳定性:,故A正确;
B.同周期主族元素从左至右,元素的金属性逐渐减弱,所以钠元素的金属性比镁元素的强,故B正确;
C.证明元素非金属性强弱,比较的是元素的最高价氧化物对应水化物的酸性,稀盐酸不是氯元素的最高价氧化物对应的水化物,根据图中信息无法比较与C的非金属性强弱,故C正确;
D.铊()与铝同主族,同主族元素随原子序数的增大,金属性逐渐增强,金属性:,则能与酸反应,但不与氢氧化钠溶液反应,故D错误;
故选D。
6.C
【详解】A.非金属性S<Cl,则H2S的稳定性比HCl弱,A错误;
B.金属性Mg<Ca,则Mg(OH)2碱性比Ca(OH)2弱,B错误;
C.X2+的核外电子数目为18,则X的质子数是18+2=20,X是Ca,位于第四周期第ⅡA族,C正确;
D.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素,D错误。
答案选C。
7.A
【详解】A.后者pH更大,说明Al(OH)比CO更容易结合H+,从而导致溶液中氢离子浓度减小,pH增大,A正确;
B.酸性条件下硝酸根离子会把亚硫酸根离子氧化为硫酸根离子生成硫酸钡沉淀,干扰亚硫酸钠变质的检验,B错误;
C.挥发的盐酸也会和硅酸钠生成硅酸沉淀,干扰二氧化碳和硅酸钠的反应,C错误;
D.向BaCl2溶液中通入SO2和气体X,出现白色沉淀,该白色沉淀可能为BaSO4或BaSO3,则气体X可能具有氧化性或者碱性,D错误;
故选A。
8.A
【详解】A.反应中和变价,化合价由降到0,标准状况下每生成,转移电子的物质的量为,A正确;
B.水解,则的溶液中含有小于,B错误;
C.第一电离能:,C错误;
D.1个中含有14个电子,中含有电子,D错误;
故选:A。
9.D
【详解】A.基态F原子的核外电子排布式为,失去3个电子后变成,故基态的核外电子排布式为,A正确;
B.由题图中物质的转化关系得,人工光合作用体系中反应的化学方程式为,B正确;
C.由题图可知Nafin膜的左边水失电子生成氧气,发生氧化反应,则铁元素发生还原反应,Nafin膜的右边二氧化碳得电子生成甲酸,发生了还原反应,则铁元素发生氧化反应,图中a、b分别代表,C正确;
D.因为该体系中存在与的循环,所以介质应为酸性,在催化剂表面得到电子并结合生成HCOOH,上发生的反应为,D错误;
故选D。
10.A
【详解】A. 氮气分子内存在氮氮三键,则N2的结构式:N≡N,A正确;
B. Fe的原子序数为26,基态Fe的电子排布式:[Ar]3d64s2,基态Fe3+的电子排布式:[Ar]3d5,B错误;
C.空间填充模型为的分子构型为V形,CO2分子中,孤电子对数、价电子对数,CO2分子的空间构型为直线形、不是V形,C错误;
D. 基态氯原子的电子排布式:1s22s22p63s23p5,价电子排布式: 3s23p5,D错误;
答案选A。
11.错误
【详解】基态碳原子的核外电子排布式为1s22s22p2,根据洪特规则,2p轨道上的2个电子应该分别在2个轨道上,且自旋方向相同,轨道表示式: ,故错误。
12.正确
【详解】各能级按s、p、d、f……的顺序含有的原子轨道数依次为1、3、5、7……,每个原子轨道最多容纳2个自旋方向相反的电子,故各能级最多可容纳的电子数按s、p、d、f……的顺序依次为1、3、5、7……的2倍,是正确的。
13.正确
【详解】依据元素电负性的概念可知,元素电负性越大,元素的非金属性越强,故说法正确。
14.错误
【详解】2p和3p轨道形状均为哑铃形,能量2pS,利用氯气和Na2S氧化还原反应可以验证,仪器A的名称为分液漏斗,干燥管D的作用是防止倒吸;(4)装置A、B、C中所装药品分别为浓盐酸、MnO2、Na2S溶液,装置C中的现象为有淡黄色沉淀生成,说明Cl2氧化Na2S生成了S,离子方程式为:S2-+Cl2=S↓+2Cl-;(4)若要证明非金属性:S>C>Si,则A中加浓硫酸,B中加Na2CO3,C中加Na2SiO3,硫酸和碳酸钠反应生成CO2,再将生成的CO2通入C中CO2、水和硅酸钠反应生成硅酸,反应的离子方程式为:CO2+H2O+SiO32-=H2SiO3+CO32-,证明酸性硫酸>碳酸>硅酸。
点睛:本题考查化学实验设计。明确元素的构位性三者的关系,结合实验中最高价氧化物的水化物的酸性强弱进行设计是解答本题的关键。
17.(1)
(2)防止G中水蒸气进入E及C装置
(3)对D处稍加热
(4)
(5) 88.76 AC
【分析】实验室制取的反应Cr2O3(s)+3CCl4(g)2CrCl3(s)+3COCl2(g),易潮解高温下易被氧气氧化,所以要防止装置内在高温条件下不能存在空气,反应结束后继续通入一段时间氮气,让在氮气氛围中冷却,防止空气进入使氧化;A中装浓H2SO4,干燥N2并防止空气中水蒸气进入C装置;无水CaCl2防止G中水蒸气进入E及C装置;反应结束后继续通入一段时间氮气,将 COCl2排入装置 G 中并被充分吸收。
【详解】(1)原子序数为24,基态原子的简化核外电子排布式为;
(2)根据分析,无水的作用是防止G中水蒸气进入E及C装置;
(3)三氯化铬易升华,实验过程中若D处出现堵塞,可通过对D处稍加热使实验继续进行;
(4)装置G吸收COCl2,发生反应生成两种盐,化学方程式为;
(5)①根据原子守恒可得,与发生氧化还原反应,根据电子得失守恒可得~6,总关系式为~6,则的物质的量为ml,该样品中的质量分数为;
②A.步骤I末继续加热一段时间,过量的在步骤Ⅱ中会将还原为Cr3+,则滴定时消耗标准溶液体积减小,测定的质量分数偏低,A正确;
B.步骤Ⅲ中所用已变质,则滴定用标准液体积偏大,测定的质量分数偏高,B错误;
C.步骤Ⅱ中末加浓磷酸,指示剂会提前变色,则消耗标准液体积偏小,测定的质量分数偏低,C正确;
D.步骤Ⅲ中读数时,滴定前俯视(读数偏小),滴定后平视,读取标准液的体积偏大,测定的质量分数偏高,D错误;
故选AC。
18. 橙 紫 同一主族元素从上到下元素原子的得电子能力逐渐减弱 同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱
【详解】向NaBr溶液中加入新制的氯水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈橙色。
向NaI溶液中加入新制的溴水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈紫色。
两个实验说明:同一主族元素从上到下元素原子的得电子能力逐渐减弱。
(3)氯气具有氧化性,能将溴离子氧化为溴单质,溴单质更易溶于四氯化碳中,在有机层显示橙红色;溴单质能将碘离子氧化为碘单质,碘单质单质更易溶于四氯化碳中,在有机层中显示紫红色;
(4)氯气具有氧化性,能将溴离子氧化为溴单质,所以氧化性是氯气强于溴单质,溴单质能将碘离子氧化为碘单质,所以氧化性是溴单质强于碘单质,氧化性越强,元素的非金属性越强,即非金属性:Cl>Br>I,得出同主族元素性质的递变规律:同主族元素性质相似,且从上到下,元素的非金属性逐渐减弱;
(5) ①氯气具有氧化性,能将溴离子氧化为溴单质,2Br-+Cl2=2Cl-+Br2,溴单质能将碘离子氧化为碘单质2I-+Br2=2Br-+I2;
②同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱。
相关试卷
这是一份鲁科版 (2019)选择性必修3第3节 烃习题,共14页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
这是一份高中鲁科版 (2019)第1节 认识晶体课时练习,共16页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第1节 共价键模型习题,共13页。试卷主要包含了单选题,判断题,解答题等内容,欢迎下载使用。










