
人教版初中化学二轮复习专题练习-溶液
展开这是一份人教版初中化学二轮复习专题练习-溶液,共15页。试卷主要包含了 溶液的概念, 溶液的基本特征, 溶液的形成, 溶解度和饱和溶液, 溶液的浓度,7%,6 g等内容,欢迎下载使用。
1. 溶液的概念:溶液是一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物。其中,被溶解的物质叫做溶质,可以是固体、液体或气体;能溶解其它物质的物质叫做溶剂,通常只能是一种,可以是固体、液体或气体。
2. 溶液的基本特征:溶液具有均一性和稳定性。均一性指溶液各部分的性质、组成完全相同,外观表现为透明、澄清、颜色一致。稳定性指外界条件不变时,溶液不论放置多久,溶质与溶剂不会分层。
3. 溶液的形成:当溶质的分子间作用力与溶剂的分子间作用力相互作用时,溶质就能够溶解在溶剂中,形成溶液。这个过程涉及到溶质分子或离子在溶剂中的无规则运动,即扩散,使得溶质充分分散在溶剂中。
4. 溶解度和饱和溶液:溶解度是指在一定温度下,溶剂中能够溶解的溶质的最大数量。当在一定温度下加入的溶质量达到该溶剂的溶解度时,溶液被称为饱和溶液。
5. 溶液的浓度:浓度是指单位体积或单位质量内所含有的溶质质量的多少。常用的浓度单位有百分比浓度、质量浓度和体积浓度等。百分比浓度是指溶质质量与溶液总质量之比,用百分数表示。质量浓度是指单位体积溶液中溶质的质量,用单位为g/L表示。体积浓度是指单位体积溶液中溶质的体积,用单位为mL/L表示。
一、选择题
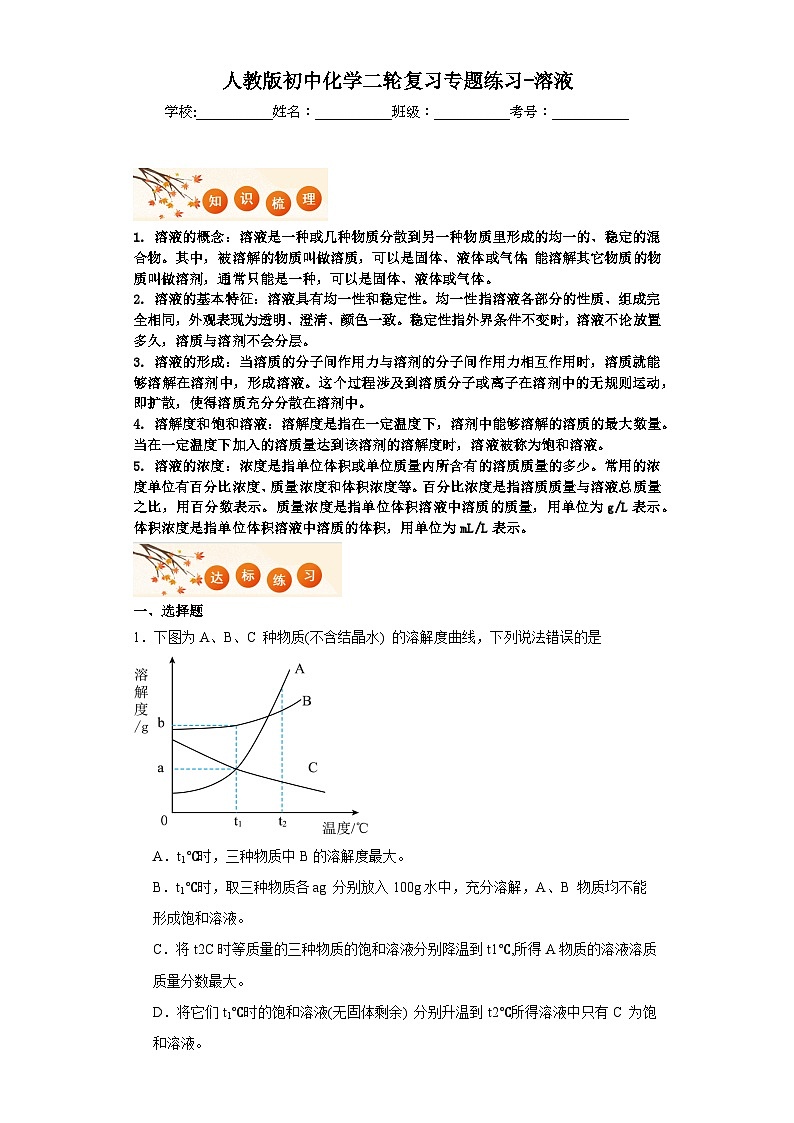
1.下图为A、B、C 种物质(不含结晶水) 的溶解度曲线,下列说法错误的是
A.t1℃时,三种物质中B的溶解度最大。
B.t1℃时,取三种物质各ag 分别放入100g水中,充分溶解,A、B 物质均不能形成饱和溶液。
C.将t2C时等质量的三种物质的饱和溶液分别降温到t1℃,所得A物质的溶液溶质质量分数最大。
D.将它们t1℃时的饱和溶液(无固体剩余) 分别升温到t2℃所得溶液中只有C 为饱和溶液。
2.化学中也有“加法”,下列“加法”正确的是
A.10g氯化钠溶液与10g硝酸银溶液完全反应所得溶液的质量为20g
B.100g10%的NaCl溶液和100g蒸馏水混合,得到200g5%的NaCl溶液
C.pH=3的稀盐酸与pH=4的稀盐酸等体积混合得到pH=7的溶液
D.20°C时,20g的氯化钠固体加入20g氯化钠饱和溶液中得到40g溶液
3.下图是硫酸镁的溶解度曲线。下列有关溶液①~④的说法不正确的是
A.①中溶液的质量为130gB.溶质质量分数:②<④
C.③中溶质与溶剂的质量比为1:2D.属于饱和溶液的只有②
4.溶液对生命活动、人类生产活动具有重要意义、下列相关叙述错误的是
A.溶液一定是均一、稳定的混合物
B.硝酸铵固体溶于水,溶液温度降低
C.稀溶液不一定是不饱和溶液
D.饱和溶液升温一定能变为不饱和溶液
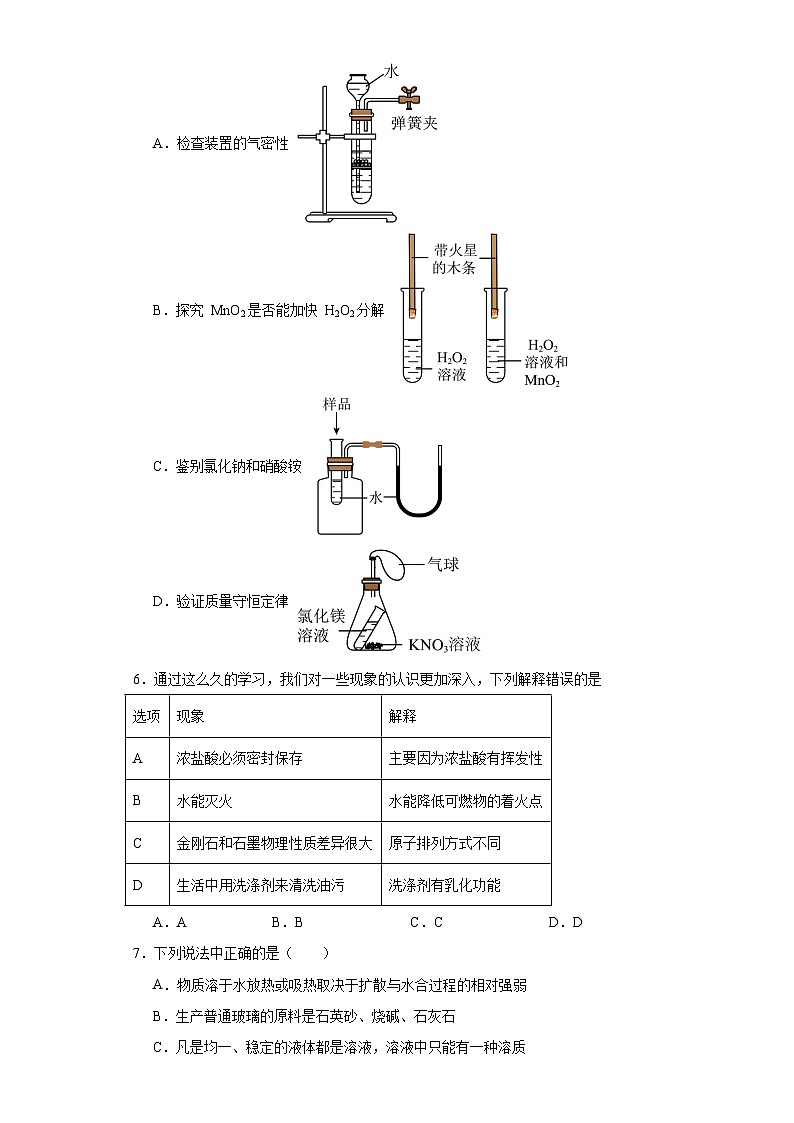
5.下列实验方案,不能达到相应实验目的的是
A.检查装置的气密性
B.探究 MnO2是否能加快 H2O2分解
C.鉴别氯化钠和硝酸铵
D.验证质量守恒定律
6.通过这么久的学习,我们对一些现象的认识更加深入,下列解释错误的是
A.AB.BC.CD.D
7.下列说法中正确的是( )
A.物质溶于水放热或吸热取决于扩散与水合过程的相对强弱
B.生产普通玻璃的原料是石英砂、烧碱、石灰石
C.凡是均一、稳定的液体都是溶液,溶液中只能有一种溶质
D.空气按体积比计算氧气氧气最多,氮气次之
8.甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
A.升高温度可使丙的饱和溶液变为不饱和溶液
B.t2℃乙、丙两种溶液所含溶质的质量一定不同
C.t1℃甲、丙饱和溶液的溶质质量分数均为16.7%
D.t2℃甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲=丙
9.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法中正确的是
A.乙的溶解度大于甲的溶解度
B.t2℃时,乙的饱和溶液升温或降温均会析出晶体
C.t3℃时,甲、乙溶液中溶质的质量相等
D.t1℃时甲、乙的饱和溶液混合,所得溶液仍为饱和溶液
10.某同学梳理归纳了以下知识:①分子、原子都是不显电性的粒子,所以不显电性的粒子一定是分子或原子;②若不慎将少量浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液;③硬水通过活性炭吸附后可变为软水;④配制6%的氯化钠溶液,量取水时,仰视量筒刻度会使所配氯化钠溶液质量分数偏低;⑤除去烧碱中混有的少量Na2CO3杂质,可加入过量的盐酸,然后蒸发结晶;⑥燃烧都伴随着发光、放热,所以有发光、放热现象的一定是燃烧。其中正确的个数有
A.2个B.3个C.4个D.5个
二、判断题
11.固体物质的溶解度都随温度的升高而增大( )
12.同一物质在不同溶剂中的溶解性不同( )
13.还能够继续溶解溶质的溶液是不饱和溶液。
14.冰水混合物不属于溶液( )
15.判断硫酸铜溶液已经饱和的方法是观察溶液颜色。( )
三、综合应用题
16.实验室常用溶质质量分数为 6%的 H2O2溶液制取少量氧气。
(1)配制 6 %的 H2O2稀溶液
①计算:市售 H2O2溶液溶质质量分数通常为 30 %。配制 500 g 6 %的 H2O2溶液,需要30 %的 H2O2溶液质量为 g。
②配制:量取所需 H2O2溶液和水于烧杯中,用玻璃棒搅拌,充分混合。
③装瓶:把配制好的 H2O2稀溶液装入试剂瓶中,贴上标签。在下图标签中填上相应的内容 。
(2)制取氧气(可能用到的部分装置如图)
①可选择的发生装置为 (填序号)。
②可用 C 装置收集 O2的理由是 。
(3)利用化学方程式计算,340 g 6 %的 H2O2溶液理论上可制取氧气的质量是多少?
17.防治空气污染是保护人类生存、保障社会可持续发展的大事。
Ⅰ.酸雨的形成
(1)pH<5.6的降水被称为酸雨,但正常雨水pH在5.6-6.0,略显酸性,主要原因是 。
(2)硫酸型酸雨的形成有以下两种途径:
假设每一步均完全反应,相同质量的硫元素通过上述两种途径产生硫酸的质量关系为:途径1 途径2(填“大于”“小于”或“等于”)
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),我们可利用此原理来测定空气中SO2的含量。请写出该反应的化学方程式 ,其中化合价发生改变的元素有 种。
Ⅱ.酸雨的防治
某烟气中含N2、O2、SO2等气体,以FeSO4催化处理其中的SO2,部分流程如图-1所示。开始时需向“脱硫”装置中加入一定量的FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液pH的影响如图-2所示:
已知:“脱硫”时发生的主要反应有2SO2+O2+2H2O2H2SO4
(4)计算脱除32gSO2的同时会生成H2SO4的质量。
(5)“脱硫”一段时间后,FeSO4溶液的浓度会升高,原因是 。
(6)温度大于60℃时脱硫率下降,可能的原因是 。
18.探究从身边的物质开始
过氧化氢,是一种无机化合物,化学式为H2O2。纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体。其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会缓慢分解成水和氧气,但分解速度极其慢,加快其反应速度的办法是加入催化剂二氧化锰等或用短波射线照射。
(1)我们在用双氧水处理伤口时,除了观察到有气泡产生之外还会发现伤口周围的皮肤有发白现象,你认为造成该现象的原因是过氧化氢具有 性;
(2)假设过氧化氢和水的密度一样,图示浓度的双氧水中过氧化氢与水的体积比为 。
(3)利用下列装置可以完成实验室制取某些气体,请根据要求回答问题。
①图中仪器①的名称是 。
②若利用A装置制氧气,其反应的文字表达式是 。
③实验室制取二氧化碳、过氧化氢制取氧气都可选用B装置,其原因是 、 。
④若用F装置来代替C装置收集气体,首先应采取的操作是 ,然后将要收集的气体从导管口 (填“a”或“b”)通入。
(4)在探究二氧化锰作过氧化氢分解的催化剂实验中,发现将二氧化锰加入过氧化氢溶液后,产生大量气体,并有白雾产生,伸入带火星的木条,未条未复燃,稍等一会,再伸入带火星的木条,木条复燃。
【分析】向过氧化氢溶液中加入二氧化锰,反应时放出大量的热。请根据该信息分析起初伸入木条没有复燃的原因是 。
【查阅资料】生石灰、氯化钙和浓硫酸是常见的干燥剂:可用于干燥氧气等;水蒸气含量越高,相对湿度越大。
【提出问题】相同条件下,浓硫酸、生石灰、氯化钙三种物质,哪种物质的干燥效果更好?
【设计实验】实验I:在老师指导下,兴趣小组同学按图1实验,测定所收集气体的相对湿度,然后将装置中盛浓硫酸的洗气装置撤去,将干燥管中的生石灰换成氯化钙,利用相同浓度的过氧化氢溶液重新进行实验,测定结果如图2所示。
【讨论】
①实验时,两次使用相同浓度的过氧化氢溶液,其目的是 。
②三种干燥剂中,相同时间内,浓硫酸的干燥效果最好,其原因可能是 。
【深入探究】由图2可知,即使用浓硫酸干燥,所收集的氧气中仍然含有一定量的水蒸气,为此,小组同学继续进行如下探究:
实验Ⅱ:利用同浓度的过氧化氢与二氧化锰作用,将产生的气体连续两次通过浓硫酸,然后收集并测定收集气体的相对湿度。测得收集到氧气的相对湿度为20%。
实验Ⅲ:利用同浓度的过氧化氢溶液与二氧化锰作用,将产生的氧气通过多孔球泡(如下图)导入浓硫酸中,然后收集并测定收集气体的相对湿度,观察到气体由多孔球泡进入浓硫酸中,气泡多且细小,收集到的氧气的相对湿度为16%。
【分析】对比实验I,实验Ⅱ、Ⅲ处理后的气体较干燥,实验Ⅱ采取的措施是 ,实验Ⅲ采取的措施是 。
序号
①
②
③
④
温度/℃
30
30
70
90
加入MgSO4的质量/g
30
50
50
50
水的质量/g
100
100
100
100
选项
现象
解释
A
浓盐酸必须密封保存
主要因为浓盐酸有挥发性
B
水能灭火
水能降低可燃物的着火点
C
金刚石和石墨物理性质差异很大
原子排列方式不同
D
生活中用洗涤剂来清洗油污
洗涤剂有乳化功能
参考答案:
1.C
【详解】A、由溶解度曲线可知:t1℃时,三种物质中B的溶解度最大,不符合题意;B、t2℃时,A、B物质溶解度都大于ag,取三种物质各ag分别放入100g水中,充分溶解,A、B物质均不能形成饱和溶液,不符合题意;C、将t2℃时等质量的三种物质的饱和溶液分别降温到t1℃所得B物质的溶液溶质质量分数最大,不是A物质的溶液溶质质量分数最大,符合题意;D、将它们t1℃时的饱和溶液(无固体剩余)分别升温到t2℃,所得溶液中只有C为饱和溶液正确,因为C的溶解度随温度的升高而减少,不符合题意。故选C。
2.B
【详解】A、氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,因此两种溶液完全反应所得溶液的质量小于20g,故选项说法不正确;
B、100g10%的NaCl溶液和100g蒸馏水混合,所得NaCl溶液中溶质的质量分数为×100%=5%,故选项说法正确;
C、pH =3的稀盐酸与pH=4的稀盐酸等体积混合,得到的溶液的pH应在3~4之间,故选项说法不正确;
D、20℃时,20g的氯化钠固体加入20g氯化钠饱和溶液,不能继续溶解,溶液的质量不变,仍为20g,故选项说法不正确。
故选B。
3.D
【详解】A、由图可知,30℃时,硫酸镁的溶解度是40g,即该温度下,100g水中最多能溶解40g硫酸镁,故30℃时,将30g硫酸镁加到100g水中,硫酸镁能全部溶解,形成的是不饱和溶液,形成溶液的质量为:30g+100g=130g,不符合题意;
B、由图可知,30℃时,硫酸镁的溶解度是40g,故该温度下,将50g硫酸镁加到100g水中,硫酸镁不能全部溶解,形成的是饱和溶液,90℃时,硫酸镁的溶解度是50g,故该温度下,将50g硫酸镁加到100g水中,恰好饱和,30℃时,硫酸镁的溶解度小于90℃时,硫酸镁的溶解度,故30℃时,硫酸镁饱和溶液的溶质质量分数<90℃时,硫酸镁饱和溶液的溶质质量分数,即溶质质量分数:②<④,不符合题意;
C、由图可知,70℃时,硫酸镁的溶解度>50g,故该温度下,将50g硫酸镁加到100g水中,硫酸镁能全部溶解,③是不饱和溶液,故③中溶质与溶剂的质量比为:50g:100g=1:2,不符合题意;
D、由以上分析可知,属于饱和溶液的是:②④,符合题意。
故选D。
4.D
【详解】A. 溶液一定是均一、稳定的混合物,此选项正确;
B. 硝酸铵固体溶于水,吸收大量的热,故溶液温度降低,此选项正确;
C. 稀溶液与溶液是否饱和无关,所以稀溶液不一定是不饱和溶液,此选项正确;
D. 对于溶解度随温度升高而增大的物质的饱和溶液,升温一定能变为不饱和溶液,此选项错误。
故选D。
5.D
【详解】A、关闭弹簧夹,向长颈漏斗中加入水,且水面浸没长颈漏斗的管口后,如长颈漏斗中的液面不下降,说明装置不漏气,选项正确;
B、实验中观察到左侧试管中的带火星木条不复燃,右侧试管中的带火星木条复燃,说明右侧试管中生成的氧气的速率快,氧气的浓度大,证明MnO2能加快 H2O2分解,选项正确;
C、向试管中加入氯化钠后,U型管中的两侧水面持平,说明装置中的气体的体积不变,则氯化钠溶于水没有热量的变化,向试管中加入硝酸铵后,观察到U型管中左侧液面升高,右侧液面降低,说明装置中的气体收缩,气体遇冷,证明硝酸铵溶于水吸收热量,选项正确;
D、氯化镁与硝酸钾不反应化学反应,没有新物质生成,则该实验不能验证质量守恒定律,选项错误。
故选D。
6.B
【详解】A、浓盐酸有挥发性,易挥发出氯化氢气体,所以浓盐酸必须密封保存,故A不符合题意;
B、水能灭火,是因为水蒸发吸热,降低温度至着火点以下,可燃物的着火点为固有属性,不能改变,故B符合题意;
C、金刚石和石墨均为碳单质,由于它们的碳原子排列方式不同,则它们的物理性质不同,故C不符合题意;
D、洗涤剂能够洗涤油污是因为洗涤剂的乳化作用,将大的油滴分散成小油滴,随水流走,故D不符合题意。
故选B。
7.A
【详解】A、溶质在溶解时,向水中扩散过程中吸收热量,与水分子形成水合分子或水合离子的过程放出热量,故物质溶于水放热或吸热取决于扩散与水合过程的相对强弱,则A正确;
B、生产普通玻璃的原料是石英砂、纯碱、石灰石,不是烧碱,则B错误;
C、水是均一、稳定的液体,但不是溶液,溶液中的溶质可以是多种,则C错误;
D、空气按体积比计算氮气最多,约占空气总体积的78%,其次是氧气,约占空气总体积的21%,则D错误。
故选A。
8.C
【详解】A、丙物质的溶解度随温度的升高而减小,所以降低温度可使丙的饱和溶液变为不饱和溶液,故选项错误;
B、t2℃时,乙物质的溶解度大于丙物质的溶解度,但两种溶液的状态、质量不能确定,所以溶液中所含的溶质的质量可能不同,故选项错误;
C、t1℃时,甲、丙物质的溶解度均是20g,所以饱和溶液的溶质质量分数均为:16.7%,故选项正确;
D、t1℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等;甲、乙溶解度随温度的降低而降低,丙的溶解度随温度的降低而升高,降低温度,甲、乙物质会析出晶体,丙物质不会析出晶体,应该丙按照t2℃时的溶解度计算,所以t2℃时,甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:乙>甲>丙,故选项错误。故选C。
9.B
【详解】A.未指明温度,所以甲、乙物质的溶解度无法比较,错误;
B.由溶解度曲线图可知,在t2℃时,升温或降温乙的溶解度均会减小,所以t2℃时,乙的饱和溶液升温或降温均会析出晶体,正确;
C.t3℃时,甲、乙两条曲线相交于一点,说明该温度下,甲、乙两物质的溶解度相等,但是未说明甲、乙两物质是否为饱和溶液以及溶液的质量,所以无法比较甲、乙溶液中溶质的质量,错误;
D.t1℃时将甲、乙的饱和溶液混合,二者均会互相溶解在对方的溶液中,所以所得溶液均为不饱和溶液,错误;
故选B。
10.A
【详解】①分子、原子都是不显电性的粒子,所以不显电性的粒子不一定是分子或原子;还有可能是中子,故归纳错误;
②若不慎将少量浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液;故归纳正确;
③活性炭吸附色素和异味,硬水通过活性炭吸附后不可变为软水;故归纳错误;
④配制6%的氯化钠溶液,量取水时,仰视量筒刻度会使量取水的体积增大,使得溶液质量增大,所配氯化钠溶液质量分数偏低;故归纳正确;
⑤除去烧碱中混有的少量Na2CO3杂质,加入过量的盐酸,会使得氢氧化钠和碳酸钠都与盐酸反应,不能达到除杂的目的,故归纳错误;
⑥燃烧都伴随着发光、放热,但不是所有发光、放热现象的都是燃烧,如灯泡会发光放热,但不是燃烧,故归纳错误;
故正确的有②④,有2个。
故选A
11.错误
【详解】大部分固体的溶解度随温度的升高而增大,但有的固体物质的溶解度随温度的升高而减小,如氢氧化钙。错误。
12.正确
【详解】物质的溶解性受溶剂和溶质的性质影响,同一物质在不同溶剂中的溶解性不同。如食用油不容于水却可以溶解于汽油中。正确。
13.错
【详解】不饱和溶液的概念:在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。但在此题中并没有指明一定温度和一定量溶剂,因此此题错误。
14.正确
【详解】冰水混合物中只含有水这种物质,水不属于溶液。
15.错误
【详解】判断溶液是否饱和的方法是继续加入这种溶质,看是否能够继续溶解,而观察颜色不确定的因素太多,没有统一的标准可以验证是否饱和,故错误。
16.(1) 100
(2) B 不易溶于水,且与水不反应
(3)解:设 340 g 6%的 H2O2溶液理论上可制取氧气的质量是 x,
x=9.6 g
答:340 g 6%的 H2O2溶液理论上可制取氧气的质量是 9.6 g
【详解】(1)①解:设需要30%的过氧化氢溶液的质量为x,根据稀释前后,溶质的质量不变,可得:500g×6%=30%x,x=100g;
③标签上应注明溶液名称和溶质质量分数,故填: ;
(2)①实验室用过氧化氢溶液和二氧化锰制取氧气,属于固液不加热反应,发生装置可选B;
②可用C装置,即排水法收集氧气,是因为氧气不易溶于水,且与水不反应;
(3)见答案。
17.(1)空气中的二氧化碳和水反应生成碳酸,碳酸的溶液显酸性
(2)等于
(3)
两/2
(4)解:设生成H2SO4的质量为x,则有
解得x=46g
答:脱除32gSO2的同时会生成H2SO4的质量为46g。
(5)脱硫时SO2 、O2与H2O反应生成硫酸,消耗水,加入的铁粉与生成的H2SO4反应生成FeSO4,使FeSO4增多,则FeSO4溶液的浓度会升高
(6)气体的溶解度随温度升高而降低,当温度大于60℃时,O2、SO2在水中的溶解度降低,导致反应不充分
【详解】(1)空气中的二氧化碳和水反应生成碳酸,碳酸的溶液显酸性,因此正常雨水略显酸性;
(2)根据图示信息得出二氧化硫中的硫元素通过途径1完全转化到硫酸中,通过途径2也全部转化到硫酸中,根据质量守恒,可以得出两种途径产生硫酸的质量关系为:途径1等于途径2;
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),根据反应前后元素种类不变,可知反应物中有水,该反应的化学方程式为:;
反应物SO2中硫元素为+4价,生成物硫酸中硫元素为+6价,反应物I2中碘元素为0价,生成物HI中碘元素为-1价,反应前后氢元素均为+1价,氧元素均为-2价,故其中化合价发生改变的元素有硫元素和碘元素2种;
(4)见答案;
(5)由于脱硫时SO2 、O2与H2O反应生成硫酸,水减少,加入的铁粉与生成的H2SO4反应生成FeSO4,使FeSO4增多,则FeSO4溶液的浓度会升高
(6)由于气体的溶解度随温度升高而降低,当温度大于60℃时,O2、SO2在水中的溶解度降低,导致反应不充分,所以脱硫率降低。
18.(1)强氧化或氧化
(2)3:97
(3) 长颈漏斗 固体与液体混合 不需要加热 F装置装满水 b
(4) 放出的热量导致水蒸发,带火星木条不复燃的原因是水蒸气含量较大 控制变量,过氧化氢溶液的浓度不相同,反应速率不同,气体带出的水蒸气量也不同 液体和气体的接触面积较大,接触时间长,吸收更充分 增加干燥的次数、延长时间 增大和干燥剂的接触面积
【解析】(1)
我们在用双氧水处理伤口时,除了观察到有气泡产生之外还会发现伤口周围的皮肤有发白现象,该现象的原因是过氧化氢具有强氧化性或氧化性;
(2)
水的密度是1g/cm3,假设过氧化氢和水的密度一样,该瓶过氧化氢的质量为100mL×1g/cm3=100g,溶质过氧化氢的质量为:100g×3%=3g,水的质量为100g-3g=97g,图示浓度的双氧水中过氧化氢与水的体积比为(3g÷1g/cm3):(97÷1g/cm3)=3:97;
(3)
①图中仪器①的名称是长颈漏斗;
②A装置是固体加热装置,且试管口没有棉花,是氯酸钾和二氧化锰加热制取氧气,反应的文字表达式为:;
③反应物的状态和反应条件决定使用的发生装置。实验室制取二氧化碳、过氧化氢制取氧气都可选用B装置,其原因是固体与液体混合、不需要加热;
④若用F装置来代替C装置收集气体,首先应采取的操作是F装置装满水,气体的密度比水小,然后将要收集的气体从导管口b通入;
(4)
分析:过氧化氢在二氧化锰的催化作用下,分解成水和氧气,放出的热量导致水蒸发,起初伸入木条没有复燃的原因是水蒸气含量较大;
讨论:
①反应物的浓度会影响反应的速率,产生气体的速率不同,则带出的水蒸气含量可能不同,所以要控制这个变量;
②分析图2,液体干燥剂的效果比固体好,可能是液体和气体的接触面积更大,接触时间长,吸收更加充分;
分析:实验II是用了两次浓硫酸来干燥,所以增加了干燥的次数,延长了干燥时间;实验III利用了多孔球泡,增大了和液体(干燥剂)的接触面积。
相关试卷
这是一份人教版初中化学二轮复习专题练习-空气,共15页。试卷主要包含了 空气的组成, 空气的性质, 氧气的用途, 氮气的性质和用途, 空气中的污染物及其危害, 空气质量的检测和控制等内容,欢迎下载使用。
这是一份人教版初中化学二轮复习专题练习-氧气,共13页。试卷主要包含了 氧气的物理性质, 氧气的化学性质,2g,则剩余的固体物质是锰酸钾,8kg,2L等内容,欢迎下载使用。
这是一份人教版初中化学二轮复习专题练习-水,共14页。试卷主要包含了 水的组成和性质, 水的电离和溶液的酸碱性, 水的净化和处理, 水的用途和危害,1g,故只能称量5等内容,欢迎下载使用。












