




福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题(Word版附解析)
展开
这是一份福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题(Word版附解析),文件包含福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题原卷版docx、福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
(考试时长:90分钟,满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16
第I卷
一、选择题(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1. 下列生活中问题,不能用金属键理论知识解释的是
A 铁易生锈B. 用金属铝制成导线
C. 用铂金做首饰D. 用铁制品做炊具
【答案】A
【解析】
【详解】A.铁易生锈,是因为铁中含有碳,易发生电化学腐蚀,与金属键无关,故A正确;
B.用金属铝制成导线,是利用金属的导电性,金属中存在金属阳离子和“自由电子”,当给金属通电时,“自由电子”定向移动而导电,能用金属键理论知识解释,故B错误;
C.用金箔做首饰,是因为有金属光泽,金属具有光泽是因为自由电子能够吸收可见光,能用金属键理论知识解释,故C错误;
D.用铁制品做炊具,是利用了金属的导热性,金属容易导热是因为自由电子在运动时经常与金属离子碰撞而引起能量的交换,能用金属键理论知识解释,故D错误;
答案选A。
2. 在基态多电子原子中,下列叙述不正确的是
A. 2s和3s轨道形状均为球形
B. 3d、4d、5d能级的轨道数相等
C. 4px、4py、4pz轨道相互垂直,且能量相等
D. p能级能量一定比s能级的能量高
【答案】D
【解析】
【详解】A.2s和3s轨道形状均为球形,A项正确;
B.无论是哪个能层上的能级,d能级都有5个轨道,B项正确;
C.同一能层,p轨道上原子轨道能量相等并且互相垂直,C项正确;
D.当s和p能级不在同一能层时,p能级能量不一定比s能级的能量高,D项错误。
故答案为:D
3. 下列说法不正确的是
A. 离子化合物和金属单质的构成粒子中均含有阳离子
B. 离子键和金属健本质上都是静电作用,都没有方向性和饱和性
C. 熔点:MgO>NaCl>Hg>HBr
D. NaHSO4在水溶液中和熔融状态下都能导电,电离方程式相同
【答案】D
【解析】
【详解】A.离子化合物由阳离子和阴离子构成,金属单质中存在金属阳离子和电子,两种物质的构成粒子中均含有阳离子,A正确;
B.离子键和金属键本质上都是静电作用,都没有方向性和饱和性,B正确;
C.MgO和NaCl为离子晶体,镁离子和氧离子半径分别小于钠离子半径和氯离子半径,且镁离子和氧离子所带电荷数分别大于钠离子和氯离子,故MgO熔点高于NaCl,Hg为金属晶体常温下为液态,HBr为分子晶体常温下为气态,故熔点MgO>NaCl>Hg>HBr,C正确;
D.NaHSO4在水溶液中电离方程式为NaHSO4=Na++H++,在熔融状态下电离方程式为NaHSO4=Na++,电离方程式不同,D错误;
故答案选D。
4. 下列有关苯分子中的描述不正确的是
A. 碳原子均以sp2杂化轨道形成正六边形的碳环,键角为120°
B. 每个碳原子还有一个与碳环平面垂直未参与杂化的2p轨道,相互间以“肩并肩”方式相互重叠,形成一个大π键
C. 6条碳碳键完全等同,共有6个原子处于同一平面
D. 每个碳原子的一个 sp2杂化轨道分别与6个H原子的1s轨道重叠形成6条σ键
【答案】C
【解析】
【详解】A.在苯分子中,碳原子都以sp2杂化,通过sp2杂化轨道形成正六边形的碳环,键角为120°,故A正确;
B.每个碳原子还有一个未参加杂化的2p轨道,它们均有一个未成对电子,这些2p轨道相互平行,以“肩并肩”方式相互重叠,形成一个多电子的大π键,故B正确;
C.苯分子呈平面正六边形,分子中共有十二个原子共面,故C错误;
D.每个碳原子含有3个sp2杂化轨道,两条分别与相连碳原子形成sp2-sp2σ键,另外一条分别与6个H的1s轨道重叠形成sp2-sσ键,故D正确;
故选:C。
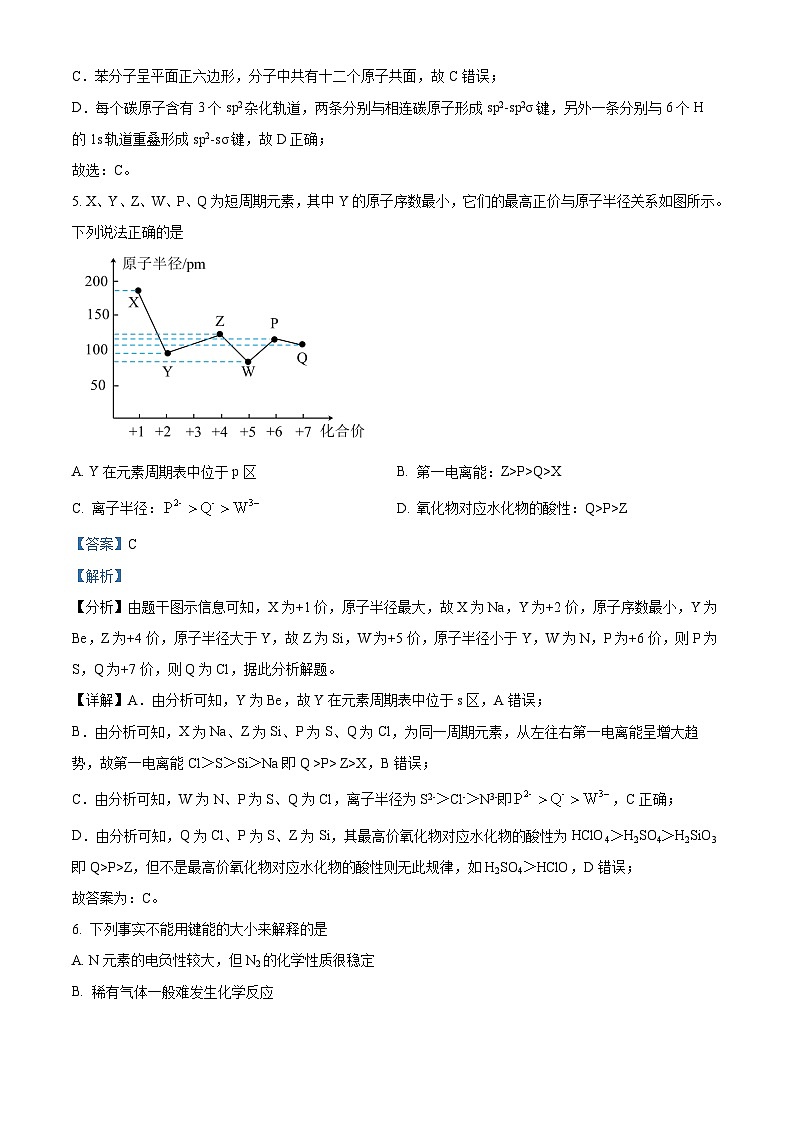
5. X、Y、Z、W、P、Q为短周期元素,其中Y的原子序数最小,它们的最高正价与原子半径关系如图所示。下列说法正确的是
A. Y在元素周期表中位于p区B. 第一电离能:Z>P>Q>X
C. 离子半径:D. 氧化物对应水化物的酸性:Q>P>Z
【答案】C
【解析】
【分析】由题干图示信息可知,X为+1价,原子半径最大,故X为Na,Y为+2价,原子序数最小,Y为Be,Z为+4价,原子半径大于Y,故Z为Si,W为+5价,原子半径小于Y,W为N,P为+6价,则P为S,Q为+7价,则Q为Cl,据此分析解题。
【详解】A.由分析可知,Y为Be,故Y在元素周期表中位于s区,A错误;
B.由分析可知,X为Na、Z为Si、P为S、Q为Cl,为同一周期元素,从左往右第一电离能呈增大趋势,故第一电离能Cl>S>Si>Na即Q >P> Z>X,B错误;
C.由分析可知,W为N、P为S、Q为Cl,离子半径为S2->Cl->N3-即,C正确;
D.由分析可知,Q为Cl、P为S、Z为Si,其最高价氧化物对应水化物的酸性为HClO4>H2SO4>H2SiO3即Q>P>Z,但不是最高价氧化物对应水化物的酸性则无此规律,如H2SO4>HClO,D错误;
故答案为:C。
6. 下列事实不能用键能的大小来解释的是
A. N元素的电负性较大,但N2的化学性质很稳定
B. 稀有气体一般难发生化学反应
C. HF、HCl、HBr、HI的稳定性逐渐减弱
D. F2比O2更容易与H2反应
【答案】B
【解析】
【详解】A.由于N2分子中存在三键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;
B.稀有气体都为单原子分子,分子内部没有化学键;
C.卤族元素从F到I原子半径逐渐增大,其氢化物中的化学键键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱;
D.由于H-F键的键能大于H—O键,所以二者相比较,更容易生成HF。
故选B.
7. 下列化学用语表示不正确的是
A. 的价层电子对互斥模型:
B. 用原子轨道描述氯化氢分子中化学键的形成:
C. 基态C原子的价层电子轨道表示式:
D. 的电子式:
【答案】D
【解析】
【详解】A.H2O分子中中心O原子价层电子对数为2+=4,O原子采用sp3杂化,O原子上含有2对孤电子对,价层电子对互斥模型:,A正确;
B.氯化氢分子中氢原子的1s轨道与氯原子的3p轨道头碰头形成σ键,原子轨道描述氯化氢分子中化学键的形成为:,B正确;
C.碳为6号元素,原子核外价电子排布为2s22p2,价层电子轨道表示式:,C正确;
D.是由钠离子和过氧根离子构成的,电子式:,D错误;
故选D。
8. 化合物A(VXW3YZ)是一种温和的还原剂。W、X、Y、Z、V都是短周期主族元素且原子序数依次增大,A的阴离子的结构如图所示,已知该阴离子所有原子均达到2电子或8电子稳定结构。下列叙述错误的是
A. V元素原子M层电子只有一种自旋方向
B. 简单氢化物稳定性Z强于Y
C. X元素原子核外有5种运动状态不同的电子
D. 中含有键
【答案】D
【解析】
【分析】由题干信息可知,W、X、Y、Z、V都是短周期主族元素且原子序数依次增大,根据阴离子所包含的元素且带一个负电荷可知,阳离子为V+,V为第IA族元素,但由于其原子序数最大,故为Na元素;W元素形成一条共价键,为IA族的H元素或第VIIA族元素,但其原子序数小于V(Na)且是五种元素中最小的,故为H元素;Z元素形成了三条共价键且达8电子稳定结构,故Z原子有一对孤电子对,其价电子数为5,为第VA族的N元素;阴离子带一个负电荷,即X或Y得到一个电子后再两者之间形成了配位键,但由于X的原子序数小于Y,故X为B元素,Y为C元素,据此分析解题。
【详解】A.由分析可知,V为Na,Na元素原子M层上只有3s1电子,故只有一种自旋方向,A正确;
B.由分析可知,Y为C,Z为N,非金属性N>C,故简单氢化物稳定性NH3强于CH4即Z强于Y,B正确;
C.由分析可知,X为B,是5号元素,故X元素即B原子核外有5种运动状态不同的电子,C正确;
D.由分析可知,Z为N、W为H,ZW4W即NH4H是离子化合物,其阳离子为,阴离子为H-,故中含有键,D错误;
故答案为:D。
9. 已知元素周期表中1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列判断正确的是( )
A. 元素的第一电离能:X>WB. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZD. 原子半径:X Ca2+>O2->Al3+,故A错误;
B.Y是Al元素,工业上用电解氧化铝冶炼铝单质,而不是氯化铝,故B错误;
C.Q是S,X是O,二者形成的化合物中,SO2中S原子最外层是10电子结构,SO3中S原子最外层是12个电子,故C错误;
D.经分析,化合物是指CaH2,电子式为,只含有离子键,故D正确;
答案选D。
16. 电负性用来描述不同元素的原子对键合电子吸引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键):
下列说法不正确的是
A. 根据电负性变化规律,确定a的最小范围为1.0
相关试卷
这是一份福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题(原卷版+解析版),文件包含福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题原卷版docx、福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份福建省厦门第一中学2023-2024学年高一下学期3月第一次月考化学试题(Word版附解析),文件包含福建省厦门第一中学2023-2024学年高一下学期3月第一次适应性训练化学试题原卷版docx、福建省厦门第一中学2023-2024学年高一下学期3月第一次适应性训练化学试题解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份福建省永春第一中学2023-2024学年高二下学期3月月考化学试卷(Word版附解析),共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









