









高教版(2021)医药卫生类第三节 化学键精品课件ppt
展开主题一 原子结构与化学键 1.3 化学键
1.了解构成分子的微粒间的相互作用,建立化学键的概念,理解“结构决定性质,性质反映结构”的内涵。2.借助氯化钠晶体结构模型和氯化氢分子形成的视频,认识离子键、共价键的形成及其条件,知道离子化合物和共价化合物的概念。 3.理解化学键断裂和形成是化学反应中物质变化的实质,学会从微观结构和宏观现象相结合的角度分析问题,提升规律总结能力。
金属钠在氯气中燃烧生成氯化钠,而氯化钠即使加热到801 ℃高温也只会熔化但不会分解;氢气在氧气中燃烧生成水,而水只有在强高温或通电情况下才能分解,其中的原因是什么呢?
图1-3-1 电解水装置
将分子(或晶体)中相邻原子之间强烈的相互作用称为化学键。
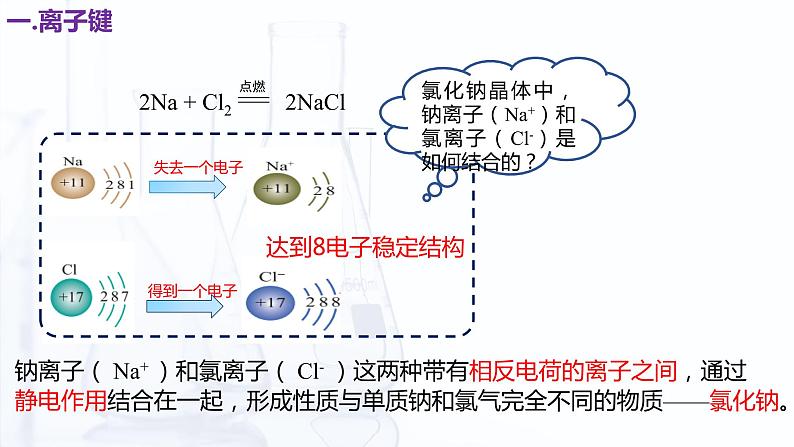
氯化钠晶体中,钠离子(Na+)和氯离子(Cl-)是如何结合的?
钠离子( Na+ )和氯离子( Cl- )这两种带有相反电荷的离子之间,通过静电作用结合在一起,形成性质与单质钠和氯气完全不同的物质——氯化钠。
1.像氯化钠这样,阴、阳离子通过静电作用所形成的化学键,称为离子键。结合原子结构示意图,小组讨论:为什么一般情况下活泼金属元素和活泼非金属元素之间易结合成离子键?
一般形成于活泼金属(IA IIA)与非金属(VIA VIIA)之间
3.离子化合物阴、阳离子通过离子键结合而形成的化合物。
4.常见离子化合物(1)绝大多数盐类、强碱类和活泼金属氧化物都是离子化合物,如KCl、ZnSO4、NaOH、CaO 等。(2) 大多数离子化合物为晶体,具有较高的熔点和沸点,易溶于水。(3)含有离子键的化合物一定是离子化合物;含有金属元素的化合物不一定是离子化合物(如AlCl3);不含金属元素的化合物不一定不是离子化 合物(如NH4Cl)。
画出19K和20Ca的原子结构示意图,讨论它们的化合价为什么分别是+1和+2价?
在化学反应中,主族元素一般都是元素原子的最外层电子(称为价电子)参与反应。为了描述方便,可以在元素符号周围用“•”或“×”表示元素原子最外层的电子,这样的式子叫作电子式。例如,第11~18号元素的电子式为:
【典例】 用电子式表示下列化合物的形成过程NaF:CaCl2:Na2S: MgO:K2O:
观看氯化氢分子形成的视频,结合氢原子和氯原子的原子结构示意图,小组合作对照氯化钠的形成,从核外电子排布的角度出发,分析两者相互作用形成的化学键有什么特点?
得电子能力相同或差别不大,该如何形成化学键呢?又是哪种类型的化学键呢?
氯化氢分子中的化学键也不是离子键。氢气和氯气分子中的化学键不是离子键。
当两个氢原子相互作用形成一个氢分子时,由于它们得失电子的能力相同,都不能失去或得到电子,只能各提供 1 个电子,形成 2 个氢原子共同使用的电子对,使 2 个氢原子都达到稳定结构,这种电子对称为共用电子对。
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。 成键微粒:原子 成键本质:共用电子对 成键条件:一般形成于两个非金属原子之间2.存在:共价键存在于非金属单质的多原子分子中,共价化合物和某些离子化合物中的离子团。
原子之间通过共用电子对形成的化合物判断:只含有共价键的化合物属于共价化合物(即若存在离子键,一定为离子化合物)常见物质类别:①非金属氢化物(如HCl、H2O、NH3)②非金属氧化物(如CO2、SO3)③含氧酸(如H2SO4、HNO3)④大多数有机化合物(如甲烷、乙醇、葡萄糖) 都是共价化合物。
共价化合物在固态时,一般熔点、沸点较低,硬度较小。
小组合作,分析氯化氢的形成过程,并用电子式表示。
氢原子和氯原子各自提供的一个电子,形成一对共用电子对。
用电子式表示下列化合物的形成过程CO2 : H2O: NH3 :
化学上通常用短线“—”表示共价键,一根短线代表一对共用电子。如氯分子可表示为Cl—Cl,氯化氢分子可表示为H—Cl。这种式子叫作结构式。
小组讨论:下面单质分子中的共价键与化合物中的共价键有何不同?
在H2、Cl2、N2 等单质分子中,由于同种原子吸引电子的能力相同,共用电子对不偏向任何一方,这样的共价键称为非极性共价键,简称非极性键。 在HCl、H2O、NH3 等共价化合物分子中,由于不同原子吸引电子的能力不同,共用电子对偏向于吸引电子能力较强的一方。吸引电子能力较强的原子就带部分负电荷,吸引电子能力较弱的原子就带部分正电荷,这样的共价键称为极性共价键,简称极性键。
偏向吸引电子能力强的原子
同种原子形成的共价键,共用电子对不发生偏移。
不同原子形成的共价键,共用电子对发生偏移。
共价键中元素化合价的体现:形成非极性键的原子间共用电子对不偏移,不会产生化合价的升降;而形成极性键的过程中,电子对偏离的元素化合价升高,电子对偏向的元素化合价降低。
配位键(1)概念:由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。(2)表示方法:配位键常用A—B或A→B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
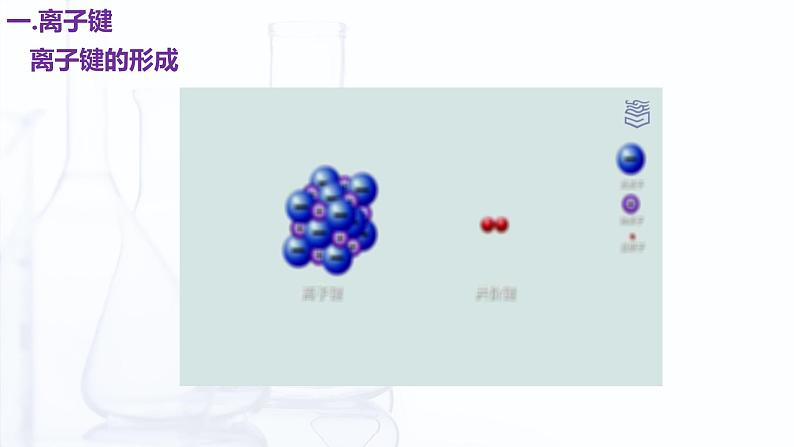
NaCl的晶体结构模型
1.下列叙述正确的是 A.非金属原子间只能形成共价键B.非金属原子间不可能形成离子化合物C.离子化合物中可能有共价键D.共价化合物中可能有离子键【答案】C
2.下列物质属于离子化合物的是A.H2S B.HNO3C.NaCl D.C2H6【答案】C
3.下列说法中正确的是A.H2O2中既有极性键,又含有非极性键B.非金属元素只能形成共价键C.共价化合物H2O2只含共价键,离子化合物Na2O2只含离子键D.金属元素与非金属元素只能形成离子键【答案】A
4.下列物质中既含离子键,又含共价键的是A.H2O B.Na2O2 C.MgCl2D.N2【答案】B
5.下列分子的结构式错误的是A.Cl2:Cl—Cl B.NH3: C.CH4: D.N2:N=N【答案】D
业精一分汗禾滴,爱心一颗花万朵。
P20,1.2.3
高教版(2021)农林牧渔类第三节 化学键优质课课件ppt: 这是一份高教版(2021)农林牧渔类第三节 化学键优质课课件ppt,共17页。PPT课件主要包含了学习目标与核心素养,主要内容,课堂小结等内容,欢迎下载使用。
中职化学高教版(2021)农林牧渔类第二节 元素周期律优质课ppt课件: 这是一份中职化学高教版(2021)农林牧渔类第二节 元素周期律优质课ppt课件,共24页。PPT课件主要包含了学习目标,归纳总结,短周期长周期,二三周期,五六七周期,三短四长,七主七副三八一零等内容,欢迎下载使用。
中职化学高教版(2021)农林牧渔类第三节 化学键优秀课件ppt: 这是一份中职化学高教版(2021)农林牧渔类第三节 化学键优秀课件ppt,共22页。PPT课件主要包含了学习目标,主要内容,物质的量,摩尔质量,物质的量浓度,3物质的量,阿伏加德罗常数,02×1023,mol铁钉,molL等内容,欢迎下载使用。












