









所属成套资源:【中职专用】高中化学(高教版2021·医药卫生类基础模块)同步课件+配套练习含解析卷
中职化学高教版(2021)医药卫生类基础模块主题二 化学反应及其规律第三节 化学平衡优秀ppt课件
展开
这是一份中职化学高教版(2021)医药卫生类基础模块主题二 化学反应及其规律第三节 化学平衡优秀ppt课件,文件包含23化学平衡课件中职专用高中化学高教版2021医药卫生类pptx、23化学平衡练习中职专用高中化学高教版2021医药卫生类原卷版docx、23化学平衡练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
主题二 化学反应及其规律 2.3 化学平衡
1. 认识化学反应是有方向的,了解可逆反应的含义,知道可逆反应在一定条件下能达到平衡状态,构建化学平衡认知模型。2. 了解吸热反应和放热反应,认识化学反应中的能量守恒,初步了解热化学方程式。3.了解浓度、压强、温度等外界条件改变对化学平衡状态的影响,认识化学平衡移动的规律,能够运用勒夏特列原理分析反应条件的选择及控制问题。
一.可逆反应与化学平衡
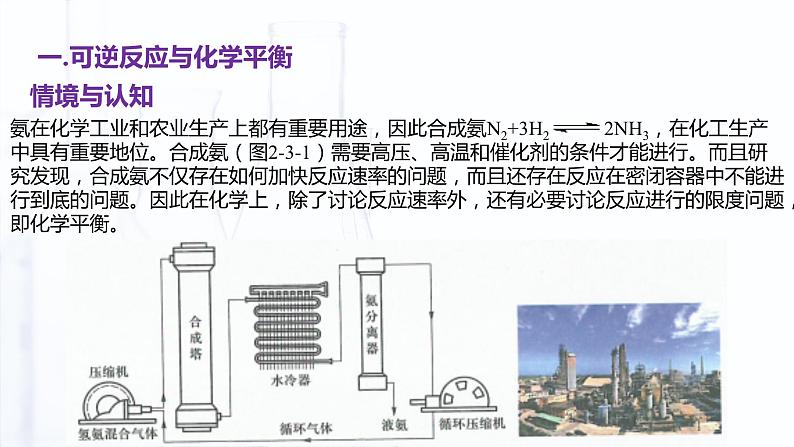
氨在化学工业和农业生产上都有重要用途,因此合成氨N2+3H2 2NH3,在化工生产中具有重要地位。合成氨(图2-3-1)需要高压、高温和催化剂的条件才能进行。而且研究发现,合成氨不仅存在如何加快反应速率的问题,而且还存在反应在密闭容器中不能进行到底的问题。因此在化学上,除了讨论反应速率外,还有必要讨论反应进行的限度问题,即化学平衡。
化学反应存在限度。有的反应不能进行完全。
合成氨反应在密闭容器中不能进行到底,是因为合成氨反应是个可逆反应。研究化学平衡问题,首先要认识可逆反应。有些化学反应在一定条件下一旦发生,反应物能完全转生成物,即反应只向一个方向进行。这样的单向反应称为不可逆反应。如在二氧化锰的催化下,用氯酸钾制备氧气的反应。但大多数化学反应,在同一条件下,能同时向两个相反的方向进行,这类化学反应称为可逆反应。为了表示反应的可逆性,
在同一条件下,能够同时向两个相反方向进行的反应称为可逆反应。可逆反应通常在反应方程式中用符号" "表示。
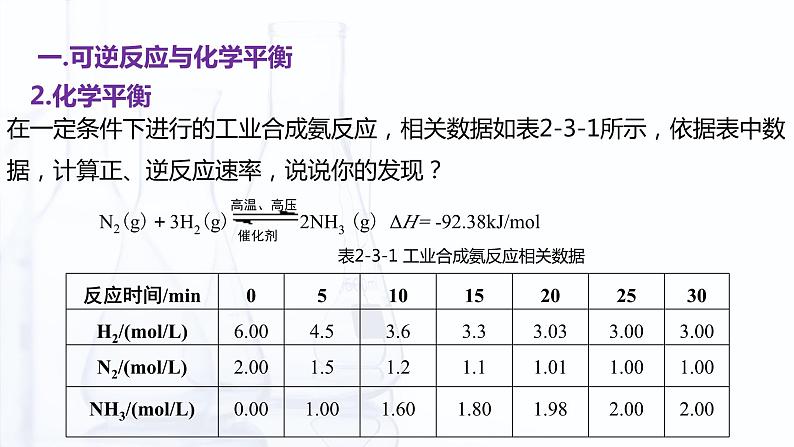
表2-3-1 工业合成氨反应相关数据
在一定条件下进行的工业合成氨反应,相关数据如表2-3-1所示,依据表中数据,计算正、逆反应速率,说说你的发现?
刚开始反应时,正向进行很快,随着时间的推移,反应物浓度减小,生成物浓度增大,正反应速率减慢,逆反应速率增大,在25min后正逆反应速率相等。
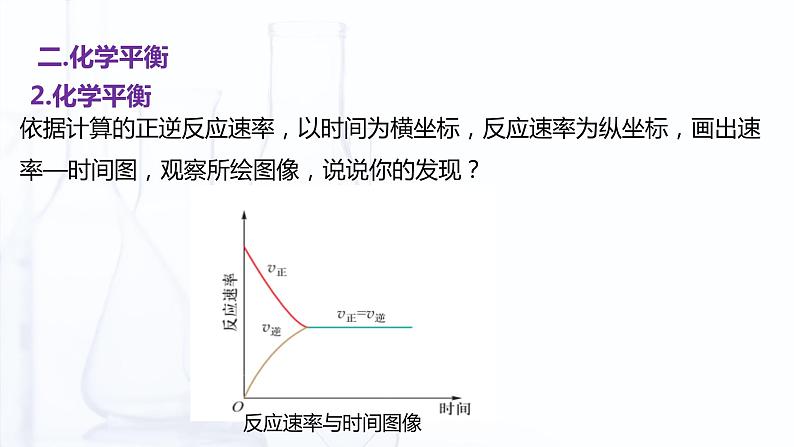
依据计算的正逆反应速率,以时间为横坐标,反应速率为纵坐标,画出速率—时间图,观察所绘图像,说说你的发现?
单位时间内正反应消耗的N2和H2的分子数恰好等于逆反应生成的N2和H2的分子数。所以反应体系中,N2、H2和NH3的浓度不再发生变化。达到化学平衡状态。
化学平衡状态具有五大特征:逆——可逆反应等——正反应速率=逆反应速率动——化学平衡是动态平衡,即v正 = v逆 ≠ 0定——可逆反应处于化学平衡状态时,混合体系中各物质浓度保持不变变——改变影响平衡的条件,平衡会被打破,并在新的条件下建立新的平衡
化学平衡只是可逆反应在一定条件下的一种暂时的、相对的稳定状态。因平衡状态被破坏而建立新的平衡的过程,称为化学平衡的移动。
化学反应速率会随温度、浓度等条件的变化而发生改变,化学平衡状态又是可逆反应正逆反应速率相等时的一种暂时的、相对的稳定状态。因此,只要正逆反应速率发生变化,平衡状态一定会被破坏。那么,哪些因素会破坏平衡状态呢?当外界条件改变时,化学平衡状态又会发生怎样的改变呢(即平衡如何移动)?
实验探究1:浓度对化学平衡的影响
在3支试管中各加入2 mL蒸馏水,然后分别加入3滴0.1 ml/L FeCl3溶液和3滴0.1 ml/L KSCN溶液得到红色溶液。
表2-3-2 红色深浅变化记录表
试管1和2中颜色加深,说明化学平衡正向移动。增大浓度,化学反应平衡发生了移动。
在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。
实验探究2:温度对化学平衡的影响
表2-3-3 气体颜色变化记录表
热水中平衡球中气体颜色加深,说明化学平衡正向移动;冰水中平衡球中气体颜色变浅,说明化学平衡逆向移动。改变温度,化学反应平衡发生了移动。
在其他条件不变的情况下,升高温度,化学平衡向吸热反应的方向移动;降低温度,化学平衡向放热反应的方向移动。
实验探究3:压强对化学平衡的影响
增大压强,体系颜色先变深后变浅,说明化学平衡正向移动。
在其他条件不变的情况下,对于有气体参加的反应,增大压强,化学平衡向气体体积缩小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
对于有气体参与的可逆反应,改变压强是否一定会导致化学平衡的移动?请以小组为单位,以氢气与碘蒸气作用生成碘化氢(H2(g) + I2(g) 2HI(g))为例进行讨论。
如果改变影响平衡的一个条件(如温度、压强,以及参加反应的化学物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是著名的勒夏特列原理,又称化学平衡移动原理。
由于催化剂能够同等程度地改变正反应和逆反应的反应速率。因此,它对化学平衡的移动没有影响,但它能改变反应达到平衡所需的时间。这对于提高生产效率具有十分重要的意义。
闵恩泽——中国催化剂之父
勒夏特列原理(平衡移动原理)
1.下列关于化学反应速率和限度的说法中,错误的是A.化学反应限度可以通过改变某些条件而改变B.可以通过无限延长化学反应的时间来改变反应的限度C.决定化学反应速率的主要因素是反应物本身的性质D.化学反应限度决定了反应物在该条件下的最大转化率【答案】B
2.下列反应不属于可逆反应的是A.二氧化硫与水反应B.二氧化硫的催化氧化C.工业合成氨 D.铜与稀硝酸反应【答案】D
3.在可逆反应2SO2(g)+O2(g) 2SO3(g)+Q达到新平衡时,在平衡体系中充入一定量的18O2,当达到新平衡时,18O的原子应存在于A.只能存在于O2的分子中B.只能存在于SO3的分子中C.能同时存在于SO2和O2的分子中D.能同时存在于SO2、O2、SO3分子中【答案】D
4.一定温度下的恒容密闭容器中,铁和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。下列描述能说明该反应已达平衡状态的是A.v(CO2)=v(CO)B.单位时间内生成FeO的质量和生成Fe的质量相等C.容器中混合气体的压强不随时间变化而变化D.容器中混合气体的密度不随时间变化而变化【答案】D
业精一分汗禾滴,爱心一颗花万朵。
P39,1.2.3
相关课件
这是一份化学农林牧渔类第三节 纤维素优质ppt课件,共19页。PPT课件主要包含了学习目标与核心素养,主要内容,纤维素,常见的磷脂,磷脂的应用,存在方式,组成与结构,常见的蜡脂,组成及结构,纤维素与淀粉的异同等内容,欢迎下载使用。
这是一份高教版(2021)农林牧渔类第一节 油脂精品ppt课件,共19页。PPT课件主要包含了学习目标与核心素养,主要内容,油脂的组成及结构,油脂的性质,油脂在生物体内的作用,物理性质,化学性质,二化学性质,课堂小结等内容,欢迎下载使用。
这是一份中职化学第三节 化学平衡完美版ppt课件,共22页。PPT课件主要包含了学习目标与核心素养,主要内容,吸热反应和放热反应,可逆反应与不可逆反应,化学平衡,影响化学平衡的因素,放热反应,吸热反应,不可逆反应,可逆反应等内容,欢迎下载使用。










