










所属成套资源:【中职专用】高中化学(高教版2021·医药卫生类基础模块)同步课件+配套练习含解析卷
高教版(2021)医药卫生类第二节 元素周期律优秀课件ppt
展开
这是一份高教版(2021)医药卫生类第二节 元素周期律优秀课件ppt,文件包含12元素周期律课件中职专用高中化学高教版2021医药卫生类pptx、12元素周期律练习中职专用高中化学高教版2021医药卫生类原卷版docx、12元素周期律练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
主题一 原子结构与化学键 1.2 元素周期律
1.认识元素性质呈周期性变化的规律及其变化的根本原因;2.了解元素周期表的结构和元素在元素周期表中的位置。3.了解同周期和同主族元素性质的递变规律,认识元素周期律(表)在学习元素、化合物及科学研究中的重要作用。
1.观看图片,想一想构成氯化钠、铜和水的基本微粒是什么?构成物质的微粒有哪些?氯化钠由氯离子和钠离子构成,铜由铜原子构成,水由水分子构成;构成物质的微粒有离子、原子、分子。2.这三种微粒之间有何联系?分子由原子构成,离子由原子得失电子形成。【总结】原子是构成物质的基本微粒。
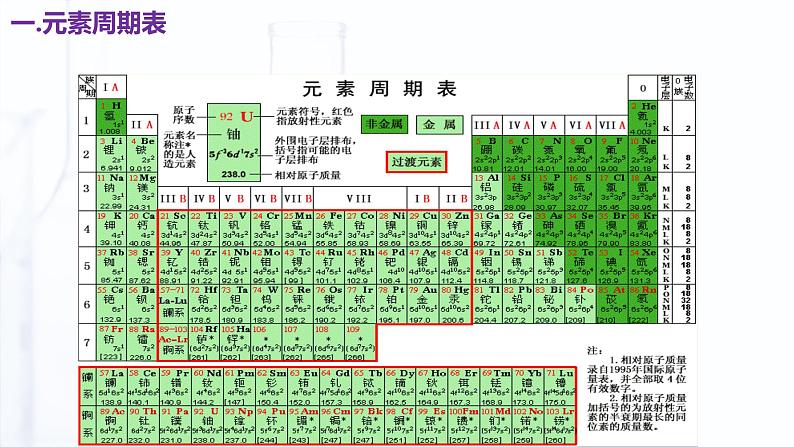
2019年,恰逢国际纯粹与应用化学联合会(IUPAC)成立100周年,也是门捷列夫发现元素周期律150周年,联合国教科文组织将这一年命名为"化学元素周期表国际年"。为了庆祝这场化学盛事,一张别具特色的元素周期表——"青年化学家元素周期表"应运而生。
原子序数与元素的原子结构之间存在什么关系?
原子序数=质子数=核电荷数=核外电子数
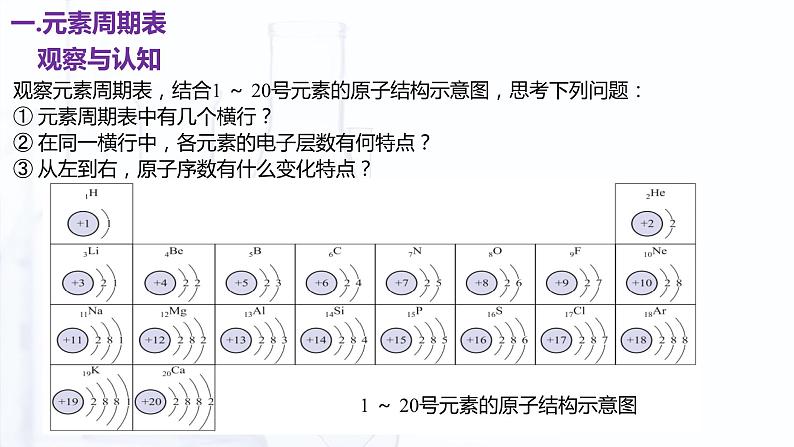
观察元素周期表,结合1 ~ 20号元素的原子结构示意图,思考下列问题:① 元素周期表中有几个横行?② 在同一横行中,各元素的电子层数有何特点?③ 从左到右,原子序数有什么变化特点?
③ 从左到右,原子序数依次递增。
① 元素周期表中有七个横行——周期。
② 在同一横行中,各元素的电子层数相同。
1、2、3周期为短周期4、5、6、7周期为长周期。
元素的周期序数 = 元素原子的电子层数
观察元素周期表,结合1 ~ 20号元素的原子结构示意图,思考下列问题:①元素周期表中有几个纵行?②在同一纵行中,最外层的电子数有何特点?③由上而下,电子层数有什么变化特点?
元素周期表中共有 18 个纵列,16 个族。分为主族(记作A族)、副族(记作B族)、Ⅷ族(包括第8、9、10三个纵列)和0族(稀有气体元素)。
①元素周期表中有18个纵行——族。
②在同一纵行中,最外层电子数相同。
③由上而下,电子层数依次递增。
1.周期:元素周期表共有七个横行,每一横行称为一个周期, 故元素周期表共有七个周期①周期序数与电子层数的关系:周期序数=核外电子层数 ②周期的分类 元素周期表中,我们把1、2、3周期称为短周期, 4、5、6、7 周期称为长周期。③周期数== 核外电子层数 ; 各周期元素从左向右都是原子序数依次递增;
2.族:元素周期表共有18个纵行,除了8、9、10三个纵行称为Ⅷ外,其余的每一个纵行称为一个族,故元素周期表共有16个族。①族的分类 元素周期表中,我们把18个纵行共分为16个族,其中7个主族,7个副族,一个VIII族,一个0族。a.主族:由短周期元素和长周期元素共同构成的族,用A表示:ⅠA、 IIA 、 IIIA 、 IVA 、 VA 、 VIA 、VIIA b.副族:完全由长周期元素构成的族,用B表示:ⅠB、 IIB 、 IIIB 、 IVB 、 VB 、 VIB 、VIIB c.第Ⅷ族:8、9、10 三个纵行 d.零族:第18 纵行,即稀有气体元素
②主族序数与最外层电子数的关系: 主族序数=最外层电子数 各主族元素从上向下都是原子序数依次增大; ③族的别称ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素 ⅣA称为碳族元素 ⅤA称为氮族元素 ⅥA称为氧族元素 ⅦA称为卤族元素 副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
根据原子核外的电子层数及最外层的电子数,可以确定元素在元素周期表中的位置。
Ca原子四个电子层,因此在第四周期;最外层电子数为 2,因此属于ⅡA族。
分析表1-2-1(1),思考并讨论以下问题:① 从表中你可以获取那些信息?② 在同一周期,从左到右,元素的原子半径呈现什么变化?③ 在同一主族,由上而下,元素的原子半径呈现什么变化?
随着元素原子序数的递增,元素的原子半径呈现周期性变化。
①通过比较同一周期元素原子的半径,可以看出电子层数相同的原子,最外层电子数目越多,原子半径越小。
②通过比较同一主族元素原子的半径,可以看出最外层电子排布相同的原子,电子层数越多,原子半径越大。
分析表1-2-1(2),思考并讨论以下问题:①从表中你可以获取那些信息?②在同一周期,从左到右,元素的原子主要化合价呈现什么变化?
① 元素的主要化合价有最高正化合价和最低负化合价。② 从各元素主要化合价的数据来看,从3Li到9F,再从11Na到17Cl,元素的最高正化合价均从+1价依次递变到+7价(氧、氟例外),非金属元素的最低负化合价均从-4价依次递变到-1价。
①最高正化合价 = 原子最外层电子数 = 主族的族序数
②最低负化合价 = 原子最外层电子数- 8
分析表1-2-1(3),思考并讨论以下问题:①从表中你可以获取那些信息?②在同一周期,从左到右,元素的金属性和非金属性呈现什么变化?
从元素主要化学性质的数据来看,从3Li到9F,再从11Na到17Cl,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。
三.元素周期表中元素性质的递变规律
钠、镁、铝的性质比较:
硅、磷、硫、氯的性质比较
同一周期元素从左到右,随着原子序数的递增,原子半径减小,原子核对电子的吸引力增大,得到电子的能力增强,则元素的金属性逐渐减弱,非金属性逐渐增强。
同一周期金属元素的最高价氧化物的水化物的碱性逐渐减弱;同一周期非金属元素的最高价氧化物的水化物的酸性逐渐增强。
同周期中主族元素性质的递变规律
观察表1-2-6列出的碱金属(第ⅠA)元素的性质,思考并讨论:(1)从表中可以获取哪些信息?(2)对于同一主族的金属元素,随着原子序数的递增,金属性有何变化?
表1-2-6 碱金属元素性质的比较
同主族元素性质的递变规律
阶梯线左下方均为金属元素
阶梯线右上方均为非金属元素
阶梯线附近为既表现出某些金属性又表现出某些非金属性的两性元素
1.某元素原子的结构示意图如下,下列关于该元素的说法不正确的是A.元素符号是KB.属于金属元素C.在化学反应中易失电子D.位于元素周期表第四周期第ⅡA族【答案】D
2.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,下列有关元素周期表说法正确的是A.元素周期表中从ⅢB族到ⅡB族10列的元素都属于副族元素B.对过渡元素的研究,有助于制造出新品种的农药C.主族元素的最高正化合价等于它所处的主族序数D.最外层电子数为2的原子都位于ⅡA族【答案】A
3.下列关于同主族元素性质的说法中正确的是A.IA族元素被称为碱金属元素B.VA族元素的最高化合价一定是+6价C.IVA族元素的最高化合价都是+4价D.VIIA族元素的最高化合价都是+7价,且最低负价都是−1价【答案】C
4.元素性质呈现周期性变化规律的根本原因是A.核电荷数依次增大B.元素的相对原子质量逐渐增大C.元素化合价呈周期性变化D.元素原子核外电子排布呈现周期性变化【答案】D
5.下列关原子结构、元素周期律及元素周期表的叙述正确的是A.多电子原子中,在离核较近的区域内运动的电子能量低B.所有主族元素原子的最外层电子数都等于元素的最高正化合价C.元素周期表中位于金属和非金属分界线附近元素属于过渡元素D.元素周期律体现了元素性质随着原子相对原子质量的递增而呈现周期性变化【答案】A
6.不能说明金属性 的是A.碱性 B.相对原子质量 C.阳离子的氧化性 D. 与冷水剧烈反应 与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈【答案】B
业精一分汗禾滴,爱心一颗花万朵。
P17,1.2
相关课件
这是一份化学农林牧渔类第三节 纤维素优质ppt课件,共19页。PPT课件主要包含了学习目标与核心素养,主要内容,纤维素,常见的磷脂,磷脂的应用,存在方式,组成与结构,常见的蜡脂,组成及结构,纤维素与淀粉的异同等内容,欢迎下载使用。
这是一份高教版(2021)农林牧渔类第一节 油脂精品ppt课件,共19页。PPT课件主要包含了学习目标与核心素养,主要内容,油脂的组成及结构,油脂的性质,油脂在生物体内的作用,物理性质,化学性质,二化学性质,课堂小结等内容,欢迎下载使用。
这是一份中职化学高教版(2021)农林牧渔类第二节 元素周期律优质课ppt课件,共24页。PPT课件主要包含了学习目标,归纳总结,短周期长周期,二三周期,五六七周期,三短四长,七主七副三八一零等内容,欢迎下载使用。









