








- 主题三 学生实验一 实验二 实验三(课件)【中职专用】高中化学(高教版2021加工制造类) 课件 1 次下载
- 主题四 第一节 常见非金属单质及其化合物【中职专用】高中化学(高教版2021加工制造类) 课件+同步练习含解析卷 课件 1 次下载
- 主题五 第一节 有机化合物的特点和分类【中职专用】高中化学(高教版2021加工制造类) 课件+同步练习含解析卷 课件 1 次下载
- 主题五 第二节 最基础的一类有机化合物——烃【中职专用】高中化学(高教版2021加工制造类) 课件+同步练习含解析卷 课件 1 次下载
- 主题五 第三节 烃的衍生物【中职专用】高中化学(高教版2021加工制造类) 课件+同步练习含解析卷 课件 1 次下载
中职化学高教版(2021)加工制造类基础模块主题四 常见无机物及其应用第二节 常见金属单质及其化合物完美版课件ppt
展开1.能从原子的结构和组成出发,初步
【学习目标】1.通过原子的微观层面分析常见金属(Na、Al、Fe)的金属性及其重要化合物的物理性质;金属(Na、Al、Fe)的结构,认识常见金属及其化合物的化学性质; 2.认识焰色反应,知道铁离子的检验方法; 3.知道常见金属在生产生活、材料制备中的应用以及对环境的影响,培养环保意识,强化可持续发展的理念
【核心素养】1.通过实验观察与分析,培养学生实验探究与创新意识等化学学科核心素养; 2.通过从金属元素微观角度分析元素化学性质,培养学生宏观辨识与微观辨析、现象观察与规律认知等化学学科核心素养
无论是2018年发射成功的嫦娥四号探测器(图4-2-1),还是2019年开通的北京大兴国际机场(图4-2-2),都离不开金属材料的重要贡献。不同功能的金属材料所需的轧制、锻造、挤压、热处理等加工工艺也不尽相同。
图 4-1-18嫦娥四号探测器
图 4-2-2 北京大兴国际机场
几种重要的非金属化合物
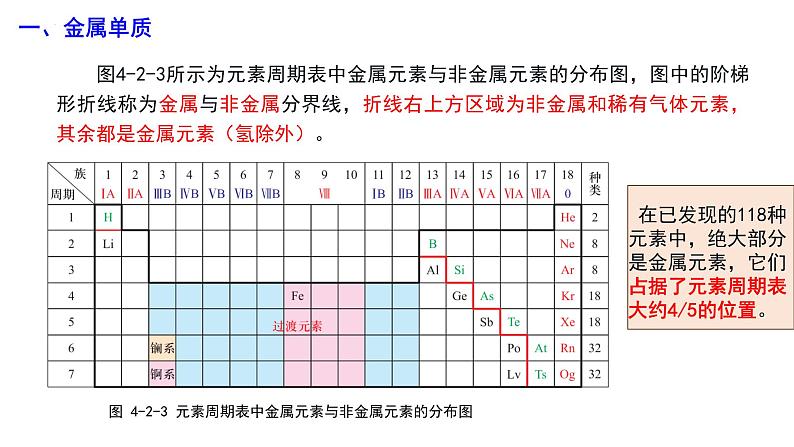
图4-2-3所示为元素周期表中金属元素与非金属元素的分布图,图中的阶梯形折线称为金属与非金属分界线,折线右上方区域为非金属和稀有气体元素,其余都是金属元素(氢除外)。
图 4-2-3 元素周期表中金属元素与非金属元素的分布图
在已发现的118种元素中,绝大部分是金属元素,它们占据了元素周期表大约4/5的位置。
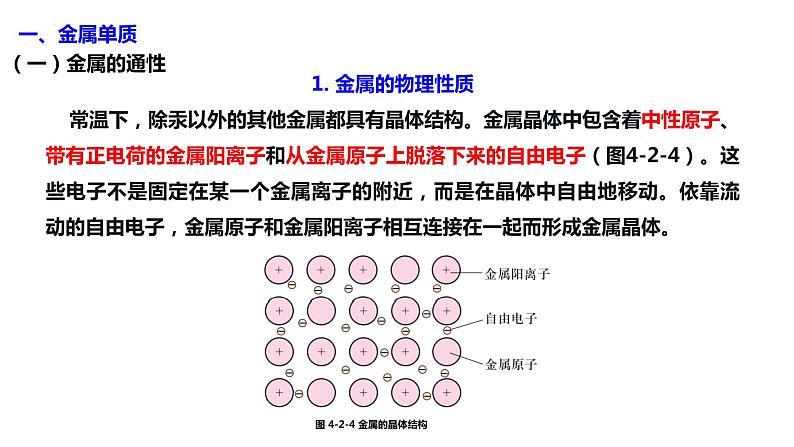
1. 金属的物理性质 常温下,除汞以外的其他金属都具有晶体结构。金属晶体中包含着中性原子、带有正电荷的金属阳离子和从金属原子上脱落下来的自由电子(图4-2-4)。这些电子不是固定在某一个金属离子的附近,而是在晶体中自由地移动。依靠流动的自由电子,金属原子和金属阳离子相互连接在一起而形成金属晶体。
图 4-2-4 金属的晶体结构
(2)金属的延展性 一般来说,金属具有不同程度的延展性,可以抽成细丝,最细的铂丝直径不超过0.2 μm;可以压成薄片,最薄的金箔只有0.1 μm厚。
金属晶体的特殊结构,决定了金属具有共同的物理性质,主要表现为:
(1)金属的颜色和光泽 大多数金属呈银白色,少数金属呈其他颜色(如金)。
(4)金属的密度、硬度和熔点 大多数金属的密度、硬度较大,熔点较高,但差别也较大。
(3)金属的导电性和导热性 大多数金属具有良好的导电性和导热性。导电性好的金属,导热性也好。
铜和铝也是很好的导热材料,广泛用于热交换器、散热材料及日用炊具等领域。
2. 金属的化学性质 图4-2-5所示为元素钠、镁、铝的原子结构示意图,运用学过的原子结构知识,从核外电子排布的角度出发,推测它们在化学反应中的电子得失情况、化学键形成及基本化学性质。
图 4-2-5 原子结构示意图
2. 金属的化学性质 金属最主要的化学共性是易失去最外层的电子,变成金属阳离子而表现出还原性。例如,金属可以与非金属反应、与氧反应、与酸反应等。
由于金属失去电子的难易程度不同,所以各种金属还原性的强弱也不同,化学活泼性强弱的差别也较大。
图4-2-6所示为金属钠及其保存方法,观察图片,说说你的发现。
(二)碱金属元素的代表——钠
钠是电和热的良导体,熔点沸点低,质地软,密度为0.97 g/cm3,是具有银白色光泽的轻金属。钠可作为还原剂,用于稀有金属的冶炼。钠广泛应用于电光源上。钠原子最外电子层上只有1个电子,在化学反应中很容易失去该电子,化学性质非常活泼。
图 4-2-6 金属钠及其保存方法
(1)实验 ① 用镊子取一小块金属钠,用滤纸吸干表面的煤油,然后用刀切开,观察刚切开及稍放置后断面的颜色和光泽。 ② 用镊子取一小块金属钠,用滤纸吸干表面的煤油,置于坩埚中(图 4-2-7),加热,观察现象。
图 4-2-7 金属钠与氧气的反应
③ 在盛有水的烧杯中,滴入几滴酚酞溶液,用镊子取一绿豆大小的金属钠放入水中,如图4-2-8所示。观察反应现象。
图 4-2-8 钠与水的反应
② 钠的密度比水小,能与水发生剧烈的反应,反应时放出热量,放出的热量使钠块熔成小球;反应后得到的溶液呈碱性;钠与水反应有气体生成,经检验为H2。
① 常温下,钠能与空气中的氧气化合生成氧化钠(Na2O),致使光亮的金属断面很快变暗。钠受热后,也能与氧气发生剧烈反应,发出黄色火焰,生成一种淡黄色固体。
(三)地壳中含量最多的金属元素——铝
图 4-2-9 日常生活中常见的铝制品
铝具有较强的还原性,在化学反应中常用作还原剂。
铝在自然界分布较广,在地壳中含量仅次于氧和硅。铝有良好的导电性、导热性和延展性,广泛用于电线、食品包装袋、饮具和太阳能热水器等的制造。铝还能跟许多元素形成合金,因铝合金质轻而坚韧,它们在汽车、飞机、火箭等制造业以及日常生活中具有广泛的用途。
(1)铝与氧气的反应 在常温下,铝能够与空气中的氧气反应,生成一层致密而坚固的氧化铝薄膜,这层薄膜能够阻止内部的铝不再继续氧化,因此铝制品具有一定的抗腐蚀能力,可以保存在空气中。但在点燃条件下,铝在氧气中能剧烈燃烧,发出耀眼的白光,并冒白烟。
(2)铝与金属氧化物的反应 铝不但能跟空气中的氧气发生反应,而且还能夺取某些金属氧化物中的氧,并放出大量的热。
工业上常用铝热法冶炼难熔的金属、焊接钢轨等。
用铝从金属氧化物中置换出金属单质的方法
(3)铝与酸和碱的反应 在两支试管中分别加入5 mL 2 ml/L HCl溶液、2 ml/L NaOH 溶液,再分别放入一小段铝片,观察现象;过一段时间后,将燃着的火柴分别放在两支试管口,观察现象并完成表4-2-1。思考金属铝具有的性质。
表 4-2-1 现象记录
铝既能与酸反应,又能与碱作用,具有两性性质。
从实验可以看出,反应都放出了一种可燃性气体——氢气,铝也都生成了+3价铝的化合物。化学方程式为:
铝热反应是指铝与某些金属氧化物发生的氧化还原反应。 铝热反应发生时,放出的大量热使金属熔化并流出,广泛用于冶炼难熔金属、焊接方面。
(四)使用最多的基础金属材料——铁
1.铁的物理性质 铁具有良好的导电性、导热性和延展性,密度为7.86 g/cm3,熔点为1535 ℃;能被磁铁吸引,具有铁磁性。
图 4-2-12 日常生活中常见的铁制品
2.铁的化学性质 铁与氧气、酸和盐溶液的反应。常温下铁与水不发生反应,但红热的铁能跟水蒸气发生反应生成四氧化三铁(Fe3O4)和氢气。
在潮湿空气中,铁在H2O、O2和CO2等的共同作用下,易发生腐蚀而生锈,铁锈的主要成分是Fe2O3·nH2O。
二、几种重要的金属化合物
1. 氧化钠与过氧化钠 图4-2-15所示为Na2O和Na2O2的电子式,分析它们的形成、差异,并推测它们的化学性质。
图 4-2-15 Na2O和Na2O2的电子式
1. 氧化钠与过氧化钠
钠的氧化物有Na2O和Na2O2。Na2O是碱性氧化物,与水反应得到氢氧化物,与酸性氧化物反应得到盐。反应的化学方程式为:
Na2O2与水反应得到氢氧化钠和过氧化氢(H2O2),与CO2反应得到碳酸钠和氧气。反应的化学方程式为:
Na2O2与水反应生成的H2O2不稳定,迅速分解产生氧气。反应的化学方程式为:
Na2O2常用作氧化剂、漂白剂、氧气发生剂,还可用作防毒面具的填料,作为高空飞行及潜水作业时的供氧剂及CO2吸收剂。
在上述第一个反应中,Al2O3表现出碱性氧化物的性质;在第二个反应中,Al2O3则表现出酸性氧化物的性质。因此,Al2O3是两性氧化物。
氧化铝(Al2O3)是白色粉末,熔点为2050 ℃,是一种比较好的耐火材料,在功能陶瓷、半导体照明等领域也有重要应用。Al2O3不溶于水,但新制的Al2O3能与酸或碱反应,都生成盐和水。
3. 铁的氧化物 (氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4)等。)
FeO是一种黑色粉末,不稳定,在空气中加热即被氧化成Fe3O4。
Fe2O3是一种红棕色粉末,俗称铁红,可用作油漆的颜料等。
Fe3O4是具有磁性的黑色粉末,俗称磁性氧化铁。
铁的氧化物都不溶于水,也不能跟水发生反应。但FeO和Fe2O3都能跟酸发生反应,分别生成亚铁盐和铁盐。
在实验室里,常常会发现,NaOH试液久置后会发生如图4-2-16所示的变化,用化学知识解释其原因。
图 4-2-16 NaOH溶液久置后的变化
1. 氢氧化钠 NaOH(烧碱、苛性碱)是强碱,具有强腐蚀性,对皮肤、纤维、陶瓷,甚至金属铂都有腐蚀作用。NaOH固体或浓溶液一般使用塑料容器存放,而不能用玻璃容器存放。
硅酸钠具有黏性,可将玻璃瓶塞与瓶口粘在一起。如果临时存放NaOH的稀溶液可以使用配有胶塞的玻璃瓶,但不能使用玻璃塞。
保存NaOH固体时应该密封,以免吸收空气中的H2O和CO2。市售NaOH难免会含有Na2CO3。当需要配制不含Na2CO3杂质的NaOH溶液时,可先制备NaOH饱和溶液,密闭静置,使Na2CO3沉淀析出,然后取上层清液,用煮沸后冷却的新鲜蒸馏水稀释至所需浓度。
2. 氢氧化铝 ①向盛有10 mL 0.5 ml/L Al2(SO4)3溶液的试管中,逐滴加入氨水至过量,观察现象并完成表4-2-2。
②将上述反应所得沉淀Al(OH)3分装在2支试管中,在1支试管中滴加2 ml/L HCl溶液,在另1支试管中滴加2 ml/L NaOH溶液,振荡,观察现象并完成表4-2-3。
Al(OH) 3在酸或强碱溶液中都能溶解,这说明它既能与酸发生反应,又能与强碱发生反应,因此,Al(OH) 3是两性氢氧化物。
表 4-2-2 现象记录
表 4-2-3 现象记录
反应中生成不溶于过量氨水的白色胶体沉淀——Al(OH)3:
Al(OH)₃+3HCl = AlCl₃+3H₂O
Fe(OH)3受热不稳定,易失水生成红棕色的Fe2O3粉末:
3. 铁的氢氧化物 铁有两种氢氧化物,即氢氧化亚铁[Fe(OH)2]和氢氧化铁[Fe(OH)3]。
Fe(OH)2在空气中不稳定,能被空气中的氧气氧化生成红褐色的Fe(OH)3:
(三)碳酸钠和碳酸氢钠
碳酸钠(Na2CO3)俗称纯碱或苏打,是白色粉末;碳酸氢钠(NaHCO3)俗称小苏打,是细小的白色晶体。Na2CO3比NaHCO3更易溶于水,它们的水溶液都因水解而呈碱性。Na2CO3和NaHCO3都能与HCl溶液反应放出CO2。NaHCO3与HCl溶液的反应比Na2CO3与HCl溶液的反应剧烈。
Na2CO3很稳定,而NaHCO3不稳定,受热易分解。
该反应可区分Na2CO3和NaHCO3。
Na2CO3是重要的化工产品,广泛用于玻璃、搪瓷的制造和炼钢、炼铝及其他有色金属的冶炼。在临床医疗领域。
NaHCO3常用作抗酸药。在食品工业领域,NaHCO3是发酵粉的主要成分之一。
1926年,“红三角牌”纯碱在世界万国博览会上夺得金质奖章,这是创新性制碱工艺——侯氏联合制碱法历时五年开出的灿烂之花,更是中国制碱业打破垄断、自立自强的标志。请以小组为单位,上网查阅资料,了解我国重化学工业的开拓者、近代化学工业的奠基人侯德榜(1890—1974,图4-2-17)为祖国制碱工业冲破封锁而努力奋斗、勇于创新的事迹,探究我国自己的碱厂从无到有、从有到优的意义。并撰写一篇演讲稿在班级进行交流。
图 4-2-17 我国科学家侯德榜
铁的盐类有铁盐(即三价铁盐)和亚铁盐(即二价铁盐)两种,常见的有氯化铁和硫酸亚铁。
1.氯化铁 氯化铁(FeCl3)是黑棕色固体,常以水合物(FeCl3·6H2O)形式存在,吸湿性很强,易溶于水,在水溶液中易水解生成氢氧化铁沉淀:
FeCl3具有氧化性,遇较强的还原剂会被还原成亚铁盐;后者在较强氧化剂的作用下,又被氧化成铁盐。
2.硫酸亚铁 含有7分子结晶水的硫酸亚铁晶体(FeSO4·7H2O)俗称绿矾,是淡绿色晶体,易溶于水。在潮湿的空气中能逐渐被氧化而变成红褐色的碱式硫酸铁。因此,绿矾需保存在密闭容器中。
绿矾在农业上用作杀菌剂,可防治小麦黑穗病和条纹病等;它也是一种微量元素肥料,植物缺铁时叶子发黄,可施用绿矾;在医药上,作内服药用于治疗缺铁性贫血;在工业上,用于制造蓝黑墨水和媒染剂,也可用于木材防腐。
电子产品加工中,常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印制电路板。工程师常需要从使用过的腐蚀废液中回收铜、铁。以小组为单位,通过采访专业技术人员、发放问卷调查表、上网查阅资料或到当地电子产品加工企业调研,了解相关铁、铜等常见金属的回收利用状况,结合所学化学知识,从节约资源和保护环境等角度提出建议意见,并将调研结果写成调查报告,以演示文稿形式在班内进行交流、展评。
三、重要金属离子的检验
每逢重要节日或重大庆祝活动时,人们常会燃放焰火营造气氛和表达内心的欢乐。焰火在我国始于唐,盛于宋,是在中国四大发明之一 ——火药的基础上衍生出来的一项技术。如图所示为2008年北京奥运会焰火秀。
几种金属或金属离子焰色反应的颜色,如图4-2-19所示。利用焰色反应所呈现的特殊颜色,可以检验金属或金属离子的存在。
图 4-2-19 几种金属或金属离子焰色反应的颜色
钠燃烧时,会观察到火焰呈黄色。
很多金属及其化合物在被灼烧时,都会使火焰呈现特殊的颜色
将固定在玻璃棒上的铂丝用稀盐酸洗涤后,放在酒精灯火焰上灼烧,直至与原来的火焰颜色相同时为止。 用铂丝蘸取Na2CO3溶液后放到酒精灯火焰上灼烧,观察火焰颜色。 把铂丝洗净,同法灼烧至没有颜色时,再蘸取KCl溶液,放到酒精灯火焰上灼烧,隔着蓝色钴玻璃观察火焰颜色。比较实验现象并完成表4-2-4。
表 4-2-4 现象记录
在2支试管中分别加入2 mL FeCl3溶液和2 mL FeSO4溶液,再各滴入几滴硫氰化钾(KSCN)溶液,观察现象并完成表4-2-5。
表 4-2-5 现象记录
氯化铁、硫酸铁等含有Fe3+ 的溶液,遇到KSCN溶液会发生反应,反应方程式为:
通常,利用这一反应可以检验Fe3+的存在。
1.现有物质A、B、C、D,其中A为单质,B、C、D均为含有A元素的化合物。将A长期置于空气中可得C,放入水中可得B,向B或C中加入盐酸均可得D。试推断A、B、C、D各是什么物质,写出有关反应的化学方程式。 2.用含有Ag+、Al3+、Ca2+、Na+四种阳离子的溶液做下列实验: (1)往上述溶液中,加入稀盐酸,可生成 色的 沉淀; (2)将沉淀过滤,在溶液中加入氨水,使溶液呈碱性,又出现 色沉淀,该沉淀是 ; (3)再过滤,往沉淀上滴加氢氧化钠溶液直至过量,这时沉淀; 往溶液中滴入碳酸钠溶液,出现 色沉淀,该沉淀是 。写出有关反应的化学方程式。
3.工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如下(图4-2-21):试回答下列问题: (1)实验室进行过滤用到的玻璃仪器有烧杯、 、 ; (2)操作Ⅱ中生成不溶物C的离子方程式是 。
图 4-2-21 铝土矿冶炼铝
常见的金属单质及其化合物
中职化学高教版(2021)医药卫生类第二节 常见金属单质及其化合物一等奖课件ppt: 这是一份中职化学高教版(2021)医药卫生类<a href="/hx/tb_c4035058_t3/?tag_id=26" target="_blank">第二节 常见金属单质及其化合物一等奖课件ppt</a>,文件包含42常见金属单质及其化合物课件中职专用高中化学高教版2021医药卫生类pptx、42常见金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类原卷版docx、42常见金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
中职化学高教版(2021)医药卫生类第一节 常见非金属单质及其化合物公开课ppt课件: 这是一份中职化学高教版(2021)医药卫生类<a href="/hx/tb_c4035057_t3/?tag_id=26" target="_blank">第一节 常见非金属单质及其化合物公开课ppt课件</a>,文件包含41常见非金属单质及其化合物课件中职专用高中化学高教版2021医药卫生类pptx、41常见非金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类原卷版docx、41常见非金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
高教版(2021)农林牧渔类第二节 常见金属单质及其化合物公开课ppt课件: 这是一份高教版(2021)农林牧渔类第二节 常见金属单质及其化合物公开课ppt课件,共38页。PPT课件主要包含了学习目标与核心素养,主要内容,碳酸钠的应用,课堂小结等内容,欢迎下载使用。












