










加工制造类第二节 元素周期律优秀课件ppt
展开展现在我们面前的浩瀚宇庙是一个色彩斑期、千变万化的宏观世界,它由成千上万种物质构成。如此丰富多彩、数量庞大、种类繁多的物质却仅由100多种元素的原子通过不同的结合方式和不同的组合构成,物质在不同条件下表现出来的各种性质,都与它们的微观结构和化学组成有关。
为了从本质上认识和了解微观世界,认识物质的性质及其变化规律,本主题将从原子结构出发,进一步学习原子组成,元素周期律和元素周期表的基本知识,认识元素性质与原子结构之间的关系,并以此为基础,进一步研究原子在形成分子时的相互作用——化学键的有关知识。
1.能从原子的结构和组成出发,初步
【学习目标】 能认识元素性质呈周期性变化的规律及其变化的根本原因,了解元素周期表的结构和元素在周期表中的位置。
【核心素养】 能通过实验探究、了解同周期和同主族元素性质的递变规律,初步形成解释、发现、分析、推理、总结等实验方法及应用能力。能通过元素周期律发现的过程,了解科学家事迹,学习他们探索未知、崇尚真理、严谨求实的科学精神。
中华民族有着悠久的历史和璀璨的文明,在公元前一千多年,已经掌握了先进的冶炼、铸造、烧制等技术。今天的博物馆里,许多精美的陶瓷器m、青铜制品等珍贵文物(图1-1-1),向人们讲述过往的辉煌。确定文物年代是文物研究中不可缺少的内容,常采用1℃断代法。"C与作为原子量标准的"℃都是碳原子,你知道两者在组成上有哪些异同?
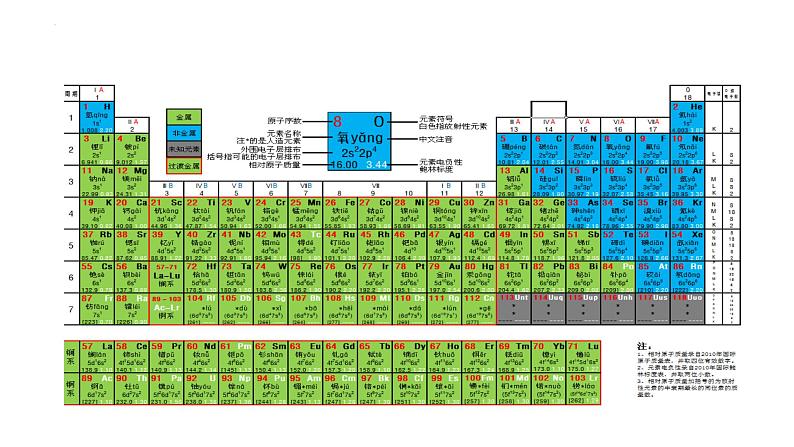
2019年是门捷列夫发表第一张元素周期表150周年,为此,联合国教科文组织将2019年命名为“化学元素周期表国际年”。现在的元素周期表,已经被正式确认发现的元素有118种。元素周期表除了可以查找元素的信息,还有哪些作用?
科学家们把元素按照核电荷数由小到大的顺序编号,这个序号称为元素的原子序数。原子序数与元素的原子结构之间存在着如下关系:
原子序数=核电荷数=核内质子数=核外电子数
把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行;把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列,就得到书后插页所示的元素周期表。
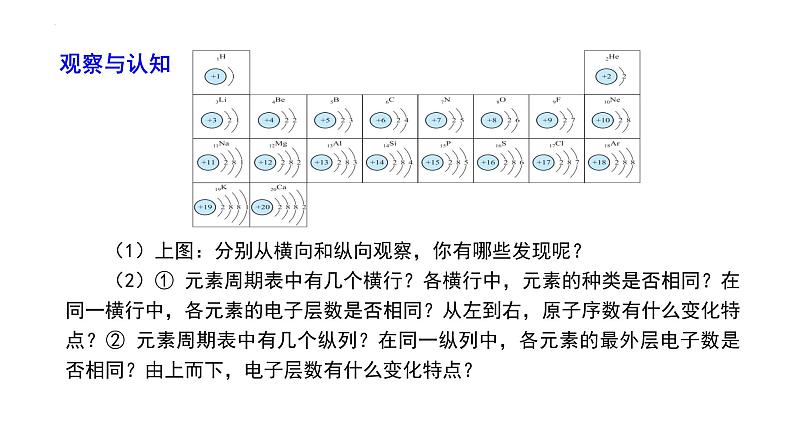
(1)上图:分别从横向和纵向观察,你有哪些发现呢? (2)① 元素周期表中有几个横行?各横行中,元素的种类是否相同?在同一横行中,各元素的电子层数是否相同?从左到右,原子序数有什么变化特点?② 元素周期表中有几个纵列?在同一纵列中,各元素的最外层电子数是否相同?由上而下,电子层数有什么变化特点?
元素周期表的横行称为周期。
H~He 2 1
Li~Ne 8 2
Na~Ar 8 3
18 4
18 5
32 6
32 7
为了避免元素周期表的横行过长,将元素周期表中的镧系元素(57La~71Lu)和锕系元素(71Ac~103Lr)分别列于元素周期表的下方。
元素周期表的纵列称为族。从左到右共18个纵列,除第8、9、10三个纵列为一族外,其余每个纵列称为一族,共有16个族。族可分为主族、副族、Ⅷ族和0族。
(第___________列,由短周期和长周期共同构成)
(第_____________列,完全由长周期元素构成)
(第__________列)
(第___列)稀有气体元素族
包括:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
包括:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
主族 A 副族 B Ⅷ 族0 族
查阅资料,了解门捷列夫、梅耶的生平和贡献。从门捷列夫当年在元素周期表上给未发现元素预留位置、预言新元素,到来自不同国家的三位科学家分别发现“镓”“钪”和“锗”的故事,结合118号元素的介绍,体会元素周期表对新元素发现的指导作用。以小组为单位在班级交流。
随着科学技术的发展,人们发现的元素种类也在不断地增加,在众多的元素中是否存在着内在联系或某种规律呢?
观察图1-2-1、表1-2-1,思考下列问题: (1)在同一周期,从左到右,随着原子序数的递增,原子的核外电子排布呈现什么变化?元素的原子半径呈现什么变化?元素的主要化合价(最高正化合价和最低负化合价)呈现什么变化? (2)在同一主族,由上而下,元素的原子半径呈现什么变化?
表 1-2-1 1~18 号元素原子核外电子排布与主要元素性质
表 1-2-1 1~18 号元素原子核外电子排布与主要元素性质(续表)
可以看出,元素原子的核外电子排布、原子半径和主要化合价等元素的性质都与原子序数的递增有密切关系。
图 1-2-2 主族元素原子半径的周期性变化示意图
随着元素原子序数的递增,元素的原子半径呈周期性变化。主族元素原子半径周期性变化如图1-2-2所示。
1. 原子半径表现出周期性变化
1、一般而言,电子层数越多,半径越大;
2、当电子层数相同时,质子数越大,半径越小;
3、粒子得电子后半径增大,失电子后半径减小。
附:粒子半径大小比较一般规律
如:同主族从上到下原子半径逐渐增大。
如:同周期从左到右原子半径逐渐减小。
如: Na Na+ Cl— Cl Fe 2+ Fe3+
2. 元素主要化合价的周期性变化
主要化合价呈现周期性变化
3. 元素金属性和非金属性的周期性变化
原子失去电子形成阳离子的性质称为元素的金属性。
原子越容易失去电子,生成的阳离子越稳定,该元素的金属性越强。元素的非金属性是指原子得到电子形成阴离子的性质,原子越容易得到电子,生成的阴离子越稳定,该元素的非金属性越强。观察表1-2-1中元素性质的数据,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,图1-2-2 主族元素原子半径的周期性变化示意图。即随着原子序数的递增,元素的金属性和非金属性也呈现周期性的变化。
根据大量实验事实,可以归纳出一条重要规律:元素的性质随着原子序数的递增而呈周期性的变化。这个规律称为元素周期律。元素周期律揭示了原子结构和元素性质的内在联系,反映了各种化学元素之间性质的变化规律,元素周期表是元素周期律的具体表现形式。
中职化学第五节 盐的水解优质课ppt课件: 这是一份中职化学<a href="/hx/tb_c4035053_t3/?tag_id=26" target="_blank">第五节 盐的水解优质课ppt课件</a>,文件包含35盐的水解课件中职专用高中化学高教版2021医药卫生类pptx、35盐的水解练习中职专用高中化学高教版2021医药卫生类原卷版docx、35盐的水解练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
中职化学第二节 蛋白质精品ppt课件: 这是一份中职化学<a href="/hx/tb_c4035066_t3/?tag_id=26" target="_blank">第二节 蛋白质精品ppt课件</a>,文件包含62蛋白质课件中职专用高中化学高教版2021医药卫生类pptx、62蛋白质练习中职专用高中化学高教版2021医药卫生类原卷版docx、62蛋白质练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
高教版(2021)医药卫生类第一节 糖类完整版课件ppt: 这是一份高教版(2021)医药卫生类<a href="/hx/tb_c4035065_t3/?tag_id=26" target="_blank">第一节 糖类完整版课件ppt</a>,文件包含61糖类课件中职专用高中化学高教版2021医药卫生类pptx、61糖类练习中职专用高中化学高教版2021医药卫生类原卷版docx、61糖类练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。












