

所属成套资源:2024年高中化学新教材同步讲义 必修第一册 (含解析)
高中化学人教版 (2019)必修 第一册第三节 物质的量优秀第1课时综合训练题
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量优秀第1课时综合训练题,共11页。
[核心素养发展目标] 1.了解物质的量及其单位、阿伏加德罗常数、摩尔质量的含义与应用,利用物质的量将宏观物理量与微观粒子的个数联系起来,并能从宏观和微观结合的视角分析解决问题。2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
一、物质的量的单位——摩尔
1.物质的量
(1)物质的量是表示含有一定数目粒子的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔
(3)表示方法及含义
明确物质的量的规范表示
如1 ml H指1 ml氢原子,1 ml H2(氢气)指1 ml氢分子,不能说1 ml氢,指代不明确。
2.阿伏加德罗常数(NA)
特别提醒 阿伏加德罗常数的单位为ml-1。
3.物质的量、阿伏加德罗常数与粒子数之间的关系
(1)关系式:n=eq \f(N,NA)。
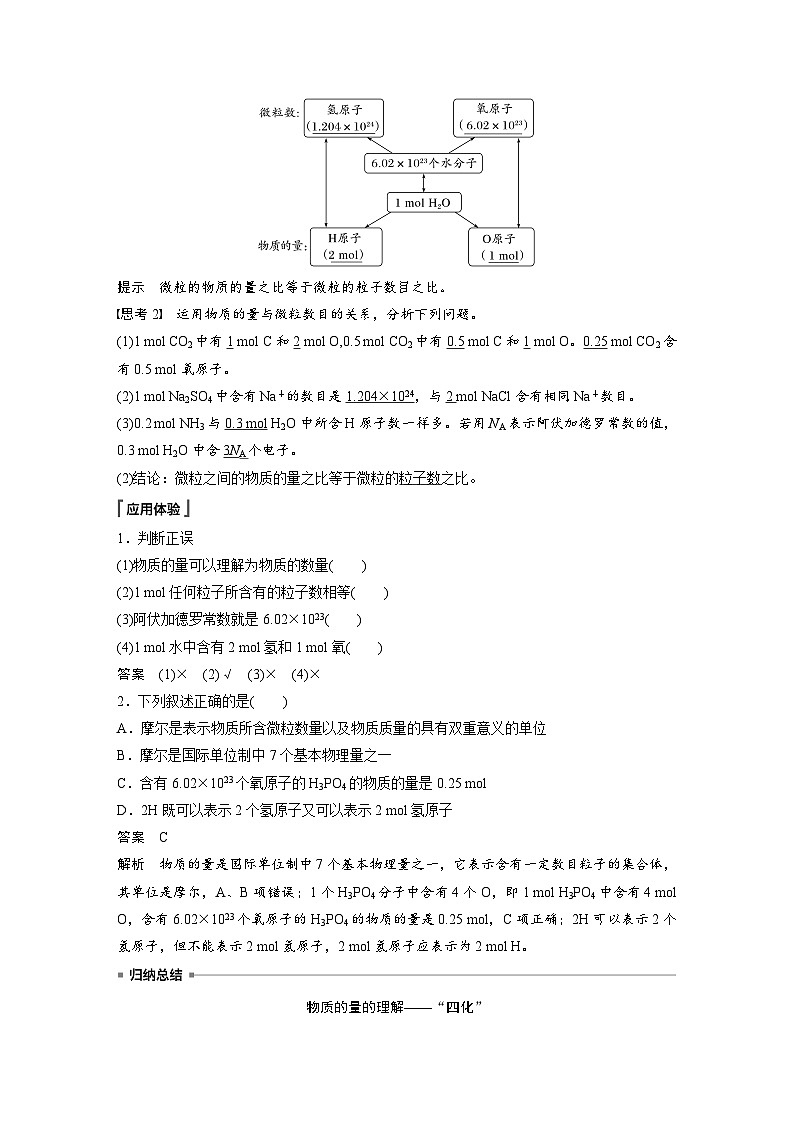
思考1 通过下图可进一步认识水的组成,并理解物质的量与微粒数目的关系?
提示 微粒的物质的量之比等于微粒的粒子数目之比。
思考2 运用物质的量与微粒数目的关系,分析下列问题。
(1)1 ml CO2中有1 ml C和2 ml O,0.5 ml CO2中有0.5 ml C和1 ml O。0.25 ml CO2含有0.5 ml氧原子。
(2)1 ml Na2SO4中含有Na+的数目是1.204×1024,与2 ml NaCl含有相同Na+数目。
(3)0.2 ml NH3与0.3 ml H2O中所含H原子数一样多。若用NA表示阿伏加德罗常数的值,0.3 ml H2O中含3NA个电子。
(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比。
1.判断正误
(1)物质的量可以理解为物质的数量( )
(2)1 ml任何粒子所含有的粒子数相等( )
(3)阿伏加德罗常数就是6.02×1023( )
(4)1 ml水中含有2 ml氢和1 ml氧( )
答案 (1)× (2)√ (3)× (4)×
2.下列叙述正确的是( )
A.摩尔是表示物质所含微粒数量以及物质质量的具有双重意义的单位
B.摩尔是国际单位制中7个基本物理量之一
C.含有6.02×1023个氧原子的H3PO4的物质的量是0.25 ml
D.2H既可以表示2个氢原子又可以表示2 ml氢原子
答案 C
解析 物质的量是国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体,其单位是摩尔,A、B项错误;1个H3PO4分子中含有4个O,即1 ml H3PO4中含有4 ml O,含有6.02×1023个氧原子的H3PO4的物质的量是0.25 ml,C项正确;2H可以表示2个氢原子,但不能表示2 ml氢原子,2 ml氢原子应表示为2 ml H。
物质的量的理解——“四化”
二、摩尔质量
1.摩尔质量
2.物质的量(n)、质量(m)和摩尔质量(M)之间的关系
n=eq \f(m,M),m=n·M。
思考1 摩尔质量与相对分子质量(或相对原子质量)是否等同,为什么?
提示 不等同,摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。当摩尔质量以“g·ml-1”为单位时,两者在数值上相等,但前者单位是g·ml-1,后者单位是1,故两者不等同。
思考2 结合下列问题,总结摩尔质量的计算方法。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为________。
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为________(用NA表示阿伏加德罗常数的值)。
(4)已知一个碳原子(12C)的质量为a g,1个某分子的质量为b g,则该分子的摩尔质量为________。
提示 (1) 17 g·ml-1 (2)64 g·ml-1
(3)bNA g·ml-1 (4)eq \f(12b,a) g·ml-1
1.判断正误
(1)氯化氢的摩尔质量是36.5 g( )
(2)氮的摩尔质量是28 g·ml-1( )
(3)CH4的摩尔质量和NA个CH4分子的质量相等( )
(4)2NA个CO2的摩尔质量为88 g·ml-1( )
(5)Fe的摩尔质量为56 g·ml-1,则1个Fe原子质量为eq \f(56,NA) g( )
答案 (1)× (2)× (3)× (4)× (5)√
2.我国科学家屠呦呦发现青蒿素,它是一种用于治疗疟疾的药物,2015年10月获得诺贝尔生理学或医学奖。下列有关青蒿素(化学式:C15H22O5)的叙述正确的是( )
A.青蒿素的摩尔质量为282
B.6.02×1023个青蒿素分子的质量约为282 g
C.1 ml青蒿素的质量为282 g·ml-1
D.282 g青蒿素中含有15个碳原子
答案 B
解析 青蒿素的摩尔质量应该为282 g·ml-1,故A错误;6.02×1023个青蒿素分子的物质的量约为1 ml,其质量约为282 g·ml-1×1 ml=282 g,故B正确、C错误;282 g青蒿素的物质的量为1 ml,1 ml青蒿素中含有15 ml碳原子,故D错误。
1.(2023·重庆合川中学高一月考)下列有关说法中正确的是( )
A.原子、电子、质子、凳子等都可用物质的量来描述
B.1 ml任何物质都含有阿伏加德罗常数个原子
C.1 ml CO2中含1 ml碳和2 ml氧
D.“物质的量”表示含有一定数目粒子的集合体,是七个基本物理量之一
答案 D
解析 凳子是宏观物质,不可用物质的量来描述,A错误;1 ml CO2中含1 ml碳原子和2 ml氧原子,C错误。
2.(2022·青岛校级月考)碳中和指控制一段时间内温室气体排放总量,实现CO2“零排放”。CO2的摩尔质量为( )
A.12 B.44 g·ml-1
C.12 g·ml-1 D.44
答案 B
解析 CO2的摩尔质量为(12+16×2)g·ml-1=44 g·ml-1。
3.下雪时,常用融雪剂清理路面。醋酸钾(CH3COOK)是常用的融雪剂,但对道路、混凝土构件、桥梁设施等有害,对植物生长也有影响,目前正在研究环保高效的融雪剂。下列关于CH3COOK的叙述正确的是( )
A.CH3COOK的相对分子质量为98 g·ml-1
B.CH3COOK的摩尔质量为98 g
C.1 ml CH3COOK含有1.806×1024个H
D.1 ml CH3COOK含有2 ml氧
答案 C
解析 CH3COOK的相对分子质量为98,故A错误;摩尔质量的单位为g·ml-1,在数值上等于该物质的相对分子质量,故B错误;CH3COOK中含3个H原子,故1 ml CH3COOK含有3 ml H原子即1.806×1024个H,故C正确;指代不明,没指明是氧原子还是氧气分子,故D错误。
4.计算填空:
(1)2 ml NO2中含________ ml氮原子,________(用NA表示阿伏加德罗常数的值,下同)个氧原子,________个质子,质量是________ g。
(2)40.5 g某金属氯化物RCl2含有0.6 ml氯离子,则金属R的摩尔质量为________。
(3)已知0.4 ml的CO和CO2的混合气体共14.4 g,则
①CO的质量为________。
②混合气体的平均摩尔质量为________。
答案 (1)2 4NA 46NA 92 (2)64 g·ml-1 (3)①5.6 g ②36 g·ml-1
题组一 物质的量及其单位
1.下列对摩尔(ml)的有关说法不正确的是( )
A.摩尔是一个单位而非物理量
B.氧气的摩尔质量就是其相对分子质量
C.物质的量是连接宏观量和微观量的桥梁
D.0.5 ml氦气约含有3.01×1023个原子
答案 B
解析 物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位,不是物理量,故A正确;当氧气的摩尔质量以g·ml-1为单位时,其数值等于其相对分子质量,故B错误;物质的量是连接宏观量和微观量的桥梁,故C正确;氦气是单原子分子,0.5 ml氦气约含有原子的数目为0.5 ml×6.02×1023 ml-1=3.01×1023,故D正确。
2.相等物质的量的CO和CO2相比较,下列有关叙述正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的O原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②③
C.④⑤ D.①②③④⑤
答案 D
解析 CO、CO2的物质的量相同,所含分子数目相同,①正确;二者所含O原子数目之比等于其分子中所含O原子个数比,②正确;同理可知③④正确;1个CO分子中所含电子数为14,而1个CO2分子中所含电子数为22,故等物质的量的CO、CO2所含电子数目之比为14∶22=7∶11,⑤正确。
3.(2022·昆明高一期末)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等物质的量的N2和CO所含分子数均为NA
B.1 ml Na与O2在一定条件下完全反应生成Na2O和Na2O2的混合物时转移电子数为NA
C.0.1 ml Na2O2中含有的阴离子的数目为0.2NA
D.1 ml氧的质量为16 g
答案 B
解析 等物质的量的N2和CO所含分子数相等,但不一定是NA,故A错误;按得失电子守恒,1 ml Na与氧气完全反应生成Na2O和Na2O2的混合物,转移的电子数目为NA,故B正确;氧指代不明,应为1 ml氧原子的质量为16 g,故D错误。
题组二 摩尔质量
4.下列关于摩尔质量的说法正确的是( )
A.摩尔质量表示单位物质的量的物质所具有的质量
B.1 ml H2SO4的质量与H2SO4的摩尔质量相同
C.摩尔质量与该物质的相对分子质量或相对原子质量相等
D.某物质的物质的量越多,对应的摩尔质量越大
答案 A
解析 B项,二者的数值相同,但单位分别为g和g·ml-1,错误;C项,摩尔质量以g·ml-1为单位时,摩尔质量的数值与该物质的相对分子质量或相对原子质量相等,错误;D项,摩尔质量不随物质的量的多少发生变化,错误。
5.下列关于物质的量、摩尔质量的叙述正确的是( )
A.0.012 kg 12C中含有约6.02×1023个碳原子
B.1 ml OH-的质量为17 g·ml-1
C.氢氧化钠的摩尔质量是40 g
D.2 ml水的摩尔质量是1 ml水的摩尔质量的2倍
答案 A
解析 0.012 kg 12C中含有1 ml碳原子,约6.02×1023个碳原子,故A正确;氢氧化钠的摩尔质量为40 g·ml-1,40 g为1 ml氢氧化钠的质量,故C错误;水的摩尔质量为18 g·ml-1,与水的物质的量多少无关,故D错误。
6.(2022·湖南衡阳高一期末)下列关于物质的量和摩尔质量的叙述正确的是( )
A.氨气的摩尔质量是17 g
B.0.5 ml O2中约含有3.01×1023个氧分子
C.1 ml氢中含有2 ml氢原子和2 ml电子
D.1 ml任何纯净物都含有相同的原子数
答案 B
解析 氨气的摩尔质量是17 g·ml-1,故A错误;1 ml O2中约含有6.02×1023个氧分子,则0.5 ml O2中约含有3.01×1023个氧分子,故B正确;没有指明是氢原子还是氢分子,故C错误;由于纯净物中含有的原子数不一定相同,则1 ml纯净物中含有的原子数不一定相同,故D错误。
题组三 与eq \f(m,M)=n=eq \f(N,NA)有关的综合计算
7.25 g胆矾(CuSO4·5H2O)固体的物质的量为( )
A.0.16 ml B.0.05 ml
C.0.08 ml D.0.10 ml
答案 D
解析 25 g胆矾(CuSO4·5H2O)固体的物质的量n=eq \f(m,M)=eq \f(25 g,250 g·ml-1)=0.1 ml,故D符合题意。
8.(2022·安徽合肥一中高一期末)一个氯原子的质量为a g,一个12C的质量是b g,用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.氯元素的相对原子质量为eq \f(12a,b)
B.氯元素的摩尔质量为aNA g·ml-1
C.m g该氯原子的物质的量为eq \f(m,aNA) ml
D.n g该氯原子所含的电子数为eq \f(17n,aNA)
答案 C
解析 eq \f(12a,b)是氯原子的相对原子质量,不是氯元素的相对原子质量,故A错误;aNA g·ml-1是氯原子的摩尔质量,不是氯元素的摩尔质量,故B错误;m g该氯原子的个数为eq \f(m g,a g)=eq \f(m,a),则该氯原子的物质的量为eq \f(m,aNA) ml,故C正确;n g该氯原子所含的电子数为eq \f(n g,a g)×17=eq \f(17n,a),故D错误。
9.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g
C.64 g·ml-1 D.32 g·ml-1
答案 D
解析 气体的物质的量n=eq \f(1.505×1023,6.02×1023 ml-1)=0.25 ml,气体的摩尔质量M=eq \f(m,n)=eq \f(8 g,0.25 ml)=32 g·ml-1。
10.意大利罗马大学的Fulvi Cacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )
A.N4属于一种新型化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含原子的个数比为1∶1
D.等质量的N4与N2所含分子的个数比为2∶1
答案 C
解析 N4属于单质,A错误;N4与N2的摩尔质量分别为56 g·ml-1和28 g·ml-1,B错误;等质量的N4与N2的物质的量之比为1∶2,所含分子的个数比为1∶2,所含原子的个数比为1∶1,C正确、D错误。
11.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
B.在1 ml Na2SO4中Na+数约为6.02×1023
C.1 ml氮气所含的电子数目为NA
D.17 g氨气所含电子数目为10NA
答案 D
解析 2.4 g Mg的物质的量是eq \f(2.4 g,24 g·ml-1)=0.1 ml,0.1 ml Mg变成镁离子时失去的电子数目为0.2NA,A错误;在1 ml Na2SO4中Na+数约为1.204×1024,B错误;1个N2分子中含有14个电子,故1 ml N2含有14NA个电子,C错误;17 g氨气的物质的量为eq \f(17 g,17 g·ml-1)=1 ml,1个NH3分子中含有10个电子,故1 ml NH3所含电子数目为10NA,D正确。
12.(2022·北京高一月考)已知:①在某发烟硫酸(H2SO4·SO3)中,I2和I2O5反应生成I2(SO4)3。②I2(SO4)3溶于水生成I2和I2O4。下列说法正确的是( )
A.该发烟硫酸的摩尔质量为178
B.反应①中还原剂与氧化剂的物质的量之比为3∶2
C.反应②中氧化产物与还原产物的物质的量之比为1∶3
D.若反应②中消耗2 ml I2(SO4)3,则转移电子3 ml
答案 D
解析 发烟硫酸(H2SO4·SO3)的摩尔质量是178 g·ml-1,故A错误;I2中碘为0价,I2O5中碘为+5价,得到+3价的碘化合物I2(SO4)3,则化学方程式为4I2+6I2O5+15H2SO4·SO3===10I2(SO4)3+15H2O,还原剂I2与氧化剂I2O5的物质的量之比为2∶3,故B错误;I2(SO4)3溶于水生成I2和I2O4,另外还应生成H2SO4,根据反应物与产物中I元素的化合价可推知I2与I2O4的物质的量之比为1∶3,则化学方程式:4I2(SO4)3+12H2O===I2+3I2O4+12H2SO4,4I2(SO4)3~I2~6e-,所以消耗2 ml I2(SO4)3,则转移3 ml电子,故C错误、D正确。
13.(2022·河北廊坊第七中学高一月考)完成下列计算:
(1)硫原子的摩尔质量是______________。
(2)0.5 ml H2SO4的质量是______________g,含______________个分子,含___________ ml氧原子,能和______________ ml NaOH完全反应。
(3)含0.4 ml Cl-的氯化镁是______________ ml,质量是__________ g,它跟_________ g氯化钠含有相同数目的Cl-。
(4)0.3 ml NH3和0.4 ml CO2的质量之比为__________,所含原子数之比为______________。
(5)已知4.8 g某混合气体含分子数为0.15NA,该气体的平均摩尔质量为______________。
答案 (1)32 g·ml-1 (2)49 0.5NA 2 1 (3)0.2 19 23.4 (4)51∶176 1∶1
(5)32 g·ml-1
解析 (2)0.5 ml H2SO4的质量是0.5 ml×98 g·ml-1=49 g,含有的分子个数为0.5NA,含有的氧原子数为4×0.5NA=2NA,物质的量为2 ml,共1 ml H+,故能和1 ml NaOH完全反应。(3)1 ml氯化镁中含有2 ml氯离子,故含0.4 ml Cl-的氯化镁是0.2 ml,质量是0.2 ml×95 g·ml-1=19 g;与0.4 ml氯化钠含有相同数目的Cl-,氯化钠的质量为0.4 ml×58.5 g·ml-1=23.4 g。
(4)0.3 ml NH3和0.4 ml CO2的质量之比为0.3×17∶0.4×44=51∶176,所含原子数之比为0.3×4∶0.4×3=1∶1。
(5)该混合气体的物质的量为eq \f(0.15NA,NA ml-1)=0.15 ml,平均摩尔质量为eq \f(m,n)=eq \f(4.8 g,0.15 ml)=32 g·ml-1。
14.下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说明:
(1)加碘盐不能长时间炖炒,且应避热、避光保存,你认为可能的原因是______________。
(2)实验分析发现,某批加碘盐中KIO3的含量为52 mg·kg-1。计算每千克加碘盐中KIO3的物质的量为____________和碘的质量为____________。
(3)若成人每天需摄入0.15~0.20 mg碘才能满足人体健康需要,通过计算说明成人平均每天食用6.0 g这种加碘盐能否获得需要的碘______________(填“能”或“不能”)。
答案 (1)KIO3在热或光作用下会分解
(2)2.4×10-4 ml 3.1×10-2 g(31 mg)
(3)能
解析 (1)加碘盐的配料为氯化钠、碘酸钾,其中碘酸钾的性质与氯酸钾相似,在热或光的作用下易分解,故为防止碘酸钾的分解,加碘盐不能长时间炖炒,且应避热、避光保存。(2)每千克加碘盐中KIO3的质量为52 mg,n(KIO3)=eq \f(0.052 g,214 g·ml-1)≈2.4×10-4 ml,m(I)=52 mg×eq \f(127,214)≈31 mg。(3)由(2)可知,每千克加碘盐中含碘31 mg,6.0 g加碘盐中含碘31 mg·kg-1×0.006 kg=0.186 mg,在0.15~0.20 mg范围内,可以获得需要的碘。
15.(2022·福建华安县第一中学高一月考)下图是已破损的维生素C(简写作VC)说明书部分信息。已知维生素C由碳、氢、氧三种元素组成。回答下列问题:
(1)VC的化学式为________________,摩尔质量为______________。
(2)VC中碳、氢元素的质量比为________________,0.1 ml VC中含氧原子数为_________。
(3)某同学妈妈每天按上述用法与用量服用该VC片剂,该同学建议妈妈食用西红柿来代替VC片,若100 g西红柿含30 mg VC,则该同学妈妈每天需食用西红柿______________g才可达到服用上述VC片的效果。
答案 (1)C6H8O6 176 g·ml-1 (2)9∶1 0.6 NA (3)200
解析 (1)由图示可知:VC的相对分子质量为176,每个VC分子中含有6个碳原子、8个氢原子,含有氧原子的个数为eq \f(176-12×6-1×8,16)=6,则VC的化学式为C6H8O6,摩尔质量为176 g·ml-1。(2)VC中碳、氢元素的质量比为(12×6)∶(1×8)=9∶1;0.1 ml VC中含氧原子数为0.6NA。(3)若100 g西红柿含30 mg VC,则每天需食用西红柿eq \f(3×2×10 mg,30 mg)×100 g=200 g才可达到服用上述VC片的效果。前提条件
公式
任意状态的任意物质
M=eq \f(m,n)(定义式)
已知一个粒子的质量
M=m(粒子)×NA
已知一个粒子的质量和一个12C原子的质量
M=eq \f(m粒子,\f(1,12)m12C)
配料:氯化钠(NaCl)、碘酸钾(KIO3)
含碘量:20~40 mg·kg-1
保质期:18个月
食用方法:勿长时间炖炒
储藏方法:避热、避光、防潮
相关试卷
这是一份高中化学沪科技版(2020)必修第一册摩尔质量 气体摩尔体积当堂检测题,共9页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份【同步讲义】高中化学(鲁科版2019)必修第一册--第04讲 物质的量及其单位——摩尔摩尔 质量 讲义,文件包含同步讲义高中化学鲁科版2019必修第一册--第04讲物质的量及其单位摩尔摩尔质量学生版docx、同步讲义高中化学鲁科版2019必修第一册--第04讲物质的量及其单位摩尔摩尔质量教师版docx等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。
这是一份高中鲁科版第3节 化学中常用的物理量-物质的量第1课时同步训练题,共10页。试卷主要包含了概念判断,选择题,非选择题等内容,欢迎下载使用。










