

所属成套资源:全套2024届高考化学复习第七章~第十章课时讲义含答案
- 2024届高考化学复习讲义第七章化学反应速率和化学平衡第三讲平衡常数及转化率考点一平衡常数的计算含答案 学案 0 次下载
- 2024届高考化学复习讲义第七章化学反应速率和化学平衡第三讲平衡常数及转化率考点二平衡常数的应用含答案 学案 0 次下载
- 2024届高考化学复习讲义第七章化学反应速率和化学平衡第四讲化学反应的方向和化学反应的调控考点一化学反应的方向含答案 学案 0 次下载
- 2024届高考化学复习讲义第七章化学反应速率和化学平衡第四讲化学反应的方向和化学反应的调控考点二化学反应的调控含答案 学案 0 次下载
- 2024届高考化学复习讲义第七章化学反应速率和化学平衡第五讲化学反应速率与化学平衡的图像含答案 学案 0 次下载
2024届高考化学复习讲义第七章化学反应速率和化学平衡第三讲平衡常数及转化率考点三平衡转化率与非平衡转化率含答案
展开
这是一份2024届高考化学复习讲义第七章化学反应速率和化学平衡第三讲平衡常数及转化率考点三平衡转化率与非平衡转化率含答案,共6页。
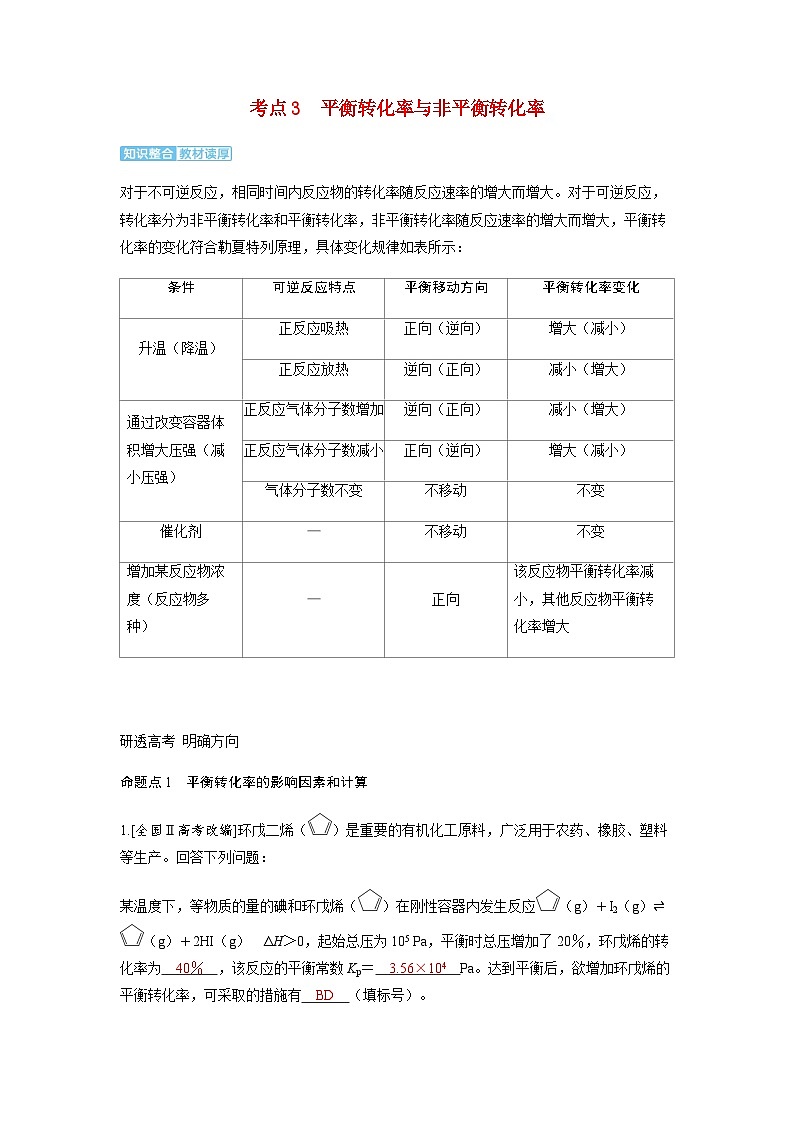
对于不可逆反应,相同时间内反应物的转化率随反应速率的增大而增大。对于可逆反应,转化率分为非平衡转化率和平衡转化率,非平衡转化率随反应速率的增大而增大,平衡转化率的变化符合勒夏特列原理,具体变化规律如表所示:
研透高考 明确方向
命题点1 平衡转化率的影响因素和计算
1.[全国Ⅱ高考改编]环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应(g)+I2(g)⇌(g)+2HI(g) ΔH>0,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为 40% ,该反应的平衡常数Kp= 3.56×104 Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 BD (填标号)。
A.通入稀有气体B.提高温度
C.增加环戊烯浓度D.增加碘浓度
解析 设容器中起始加入I2(g)和环戊烯的物质的量均为1 ml,平衡时转化的环戊烯的物质的量为x ml,由“三段式”法得:
(g) +I2(g)⇌(g)+2HI(g)
起始量/ml 1 1 0 0
转化量/ml x x x 2x
平衡量/ml 1-x 1-x x 2x
根据平衡时总压强增加了20%,且恒温恒容时,压强之比等于气体物质的量之比,得1+1(1-x)+(1-x)+x+2x=11.2,解得x=0.4,则环戊烯的转化率为40%。平衡时(g)、I2(g)、(g)、HI(g)的分压分别为p总4、p总4、p总6、p总3,则Kp=p总6×(p总3)2p总4×p总4=827p总,根据p总=1.2×105 Pa,可得Kp=827×1.2×105 Pa≈3.56×104 Pa。由刚性容器(恒容),可知通入稀有气体时各反应物及产物浓度不变,化学平衡不移动,A项不符合题意;该反应为吸热反应,提高温度,平衡正向移动,可提高环戊烯的平衡转化率,B项符合题意;增加环戊烯浓度,能提高I2(g)的平衡转化率,但环戊烯的平衡转化率降低,C项不符合题意;增加I2(g)的浓度,化学平衡正向移动,能提高环戊烯的平衡转化率,D项符合题意。
2.[全国Ⅰ高考]H2S与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610 K时,将0.10 ml CO2与0.40 ml H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1= 2.5 %,反应平衡常数K= 2.8×10-3 。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 > α1,该反应的ΔH > 0。(填“>”“<”或“=”)
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是 B (填标号)。
A.H2SB.CO2
C.COSD.N2
解析 (1)该反应是气体分子数不变的反应,平衡时n(H2O)=0.02×0.50 ml=0.01 ml。
H2S(g)+CO2(g)⇌COS(g)+H2O(g)
起始量/ml 0.40 0.10 0 0
转化量/ml 0.01 0.01 0.01 0.01
平衡量/ml 0.39 0.09 0.01 0.01
H2S的平衡转化率α1=×100%=2.5%。对于气体分子数不变的反应,可直接用物质的量替代浓度计算平衡常数:K=c(COS)·c(H2O)c(H2S)·c(CO2)=n(COS)·n(H2O)n(H2S)·n(CO2)=0.01××0.09≈2.8×10-3。(2)总物质的量不变,H2O的物质的量分数增大,说明平衡正向移动,H2S的转化率增大,即升高温度,平衡向正反应方向移动,故正反应是吸热反应。(3)平衡之后,再充入H2S,则CO2的转化率增大,H2S的转化率减小,A项错误;充入CO2,平衡正向移动,H2S的转化率增大,B项正确;充入COS,平衡逆向移动,H2S的转化率减小,C项错误;充入N2,无论体积是否变化,对于气体分子数不变的反应,平衡不移动,H2S的转化率不变,D项错误。
3.(1)[2023全国甲]电喷雾电离等方法得到的M+(Fe+、C+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4M++CH3OH,结果如图所示。图中300 K的曲线是 b (填“a”或“b”)。300 K、 60 s时MO+的转化率为 1-10-0.11×100% (列出算式)。
(2)[2023湖南改编]在某温度、100 kPa下,向反应器中充入1 ml气态乙苯发生反应C6H5C2H5(g)⇌C6H5CHCH2(g)+H2(g) ΔH,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 5 ml水蒸气作为稀释气(计算时忽略副反应)。
解析 (1)由原子守恒知,c(MO+)+c(M+)为定值,随反应的进行,MO+减少,c(MO+)c(MO+)+c(M+)减小,温度越高,反应速率越快,反应相同时间时,对应的-lg [c(MO+)c(MO+)+c(M+)]越大,故曲线b表示300 K时的曲线。设起始时c(MO+)=1 ml·L-1,则反应过程中c(MO+)+c(M+)始终为1 ml·L-1,300 K、60 s时-lg [c(MO+)c(MO+)+c(M+)]=0.1,即c(MO+)c(MO+)+c(M+)=10-0.1,则此时c(MO+)=10-0.1ml·L-1,MO+的转化率为1-10-0.11×100%。(2)乙苯的平衡转化率为50%时,由题中信息可得:
C6H5C2H5(g)⇌C6H5CHCH2(g)+H2(g)
起始量 1 ml 0 0
转化量 0.5 ml 0.5 ml 0.5 ml
平衡量 0.5 ml 0.5 ml 0.5 ml
平衡分压1003 kPa 1003 kPa 1003 kPa
则压强平衡常数Kp=p(苯乙烯)·p(H2)p(乙苯)=1003 kPa。设充入x ml水蒸气时乙苯平衡转化率提高到75%,则:
C6H5C2H5(g)⇌C6H5CHCH2(g)+H2(g)
起始量 1 ml 0 0
转化量 0.75 ml 0.75 ml 0.75 ml
平衡量 0.25 ml 0.75 ml 0.75 ml
平衡分压251.75+x kPa 751.75+x kPa 751.75+x kPa
温度不变,平衡常数不变,则压强平衡常数Kp=p(苯乙烯)·p(H2)p(乙苯)=2251.75+x kPa =1003 kPa,解得x=5。
命题点2 非平衡转化率的判断
4.乙苯催化脱氢生产苯乙烯的反应为。
(1)t ℃下,将1 ml乙苯加入体积为1 L的密闭容器中,发生上述反应。反应时间与容器内气体总物质的量、总压强的数据如表所示。
①n4= 1.4 ,平衡时乙苯的转化率为 40% 。
②t ℃下该反应的平衡常数Kp= 26.7 kPa。(Kp为以分压表示的平衡常数,计算结果保留1位小数)
(2)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气。测得温度和投料比M[M=n(H2O)/n(乙苯)]对乙苯平衡转化率的影响如图1所示。
图1
①图1中A、B、C三点对应平衡常数的大小顺序为 KA>KB=KC 。
②图1中投料比(MA、MB、MC)的大小顺序为 MA>MB>MC ,理由是 该反应是气体分子数增大的反应,恒压下充入水蒸气,相当于减压,平衡正向移动,水蒸气的量越大,即M越大,平衡正向移动的程度越大,乙苯的平衡转化率越大 。
(3)其他条件相同,在甲、乙两种催化剂的作用下,乙苯转化率与温度的关系如图2所示。在甲催化剂的作用下,图2中N点处(对应温度为320 ℃)乙苯的转化率 一定不是 (填“可能是”“一定是”或“一定不是”)该温度下的平衡转化率,原因为 N点处乙苯的转化率小于相同温度下乙催化剂催化下的乙苯转化率,且催化剂不影响平衡转化率 。高于320 ℃时,乙苯的转化率降低的原因可能是 催化剂活性降低 。
图2
解析 (1)①由题表数据可知30 min时反应已经达到平衡,平衡总压强为140 kPa,设达到平衡时乙苯的转化量为x ml,列“三段式”进行计算:
起始量/ml 1 0 0
转化量/ml x x x
平衡量/ml 1-x x x
恒温恒容条件下,压强之比等于物质的量之比,则140100=1-x+x+x1,解得x=0.4,则平衡时的总物质的量为1.4 ml,平衡时乙苯的转化率为x1×100%=0.41×100%=40%。②Kp=p(苯乙烯)·p(H2)p(乙苯)=0.41.4×140kPa×0.41.4×140kPa0.61.4×140kPa≈26.7 kPa。(2)①由题图1可知,温度升高乙苯的平衡转化率增大,则升温时平衡正向移动,正反应为吸热反应,升温K增大,且K只受温度影响,温度不变,K不变,因此A、B、C三点对应平衡常数的大小顺序为KA>KB=KC。②反应在常压下进行,可视为恒压条件下的反应,水蒸气相对于题给反应为“惰性”组分,充入水蒸气,相当于减压,而该反应为气体分子数增大的反应,减小压强平衡正向移动,可提高乙苯的转化率,因此转化率大的投料比大,即MA>MB>MC。(3)相同条件下甲催化剂和乙催化剂对应的平衡转化率应该相同,而题图2中320 ℃时甲催化剂和乙催化剂对应的转化率不同,且甲催化剂对应的转化率低,说明N点时乙苯的转化率一定不是平衡转化率。温度过高时会使催化剂失去活性,导致反应速率以及反应的选择性等降低,则单位时间内反应物的转化率降低。条件
可逆反应特点
平衡移动方向
平衡转化率变化
升温(降温)
正反应吸热
正向(逆向)
增大(减小)
正反应放热
逆向(正向)
减小(增大)
通过改变容器体积增大压强(减小压强)
正反应气体分子数增加
逆向(正向)
减小(增大)
正反应气体分子数减小
正向(逆向)
增大(减小)
气体分子数不变
不移动
不变
催化剂
—
不移动
不变
增加某反应物浓度(反应物多种)
—
正向
该反应物平衡转化率减小,其他反应物平衡转化率增大
时间/min
0
10
20
30
40
总物质的量/ml
1
n1
n2
n3
n4
总压强/kPa
100
125
135
140
140
相关学案
这是一份最新高考化学考点一遍过(讲义) 考点40 化学平衡常数及转化率,共24页。
这是一份高考化学一轮复习第七章化学反应速率和化学平衡第三讲化学平衡常数化学反应进行的方向学案新人教版,共26页。学案主要包含了加固训练—拔高等内容,欢迎下载使用。
这是一份高考化学一轮复习第七章化学反应速率和化学平衡第三讲化学平衡常数化学反应进行的方向学案,文件包含湖南师大附中数学附中3次pdf、湖南师大附中数学答案附中3次pdf等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。








