

所属成套资源:全套2024届高考化学复习第七章~第十章课时讲义含答案
- 2024届高考化学复习讲义第九章有机化学基础第六讲生物大分子合成高分子考点二合成高分子含答案 学案 0 次下载
- 2024届高考化学复习讲义第九章有机化学基础第七讲有机合成推断与路线设计考点一有机综合推断含答案 学案 1 次下载
- 2024届高考化学复习讲义第十章化学实验基础第一讲常见的化学仪器及使用方法考点一实验仪器的选择与使用含答案 学案 0 次下载
- 2024届高考化学复习讲义第十章化学实验基础第一讲常见的化学仪器及使用方法考点二化学实验基本操作含答案 学案 0 次下载
- 2024届高考化学复习讲义第十章化学实验基础第一讲常见的化学仪器及使用方法考点三化学试剂的保存和化学实验安全含答案 学案 0 次下载
2024届高考化学复习讲义第九章有机化学基础第七讲有机合成推断与路线设计考点二有机合成路线设计含答案
展开
这是一份2024届高考化学复习讲义第九章有机化学基础第七讲有机合成推断与路线设计考点二有机合成路线设计含答案,共9页。
1.有机合成的基本思路
说明 (1)从原料出发选择正向合成线路:对比原料分子和产物分子在碳骨架和官能团方面的异同 → 有目的地选择每一步转化反应。
(2)从目标产物出发选择逆向合成线路:目标产物的适当位置断裂化学键→较小中间体1→更小中间体2→……→基础原料。
2.有机合成的主要任务
(1)构建碳骨架
(2)引入官能团
(3)官能团的保护
常用保护技巧:①选择合适的氧化剂(或还原剂)。②合理安排官能团转换反应的先后顺序。③合成前引入保护基,合成后脱除保护基。
(4)苯环定位的原则
苯环上原有取代基能影响新导入取代基在苯环上的位置,常见基团的影响如表:
3.有机合成的线路优化(绿色理念)
(1)步骤少、副反应少、产率高。
(2)反应物、溶剂和催化剂尽可能廉价易得、无毒。
(3)反应条件温和,操作简便,产物易于分离提纯。
(4)污染排放少。
1.下列合成路线中不可行的是( C )
A.用氯苯合成环己烯:H+催化剂NaOH,醇 △
B.用乙烯合成乙酸:CH2CH2H2O,催化剂 △,加压CH3CH2OHO2,Cu △ CH3CHOO2,催化剂 △ CH3COOH
C. 用乙烯合成乙二醇:H2,催化剂 △ CH3CH3Cl2hvCH2ClCH2ClNaOH,H2O △ HOCH2CH2OH
2.设计合成路线完成下列转化。
(1)[碳骨架的建构]由乙醇得到乳酸(α-羟基丙酸)。
CH3CH2OHCu或Ag △ CH3CHOHCNCH3CH(OH)CNH2O,H+O2,△ CH3CH(OH)COOH(第三步通常由已知给出)
(2)[引入官能团]由1-丙醇得到丙炔。
CH3CH2CH2OH浓硫酸△CH3CHCH2Br2NaOH的醇溶液△
3.设计合成路线完成下列转化。
(1)[双键的保护]利用酸性高锰酸钾溶液,实现转化(其他试剂任选):
CH2CH—CH2—CHO→CH2CH—CH2—COOH。
CH2CH—CH2—CHOHBrKMnO2/H+NaOH的醇溶液△CH2CH—CH2—COONaH+CH2CH—CH2—COOH
(2)[羟基的保护]已知:
①;
②,请写出以为初始反应物合成的路线。
(3)[氨基的保护]写出合成的路线。
(4)[醛基的保护]已知:
请以C2H5COCH2COOH为初始反应物,经三步反应合成有机物C2H5COCH2CH2OH,写出合成路线。
研透高考 明确方向
命题点 有机合成路线设计
1.[苯环的定位][2023湖南]含有吡喃萘醌骨架的化合物常具有抗菌、抗病毒等生物活性。一种合成该类化合物的路线如下(部分反应条件已简化):
回答下列问题:
(1)B的结构简式为 。
(2)从F转化为G的过程中所涉及的反应类型是 消去反应 、 加成反应 。
(3)物质G所含官能团的名称为 醚键 、 碳碳双键 。
(4)依据上述流程提供的信息,下列反应产物J的结构简式为 。
(5)下列物质的酸性由大到小的顺序是 ③>①>② (写标号)。
①
②
③
(6)(呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中,除外,还有 4 种。
(7)甲苯与溴在FeBr3催化下发生反应,会同时生成对溴甲苯和邻溴甲苯。依据由C到D的反应信息,设计以甲苯为原料选择性合成邻溴甲苯的路线(无机试剂任选)。
解析 (1)根据E、F的结构简式,结合B的分子式可推知B为。(2)由F、中间体、G的结构可知,F先发生消去反应得到中间体,中间体再与呋喃发生加成反应得到(G)。(3)物质G的结构简式为,含有的官能团有醚键、碳碳双键。(4)和发生类似中间体G的加成反应得到,和HCl发生类似GH的反应得到,故产物J的结构简式为。(5)F的电负性大,—CF3为吸电子基团,由于诱导效应使中O—H键极性增强,—CH3为推电子基团,由于共轭效应使O—H键极性减弱,故酸性:>>。(6)的不饱和度为3,其同分异构体能发生银镜反应,则含有醛基,除了外,还有、、、,共4种。(7)由CD可知,—SO3H取代中—CH3的对位,则先令和浓硫酸发生取代反应生成,再和液溴发生取代反应生成,最后加热得到。
2.[碳骨架的架构][2023湖北]碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线:
回答下列问题:
(1)由A→B的反应中,乙烯的碳碳 π 键断裂(填“π”或“σ”)。
(2)D的同分异构体中,与其具有相同官能团的有 7 种(不考虑对映异构),其中核磁共振氢谱有三组峰,峰面积之比为9∶2∶1的结构简式为 。
(3)E与足量酸性KMnO4溶液反应生成的有机物的名称为 乙酸 、 丙酮 。
(4) G的结构简式为 。
(5)已知:2NaOH溶液 △ +H2O,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I()和另一种α, β-不饱和酮J,J的结构简式为 。若经此路线由H合成I,存在的问题有 ab (填标号)。
a.原子利用率低b.产物难以分离
c.反应条件苛刻d.严重污染环境
解析 (1)A→B为碳碳双键的加成反应,故断裂的化学键为乙烯的碳碳π键。(2)由D的结构简式可知,D的分子式为C5H12O,与其具有相同官能团的为C5H11OH,由于C5H11OH共有8种结构,除去D本身,满足条件的D的同分异构体有7种,其中核磁共振氢谱有三组峰,峰面积之比为9∶2∶1的结构简式为。(3)E为,与足量酸性KMnO4溶液反应时,发生氧化反应,碳碳双键断裂,生成CH3COOH和,其名称分别为乙酸和丙酮。(4)根据D→E、F→G的反应条件可推知F→G与D→E的反应类型相同,均为醇的消去反应,再结合H的结构简式分析可得G的结构简式为。(5)由题目信息可知,另一种α,β-不饱和酮J的结构简式为;经此路线由H合成I,生成的两种产物均为不饱和酮,二者互溶,难以分离,且由于有副产物生成,原子利用率较低,故选ab。
方法点拨
解答有机合成路线设计题的常见方法
此类试题情境新颖,体现化学的应用性,拓宽学生视野,但不用纠结于情境,灵活运用正推法和逆推法即可,具体如下:
目标
常用反应
增长
碳链
加成反应:碳碳双键或碳碳三键或醛基+HCN(增加一个碳原子);
羟醛缩合(增加多个碳原子)
缩短
碳链
氧化反应:碳碳双键或碳碳三键或苯的同系物+酸性高锰酸钾溶液
碳链
成环
(环)加成反应:狄尔斯-阿尔德反应(如+△)
目标
常用途径或反应
碳碳双键或
碳碳三键
卤代烃或醇的消去反应;烷烃裂化;炔烃不完全加成
碳卤键
烯烃或炔烃与X2、HX加成;烷烃、苯环的卤代反应;醇与HX的取代反应
羟基
卤代烃或酯水解;醛基或羰基还原;烯烃与水加成
醛基或酮羰基
醇的催化氧化;碳碳双键被氧化
羧基
酯基、酰胺基、氰基(—CN)、—CCl3水解;醛基、碳碳双键、碳碳三键、苯的同系物等的氧化
酯基
酯化反应
醚键
羟基间脱水
酰胺基
羧基与氨基间脱水
氨基
硝基、氰基(—CN)加氢还原、R—X与NH3反应
羟基的保护
先将羟基转化为醚键,使醇或酚转化为在一般反应条件下比较稳定的醚。相关合成反应结束后,再在一定条件下脱除保护基,恢复羟基。
氨基的
保护
(1)先与盐酸反应转化为盐,待氧化其他基团后再与NaOH溶液反应重新转化为氨基;
(2)注意官能团的转化顺序。如在对硝基甲苯合成对氨基苯甲酸的过程中应先把—CH3氧化成—COOH,再把—NO2还原为—NH2,以防止KMnO4氧化—CH3时,—NH2(具有还原性)也被氧化
碳碳双键
的保护
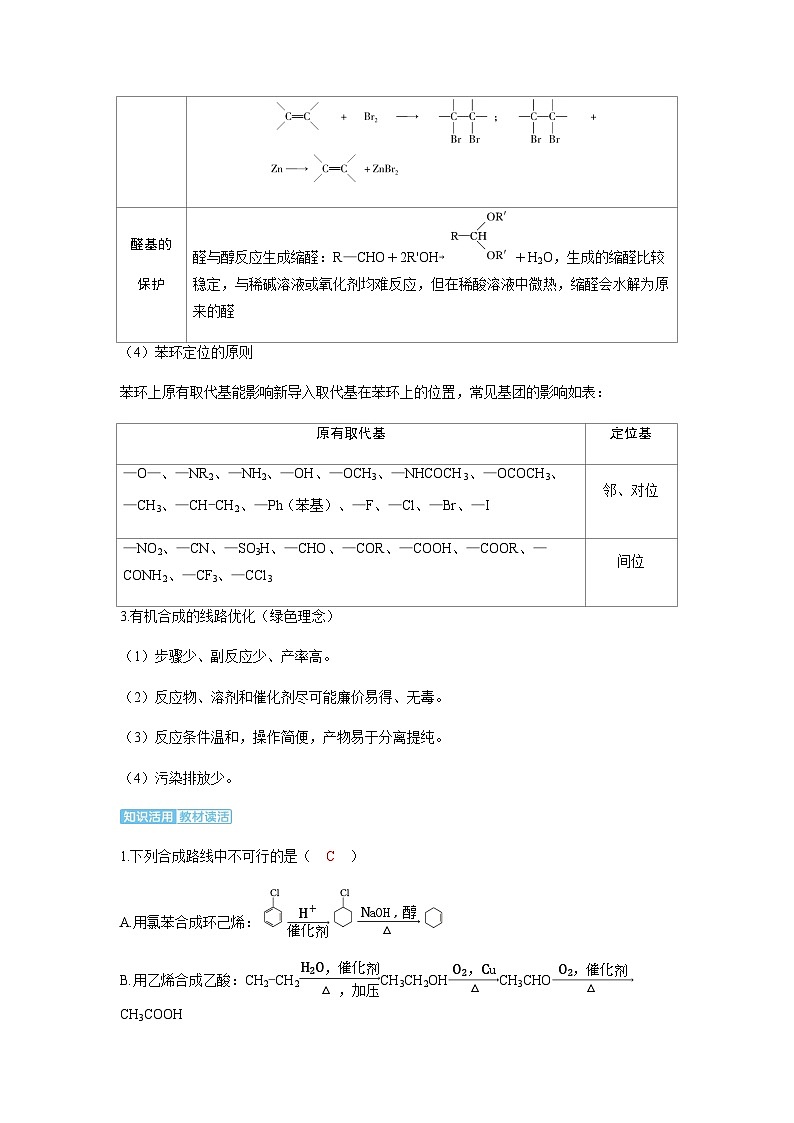
先与卤素单质、卤化氢等发生加成反应,待氧化其他基团后再利用消去反应将其重新转化为碳碳双键,如:
醛基的
保护
醛与醇反应生成缩醛:R—CHO+2R'OH+H2O,生成的缩醛比较稳定,与稀碱溶液或氧化剂均难反应,但在稀酸溶液中微热,缩醛会水解为原来的醛
原有取代基
定位基
—O—、—NR2、—NH2、—OH、—OCH3、—NHCOCH3、—OCOCH3、—CH3、—CHCH2、—Ph(苯基)、—F、—Cl、—Br、—I
邻、对位
—NO2、—CN、—SO3H、—CHO、—COR、—COOH、—COOR、—CONH2、—CF3、—CCl3
间位
相关学案
这是一份2024届高考化学一轮复习专题9第51讲有机合成路线的设计能力学案,共35页。
这是一份鲁科版高考化学一轮复习第9章第55讲有机合成路线的设计课时学案,共27页。
这是一份新高考化学二轮复习学案第1部分 专题突破 专题23 有机合成路线的设计(含解析),共16页。








