










所属成套资源:2024年高考化学二轮复习课件(含练习)
第一篇 主题二 选择题4 阿伏加德罗常数应用判断-2024年高考化学二轮复习课件
展开
这是一份第一篇 主题二 选择题4 阿伏加德罗常数应用判断-2024年高考化学二轮复习课件,文件包含第一篇主题二选择题4阿伏加德罗常数应用判断pptx、第一篇主题二选择题4阿伏加德罗常数应用判断docx、第一篇主题二选择题4阿伏加德罗常数应用判断学生版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
考向一 一定量物质中指定微粒数目的判断1.气体中微粒数目的判断(1)(2023·全国甲卷,10B)标准状况下,2.24 L SO3中电子的数目为4.00NA ( )(2)(2022·广东,9C)1 ml CO中含有6.02×1024个电子 ( )(3)(2021·河北,7A)22.4 L(标准状况)氟气所含的质子数为18NA( )(4)(2022·全国甲卷,11A)25 ℃,101 kPa下,28 L氢气中质子的数目为2.5NA( )
2.液体或固体物质中微粒数目的判断(1)(2022·浙江6月选考,12A)12 g NaHSO4中含有0.2NA个阳离子( )(2)(2020·全国卷Ⅲ,9B)1 ml 重水比1 ml 水多NA个质子( )(3)(2023·辽宁,5C)0.1 ml KNO3晶体中含离子数目为0.2NA ( )
3.溶液中指定微粒数目的判断(1)(2023·浙江6月选考,7C)向1 L 0.1 ml·L-1 CH3COOH溶液通氨气至中性,铵根离子数为0.1NA ( )(2)(2022·辽宁,3D)pH=12的Na2CO3溶液中OH-数目为0.01NA( )(3)(2020·全国卷Ⅲ,9D)1 L 1 ml·L-1NaCl溶液含有28NA个电子( )(4)(2022·全国甲卷,11B)2.0 L 1.0 ml·L-1 AlCl3溶液中,Al3+的数目为2.0NA( ) (5)(2019·全国卷Ⅱ,8B)1 L 0.1 ml·L-1磷酸钠溶液含有的 数目为0.1NA( )
考向二 一定量物质中化学键数目的判断4.(1)(2023·全国甲卷,10A)0.50 ml异丁烷分子中共价键的数目为6.5NA ( )(2)(2023·浙江6月选考,7A)4.4 g C2H4O中含有σ键数目最多为0.7NA ( )(3)(2019·全国卷Ⅱ,8D)48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA( )(4)(2022·辽宁,3B)28 g C2H4分子中含有的σ键数目为4NA( )(5)(2022·浙江6月选考,12B)11.2 L乙烷和丙烯的混合气体中所含碳氢键数为3NA( )
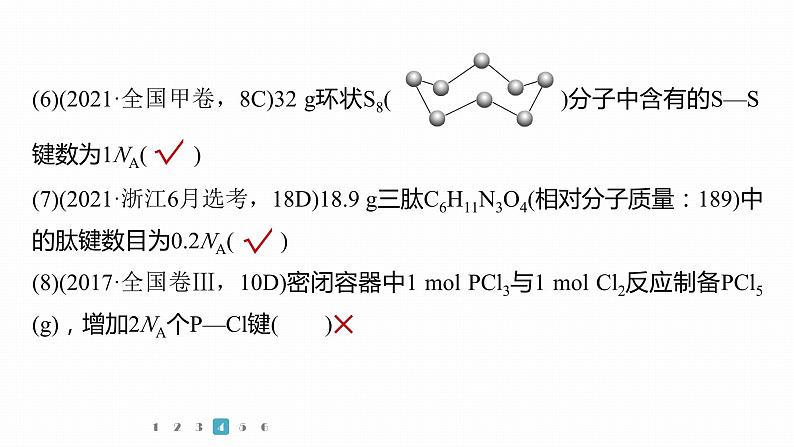
(6)(2021·全国甲卷,8C)32 g环状S8( )分子中含有的S—S键数为1NA( )(7)(2021·浙江6月选考,18D)18.9 g三肽C6H11N3O4(相对分子质量:189)中的肽键数目为0.2NA( )(8)(2017·全国卷Ⅲ,10D)密闭容器中1 ml PCl3与1 ml Cl2反应制备PCl5(g),增加2NA个P—Cl键( )
考向三 氧化还原反应中电子转移数目的判断5.(1)(2023·辽宁,5B)S+2KNO3+3C===K2S+N2↑+3CO2↑,每生成2.8 g N2转移电子数目为NA ( )(2)(2022·全国甲卷,11D)电解熔融CuCl2,阴极增重6.4 g,外电路中通过电子的数目为0.10 NA( )(3)(2022·浙江1月选考,12C)足量的浓盐酸与8.7 g MnO2反应,转移电子的数目为0.4NA( )
(4)(2021·河北,7C)电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为NA( )(5)(2021·全国甲卷,8B)3 ml的NO2与H2O完全反应时转移的电子数为4NA( )(6)(2021·浙江1月选考,18C)向100 mL 0.10 ml·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA( )(7)(2015·全国卷Ⅰ,8C)过氧化钠与水反应时,生成0.1 ml氧气转移的电子数为0.2NA( )
考向四 化学反应中指定物质微粒数目的判断6.(1)(2022·广东,9D)22.4 L CO2被还原生成1 ml CO( )(2)(2022·全国甲卷,11C)0.20 ml苯甲酸完全燃烧,生成CO2的数目为1.4NA( )(3)(2021·湖南,5D)11.2 L CH4和22.4 L Cl2(均为标准状况)在光照下充分反应后的分子数为1.5NA( )(4)(2022·浙江6月选考,12D)0.1 ml H2和0.1 ml I2于密闭容器中充分反应后,HI分子总数为0.2NA( )
(5)(2022·海南,7D)在2.8 g Fe中加入100 mL 3 ml·L-1 HCl,Fe完全溶解,反应生成的标准状况下气体3.36 L( )(6)(2021·浙江1月选考,18B)CH4和C2H4混合气体2.24 L(标准状况)完全燃烧,则消耗O2分子数目为0.25NA( )
1.考情分析有关阿伏加德罗常数(NA)的综合判断,常见的考查角度为(1)粒子数目(分子数、原子数、离子数、质子数、中子数、电子数等);(2)物质结构(极性键、非极性键等);(3)氧化还原反应转移电子数目;(4)化学反应前后物质量的关系等。
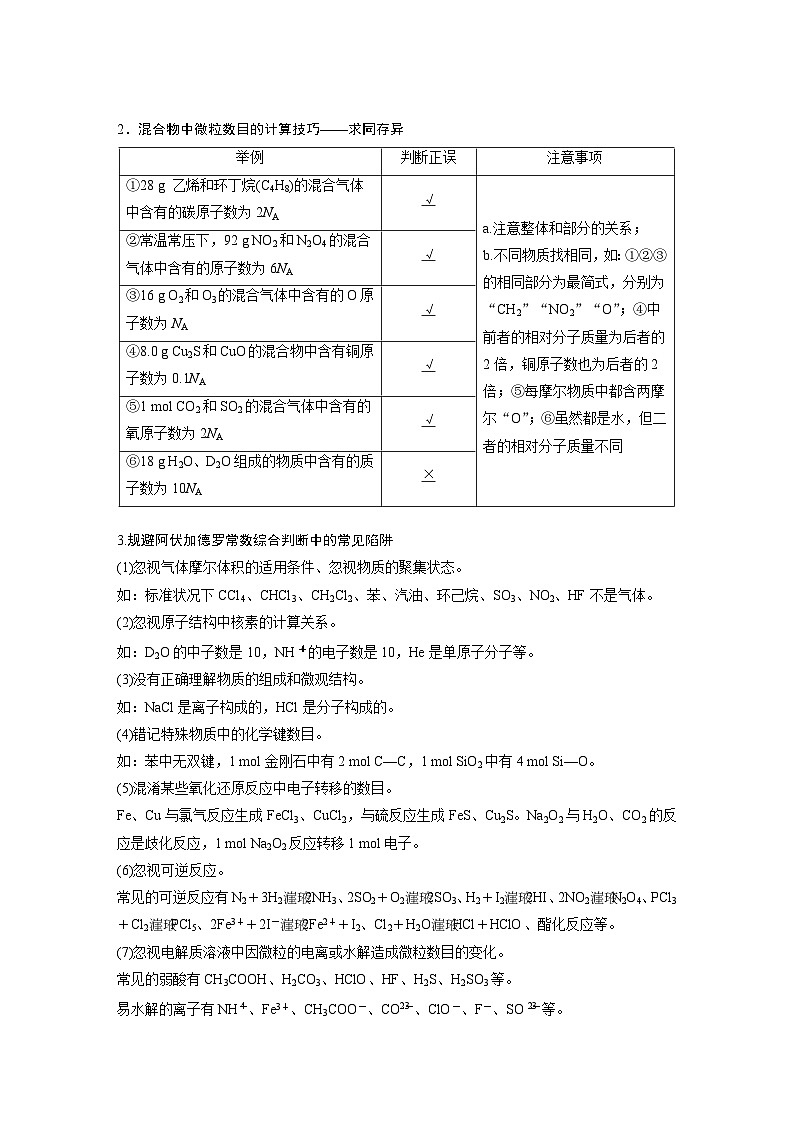
2.混合物中微粒数目的计算技巧——求同存异
3.规避阿伏加德罗常数综合判断中的常见陷阱
(1)忽视气体摩尔体积的适用条件、忽视物质的聚集状态。如:标准状况下CCl4、CHCl3、CH2Cl2、苯、汽油、环己烷、SO3、NO2、HF不是气体。(2)忽视原子结构中核素的计算关系。如:D2O的中子数是10, 的电子数是10,He是单原子分子等。(3)没有正确理解物质的组成和微观结构。如:NaCl是离子构成的,HCl是分子构成的。
(4)错记特殊物质中的化学键数目。如:苯中无双键,1 ml金刚石中有2 ml C—C,1 ml SiO2中有4 ml Si—O。(5)混淆某些氧化还原反应中电子转移的数目。Fe、Cu与氯气反应生成FeCl3、CuCl2,与硫反应生成FeS、Cu2S。Na2O2与H2O、CO2的反应是歧化反应,1 ml Na2O2反应转移1 ml电子。
(6)忽视可逆反应。常见的可逆反应有N2+3H2 2NH3、2SO2+O2 2SO3、H2+I22HI、2NO2 N2O4、PCl3+Cl2 PCl5、2Fe3++2I- 2Fe2++I2、Cl2+H2O HCl+HClO、酯化反应等。
(7)忽视电解质溶液中因微粒的电离或水解造成微粒数目的变化。常见的弱酸有CH3COOH、H2CO3、HClO、HF、H2S、H2SO3等。
(8)忽视胶体粒子的组成。胶体粒子是胶团,如1 ml FeCl3水解形成的Fe(OH)3胶体粒子数小于NA。(9)忽视溶液的体积及溶剂水中的氧原子或氢原子。
4.熟练掌握物质的量等相关物理量之间的关系,在计算时必须以“物质的量”为中心
1.(2023·黑龙江大庆一模)设NA为阿伏加德罗常数的值,下列说法正确的是A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.2NAB.1 L 1 ml·L-1 H2O2溶液中,氢原子数目为2NAC.22.4 L(标准状况下)氯气与56 g铁充分反应,转移的电子数为3NAD.密闭容器中2 ml SO2和1 ml O2充分反应后,容器中分子数为2NA
过氧化钡中含有钡离子、过氧根离子,16.9 g(0.1 ml)过氧化钡固体中阴、阳离子总数为0.2NA,A正确;1 L 1 ml·L-1 H2O2溶液中含有过氧化氢分子、水分子,则氢原子数目大于2NA,B错误;22.4 L氯气(1 ml)与56 g铁(1 ml)充分反应:2Fe+3Cl2 2FeCl3,氯气完全反应,Cl2~2e-,则转移的电子数为2NA,C错误;密闭容器中SO2和O2的反应为可逆反应,进行不完全,容器中分子数不为2NA,D错误。
2.(2023·吉林通化二模)设NA为阿伏加德罗常数的值。下列说法正确的是A.7.8 g Na2O2中所含阴离子数为0.1NAB.1 ml FeCl3完全反应制成胶体后,其中含有氢氧化铁胶粒数为NAC.1 ml N2和3 ml H2在一定条件下充分反应生成的NH3分子数为2NAD.常温下pH=2的醋酸溶液中含有的氢离子数为0.1NA
Na2O2中含有Na+和 ,7.8 g Na2O2的物质的量为0.1 ml,则阴离子数为0.1NA,A正确;1 ml FeCl3完全反应制成胶体后,其中含有氢氧化铁胶粒数小于NA,B错误;反应为可逆反应,生成的NH3分子数小于2NA,C错误;没有给出醋酸溶液的体积,无法算出氢离子数,D错误。
3.(2023·湖南娄底模拟预测)NA为阿伏加德罗常数的值。硫、氟及其化合物在生产、生活中有广泛应用。下列有关叙述正确的是A.0.2 ml H2S和0.3 ml SO2混合反应转移电子 数最多为0.4NAB.标准状况下,11.2 L HF含原子总数为NAC.1 ml SF6(如图所示)分子含σ键数为12NAD.32 g S8、S4、S2的混合物中含S原子数为2NA
2H2S+SO2===3S+2H2O,0.2 ml H2S与0.3 ml SO2完全反应,转移0.4 ml电子,A项正确;标准状况下,HF为液体,不确定其物质的量,B项错误;1个SF6分子含6个单键,则1 ml SF6分子含σ键数为6NA,C项错误;32 g硫的单质含1 ml S,含S原子数为NA,D项错误。
4.(2023·湖南永州二模)设NA为阿伏加德罗常数的值,下列说法正确的是A.2.0 g D218O中所含质子数为NAB.70 g C5H10的烃分子中含有C—C σ键的数目一定为4NAC.1 ml SO2与足量的O2反应,转移的电子数为2NAD.室温下34.2 g蔗糖完全水解生成的葡萄糖分子数为0.1NA
不确定该物质为环烷烃还是链烃,不能计算其C—C σ键的数目,B错误;二氧化硫和氧气反应为可逆反应,反应不完全,转移电子数小于2NA,C错误;1 ml蔗糖完全水解生成1 ml葡萄糖和1 ml果糖,34.2 g蔗糖为0.1 ml,完全水解生成的葡萄糖分子数为0.1NA,D正确。
5.设NA为阿伏加德罗常数的值,根据氯元素的“价—类”二维图,下列分析正确的是A.标准状况下,11.2 L CCl4所含共价 键数为2NAB.由“价—类”二维图推测ClONO2 可能具有强氧化性,1 ml ClONO2 水解生成两种酸时,转移电子数为2NAC.工业上用NaClO3和SO2制备1 ml ClO2时,消耗SO2分子数为0.5NAD.1 L 1 ml·L-1 NaClO溶液中含有ClO-数为NA
标准状况下,四氯化碳不是气体,11.2 L CCl4的物质的量不是0.5 ml,所含共价键数不是2NA,故A错误;ClONO2中Cl为+1价、N为+5价,ClONO2可能具有强氧化性,ClONO2可水解生成硝酸和次氯酸,反应不是氧化还原反应,故B错误;
1 L 1 ml·L-1 NaClO溶液中,次氯酸根离子水解,含有ClO-数小于NA,故D错误。
6.海水提溴过程中发生反应:3Br2+6Na2CO3+3H2O===5NaBr+NaBrO3+6NaHCO3,下列说法正确的是A.标准状况下,2 ml H2O的体积约为44.8 LB.1 L 0.1 ml·L-1 Na2CO3溶液中 的物质的量为0.1 mlC.反应中消耗3 ml Br2时,转移的电子数约为5×6.02×1023D.反应中氧化产物和还原产物的物质的量之比为5∶1
标准状况下,水是非气体,2 ml水的体积不是44.8 L,A项错误;
溴元素由0价变为+5价和-1价,反应中消耗3 ml Br2时,转移5 ml电子,故转移的电子数约为5×6.02×1023,C项正确;NaBrO3是氧化产物,NaBr是还原产物,两者的物质的量之比为1∶5,D项错误。
相关课件
这是一份专题一 选择题专攻 2.阿伏加德罗常数的应用 2024年高考化学二轮复习课件+讲义,文件包含专题一选择题专攻2阿伏加德罗常数的应用pptx、专题一选择题专攻2阿伏加德罗常数的应用教师版docx、专题一选择题专攻2阿伏加德罗常数的应用docx等3份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
这是一份2024年高考化学一轮复习阿伏加德罗常数的多维判断课件,共29页。PPT课件主要包含了解析3,返回2,随堂演练能力提升,解析28,返回27等内容,欢迎下载使用。
这是一份2023届高三化学高考备考二轮复习“阿伏加德罗常数”的应用课件,共59页。PPT课件主要包含了回扣自测,核心精讲,真题演练,考向预测,专题强化练等内容,欢迎下载使用。









