








所属成套资源:2024年高考化学二轮复习课件(含练习)
第一篇 主题二 题型抢分练-2024年高考化学二轮复习课件
展开
这是一份第一篇 主题二 题型抢分练-2024年高考化学二轮复习课件,文件包含第一篇主题二题型抢分练pptx、第一篇主题二题型抢分练docx等2份课件配套教学资源,其中PPT共44页, 欢迎下载使用。
A组1.设NA为阿伏加德罗常数的值。下列说法正确的是A.15 g 14C16O中含有的质子数目为8NAB.铅酸蓄电池中,当正极理论上增加3.2 g时,电路中通过的电子数目为 0.1NAC.1 L 0.1 ml·L-1的NaHCO3溶液中,阴离子总数小于0.1NAD.常温常压下,46 g NO2中所含的分子数目为NA
15 g 14C16O中含有的质子的物质的量为 ×(6+8)=7 ml,数目为7NA,A错误;正极由PbO2→PbSO4,每增重64 g转移2 ml电子,故正极增重3.2 g转移的电子数为0.1NA,B正确;NO2容易形成双聚分子N2O4,常温常压下,46 g NO2中所含的分子数目少于NA,D错误。
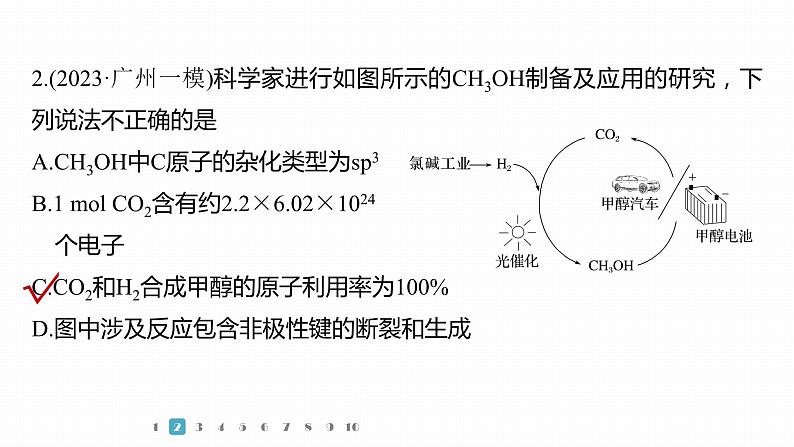
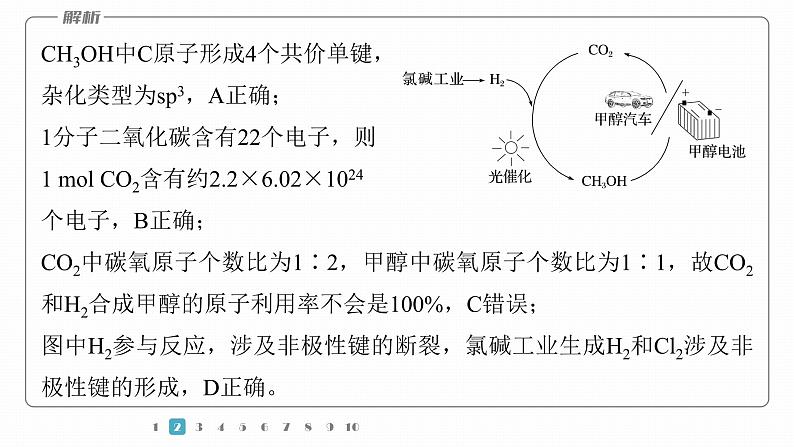
2.(2023·广州一模)科学家进行如图所示的CH3OH制备及应用的研究,下列说法不正确的是A.CH3OH中C原子的杂化类型为sp3B.1 ml CO2含有约2.2×6.02×1024 个电子C.CO2和H2合成甲醇的原子利用率为100%D.图中涉及反应包含非极性键的断裂和生成
CH3OH中C原子形成4个共价单键,杂化类型为sp3,A正确;1分子二氧化碳含有22个电子,则1 ml CO2含有约2.2×6.02×1024个电子,B正确;CO2中碳氧原子个数比为1∶2,甲醇中碳氧原子个数比为1∶1,故CO2和H2合成甲醇的原子利用率不会是100%,C错误;图中H2参与反应,涉及非极性键的断裂,氯碱工业生成H2和Cl2涉及非极性键的形成,D正确。
3.(2022·河南信阳二模)设NA为阿伏加德罗常数的值,下列说法正确的是A.常温常压下,1 ml Cl2溶于1.0 L H2O中,溶液中Cl-、HClO、ClO-的 个数之和为2NAB.46.0 g C2H6O完全燃烧,有5NA个C—H断裂C.56.0 g Fe与1.0 ml Br2反应,转移电子数为2NAD.标准状况下,11.2 L NH3与11.2 L HF均含有5NA个质子
Cl2与H2O的反应属于可逆反应,所得混合物中还含有Cl2,溶液中Cl-、HClO、ClO-的个数之和小于2NA,A错误;C2H6O有乙醇和甲醚两种不同的结构,若为乙醇,则46.0 g C2H6O中含有C—H的数目为5NA,若为甲醚,则46.0 g C2H6O中含有C—H的数目为6NA,B错误;56.0 g Fe与1.0 ml Br2反应时,铁过量,转移电子数取决于溴,则反应转移电子数为2NA,C正确;标准状况下HF不是气体,故11.2 L HF不为0.5 ml,无法计算所含质子数目,D错误。
4.(2023·郑州一模)设NA为阿伏加德罗常数的值,下列说法正确的是A.0.1 ml肼(N2H4)含有的孤电子对数为 g NaHSO4固体中含有0.4NA个阳离子C.电解饱和食盐水时,若阴阳两极产生气体的总体积为44.8 L,则转移电 子数为2NAD.0.1 ml CH3COOH与足量CH3CH2OH充分反应,生成0.1NA个CH3COOCH2CH3 分子
肼的电子式为 ,每个氮原子上各有1个孤电子对,故0.1 ml肼(N2H4)含有的孤电子对数为0.2NA,A正确;24 g NaHSO4的物质的量为 =0.2 ml,1 ml NaHSO4固体中含有1 ml Na+和1 ml ,故含有0.2NA个阳离子,B错误;没有说明是否为标准状况,无法计算气体的物质的量,C错误;乙酸和乙醇的反应为可逆反应,故生成的CH3COOCH2CH3分子数小于0.1NA,错误。
5.(2023·湖南常德一模)乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为:
以下叙述不正确的是A.乙烯氧化法中,生成0.1 ml乙醛时,转移的电子数约为1.204×1024B.C2H4的电子式为C.根据价层电子对互斥模型,18 g水的中心原子含有2 ml孤电子对D.44 g CH3CHO中sp3杂化的碳原子数目为NA
乙烯氧化法中氧元素化合价由0变为-2,电子转移关系为O2~2CH3CHO~4e-,生成0.1 ml乙醛时,转移的电子为0.2 ml,数目约为1.204×1023,A错误;H2O分子中中心O原子价层电子对数为2+ =4,含有2个孤电子对,则18 g水(为1 ml)的中心原子含有2 ml孤电子对,C正确;CH3CHO中甲基中碳原子采用sp3杂化,醛基上碳原子采用sp2杂化,故44 g CH3CHO中sp3杂化的碳原子数目为NA,D正确。
6.(2023·福建漳州模拟)硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革的还原剂,工业制取Na2S2O3的总化学方程式为2Na2S+Na2CO3+4SO2 ===3Na2S2O3+CO2。设NA为阿伏加德罗常数的值,下列说法正确的是A.常温常压下,22.4 L CO2中含有σ键个数为2NAB.每生成3 ml Na2S2O3,被氧化的SO2的物质的量为4 mlC.等物质的量的Na2S和Na2S2O3,阴、阳离子个数比均为2∶1D.生成47.4 g Na2S2O3转移电子数为0.8NA
常温常压下22.4 L CO2的物质的量不是1 ml,难以计算含有的 σ 键个数,A错误;在反应中SO2中硫元素化合价降低被还原,每生成3 ml Na2S2O3,被还原的SO2的物质的量为4 ml,B错误;等物质的量的Na2S和Na2S2O3中,阴、阳离子个数比均为1∶2,C错误;47.4 g Na2S2O3的物质的量为0.3 ml,每生成0.3 ml Na2S2O3消耗Na2S的物质的量为0.2 ml,1 ml Na2S参与反应转移4 ml电子,所以每生成47.4 g Na2S2O3转移电子数为0.8NA,D正确。
7.溶液中的Cu2+浓度可采用碘量法测得:
反应①中的氧化剂为Cu2+。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.100 0 ml·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,溶液中Cu2+的浓度为________ml·L-1。
n(Na2S2O3)=0.025 L×0.100 0 ml·L-1=2.5×10-3 ml,由反应①②可得关系式:
8.葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:葡萄酒样品100.00 mL 溶液出现蓝色且30 s内不褪色。已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI。按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量为______ g·L-1。
根据反应的化学方程式SO2+I2+2H2O===H2SO4+2HI,则样品中抗氧化剂的残留量为 =0.16 g·L-1。
9.将1.08 g FeO完全溶解在100 mL 1.00 ml·L-1硫酸中,然后加入25.00 mL K2Cr2O7溶液,恰好使Fe2+全部转化为Fe3+,且 中的铬全部转化为Cr3+。则K2Cr2O7的物质的量浓度是______________。
0.100 ml·L-1
10.某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 ml·L-1的酸性KMnO4溶液滴定,至终点时消耗KMnO4溶液体积为25.0 mL。提示:2Fe3++Cu===2Fe2++Cu2+,8H++ +5Fe2+===Mn2++5Fe3++4H2O。(1)计算该铁矿石中铁元素的质量分数:______。
(2)计算氧化物FemOn的化学式:_____________________(m、n为正整数)。
Fe5O7(或FeO·2Fe2O3)
B组1.(2023·广州二模)设NA为阿伏加德罗常数的值。下列叙述正确的是A.标准状况下,11.2 L Cl2溶于水生成Cl-的数目为 ℃时,1 L pH=8的CH3COONa溶液中水电离出的OH-数目为10-8NAC.等物质的量的Al分别与足量盐酸和NaOH溶液反应,转移的电子数均为 3NAD.常温常压下,3.4 g羟基(—OH)所含的电子数目为1.8NA
醋酸钠水解促进水的电离,pH=8,则pOH=4,则25 ℃时,1 L pH=8的CH3COONa溶液中水电离出的OH-数目为10-4NA,故B错误;不确定铝的物质的量,不能计算转移的电子数,故C错误;1个羟基—OH含有9个电子,3.4 g羟基为0.2 ml,所含的电子数目为1.8NA,故D正确。
2.(2022·海南模拟预测)设NA为阿伏加德罗常数的值。下列说法正确的是A.1 L 0.5 ml·L-1 H3PO4溶液中含H+数为1.5NAB.1 ml乙二醇(HOCH2CH2OH)中含sp3杂化的原子数为4NAC.80 g SO3、SO2的混合物中含有NA个硫原子D.1 ml乙炔中含有的π键数为NA
H3PO4部分发生电离,所以1 L 0.5 ml·L-1 H3PO4溶液中含H+数小于1.5NA,A不正确;乙二醇分子中的C、O原子都采取sp3杂化,1个乙二醇分子中有4个原子采取sp3杂化,所以1 ml乙二醇中含sp3杂化的原子数为4NA,B正确;80 g SO3的物质的量为1 ml,含硫原子个数为NA,80 g SO2的物质的量大于1 ml,含硫原子个数大于NA,所以80 g SO3、SO2的混合物中含有的硫原子数大于NA,C不正确;1个乙炔分子中含有2个π键,则1 ml乙炔中含有的π键数为2NA,D不正确。
3.(2022·陕西周至一模)若NA表示阿伏加德罗常数的值,则下列说法正确的是A.100 g质量分数为46%的酒精水溶液中含有氧原子数目为NAB.0.1 ml·L-1 CH3COOK溶液中含有CH3COO-数小于0.1NAC.标准状况下,1个O2分子的体积约为D.标准状况下,22.4 L O2与足量H2反应生成H2O,转移的电子数为4NA
乙醇和水分子中都含有氧原子,则100 g质量分数为46%的酒精水溶液中含有氧原子的数目大于NA,故A错误;溶液的体积未知,无法计算0.1 ml·L-1醋酸钾溶液中醋酸根离子的数目,故B错误;标准状况下,在粒子数目、粒子的大小相同的情况下,气体的体积主要与气体分子间的平均距离的大小有关,所以无法计算1个氧气分子的体积,故C错误;标准状况下,22.4 L氧气为1 ml,与足量氢气反应生成水时,转移的电子数目为4NA,故D正确。
4.(2023·四川绵阳二模)为防止水体富营养化,常用NaClO除去水体中过量氨氮(以NH3表示),气体产物为N2。设NA为阿伏加德罗常数的值。下列有关叙述正确的是A.NH3、H2O、OH-所含电子数均为10NAB.pH=11的NaClO溶液中H+数目为10-11NAC.反应消耗74.5 g NaClO,水体将增加NA个Cl-D.除氨氮过程中,当生成22.4 L N2时转移电子数为6NA
NH3、H2O、OH-所含电子数均为10,A错误;pH=11的NaClO溶液的体积未知,无法计算其溶液中H+数目,B错误;该反应的离子方程式为3ClO-+2NH3===N2+3Cl-+3H2O,所以反应消耗74.5 g(即1 ml NaClO),水体将增加NA个Cl-,C正确;氮气所处的状态未知,无法计算生成22.4 L N2时转移电子数,D错误。
5.(2023·济南模拟)设NA为阿伏加德罗常数的值。下列说法错误的是A.1 ml H2C2O4分子中π键的数目为3NAB.1 ml甲基正离子 的质子数为9NAC.1 ml [Cu(NH3)4]2+中配位原子的个数为4NAD.78 g Na2O2与足量SO2反应转移电子数为2NA
单键均为σ键,双键中含有1个π键、1个σ键,所以1 ml H2C2O4分子中π键的数目为2NA,A错误;1个甲基正离子 的质子数为9,则1 ml甲基正离子 的质子数为9NA,B正确;[Cu(NH3)4]2+中配体为NH3,配位原子为N,1 ml [Cu(NH3)4]2+中配位原子的个数为4NA,C正确;78 g Na2O2的物质的量为1 ml,与足量SO2反应生成硫酸钠,转移电子数为2NA,D正确。
6.(2022·合肥模拟预测)目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如图所示,其中“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。下列说法正确的是A.制备CuI过程中,消耗SO2与CuSO4 的物质的量之比为1∶2B.滤渣1能够完全溶解于稀硫酸中C.制得0.1 ml KIO3至少需要5.6 L Cl2D.制备KI时要控制溶液的pH不宜过大
根据反应方程式2SO2 +I2+2Cu2++4H2O===2CuI↓+ +8H+可知,制备CuI过程中,消耗SO2与CuSO4的物质的量之比为1∶1,A错误;分析可知,滤渣1的成分为Fe和Cu,其中Fe能与稀硫酸发生置换反应,而Cu不能与稀硫酸发生反应,B错误;
根据反应方程式5Cl2+I2+12OH-=== +10Cl-+6H2O可知,每制取得到2 ml KIO3,反应消耗5 ml Cl2,则制取0.1 ml KIO3,消耗0.25 ml Cl2,气体所处状态未知,无法计算其体积,C错误;
制备KI时,若溶液pH过大,Fe2+会反应生成Fe(OH)2沉淀,因此要控制溶液的pH不宜过大,D正确。
7.(2023·湖南岳阳一模)NA为阿伏加德罗常数的值,下列说法正确的是A.100 g 98%的硫酸溶液中H+的数目为2NAB.浓硝酸热分解生成NO2、N2O4共23 g时,转移电子数为0.5NAC.1 L 0.01 ml·L-1 溶液中, 和 的离子数 目之和为0.01NAD.锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、 b nm、c nm,α=β=γ=90°,则晶体的密度为 g·cm-3
98%的硫酸溶液为浓硫酸,主要以H2SO4分子存在,100 g 98%的硫酸溶液中H+的数目小于2NA,A错误;浓硝酸热分解生成NO2、N2O4共23 g,生成的NO2、N2O4中的N元素均为+4价,两者最简式均为NO2,可看做生成23 g NO2,即0.5 ml,转移电子数为0.5NA,B正确;
溶液中电离出的 既可以水解又可以电离,溶液中存在的粒子有 、 、 ,三者的数目之和为0.01NA,C错误;
8.在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3·7H2O的质量的比值随温度变化的关系如图所示。400 ℃时制得超细氧化铋,计算得出其化学式(写出计算过程,M[Bi2(C2O4)3·7H2O]=808 g·ml-1)。
9.利用CO与炉渣反应得到还原铁粉,得到的产品可用K2Cr2O7滴定分析法测定纯度。实验步骤如下:称取0.224 0 g样品,加入过量稀硫酸充分溶解,用3.000×10-2 ml·L-1 K2Cr2O7溶液滴定至终点(滴定过程中与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液20.00 mL,计算该样品中还原铁粉的质量分数(写出计算过程)。
答案 根据得失电子守恒可得关系: ~6Fe2+,滴定中消耗n(K2Cr2O7)=3.000×10-2ml·L-1×20.00×10-3 L=6×10-4 ml,则n(Fe2+)=6n(K2Cr2O7)=3.6×10-3ml,根据铁元素守恒可知样品中铁粉的质量为3.6×10-3 ml×56 g·ml-1=0.201 6 g,质量分数为 ×100%=90.00%。
10.[2021·山东,18(3)]六氯化钨(WCl6)可用作有机合成催化剂,熔点为283 ℃,沸点为340 ℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6。利用碘量法测定WCl6产品纯度,实验如下:①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1 g;开盖并计时1分钟,盖紧称重为m2 g;再开盖加入待测样品并计时1分钟,盖紧称重为m3 g,则样品质量为______________g(不考虑空气中水蒸气的干扰)。
称量时加入足量的CS2,盖紧称重为m1 g,由于CS2易挥发,开盖时要挥发出来,称量的质量要减少,开盖并计时1分钟,盖紧称重为m2 g,则挥发出的CS2的质量为(m1-m2)g,再开盖加入待测样品并计时1分钟,又挥发出(m1-m2)g的CS2,盖紧称重为m3 g,则样品质量为m3 g+2(m1-m2)g-m1 g=(m3+m1-2m2)g。
滴定达终点时消耗c ml·L-1的Na2S2O3溶液V mL,则样品中WCl6(摩尔质量为M g·ml-1)的质量分数为___________________。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将_______(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将______(填“偏大”“偏小”或“不变”)。
根据测定原理,称量时,若加入待测样品后,开盖时间超过1分钟,挥发的CS2的质量增大,m3偏小,但WCl6的质量不变,则滴定时消耗Na2S2O3溶液的体积将不变,样品中WCl6质量分数的测定值将偏大。
相关课件
这是一份第一篇 主题三 选择题5 氧化还原反应的规律及应用-2024年高考化学二轮复习课件,文件包含第一篇主题三选择题5氧化还原反应的规律及应用pptx、第一篇主题三选择题5氧化还原反应的规律及应用docx、第一篇主题三选择题5氧化还原反应的规律及应用学生版docx等3份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
这是一份第一篇 主题二 热点题空1 关系式法、守恒法在化学计算中的应用-2024年高考化学二轮复习课件,文件包含第一篇主题二热点题空1关系式法守恒法在化学计算中的应用pptx、第一篇主题二热点题空1关系式法守恒法在化学计算中的应用docx、第一篇主题二热点题空1关系式法守恒法在化学计算中的应用学生版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
这是一份第一篇 主题二 选择题4 阿伏加德罗常数应用判断-2024年高考化学二轮复习课件,文件包含第一篇主题二选择题4阿伏加德罗常数应用判断pptx、第一篇主题二选择题4阿伏加德罗常数应用判断docx、第一篇主题二选择题4阿伏加德罗常数应用判断学生版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。









