









第一篇 主题三 题型抢分练-2024年高考化学二轮复习课件
展开A组1.(2023·山东临沂一模)古文献《余冬录》中对胡粉[主要成分为2PbCO3·Pb(OH)2]制法的相关描述:“铅块悬酒缸内,封闭四十九日,开之则化为粉矣。化不白者(Pb),炒为黄丹(Pb3O4)。黄丹滓为密陀僧(PbO)”。下列说法错误的是A.2PbCO3·Pb(OH)2属于碱式盐B.Pb3O4与硫酸反应只生成PbSO4和水C.“化不白者,炒为黄丹”的过程中发生了氧化还原反应D.“密陀僧”与碳粉高温加热可以制得铅
2PbCO3·Pb(OH)2属于碱式盐,A正确;Pb3O4中铅的化合价是+2和+4,所以与硫酸反应生成的盐不是只有PbSO4,B错误;“化不白者,炒为黄丹”的过程中铅被氧化成Pb3O4,发生了氧化还原反应,C正确;“密陀僧”(PbO)与碳粉高温加热,碳作还原剂可以制得铅,D正确。
2.(2023·吉林辽源二模)下列实验设计及其对应的离子方程式均正确的是A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2OB.向MgCl2溶液中加入氨水制备Mg(OH)2:Mg2++2OH-===Mg(OH)2↓C.用漂白粉溶液脱除废气中的SO2:Ca2++2ClO-+SO2+H2O=== CaSO3↓+2HClOD.泡沫灭火器的工作原理:2Al3++ +3H2O===2Al(OH)3↓+3CO2↑
一水合氨为弱碱,反应为Mg2++2NH3·H2O===Mg(OH)2↓+ ,B错误;用漂白粉溶液脱除废气中的SO2,二氧化硫会被次氯酸根离子氧化为硫酸根离子:Ca2++SO2+3ClO-+H2O===CaSO4↓+Cl-+2HClO,C错误;泡沫灭火器的工作原理是铝离子和碳酸氢根离子反应生成氢氧化铝沉淀和二氧化碳:Al3++ ===Al(OH)3↓+3CO2↑,D错误。
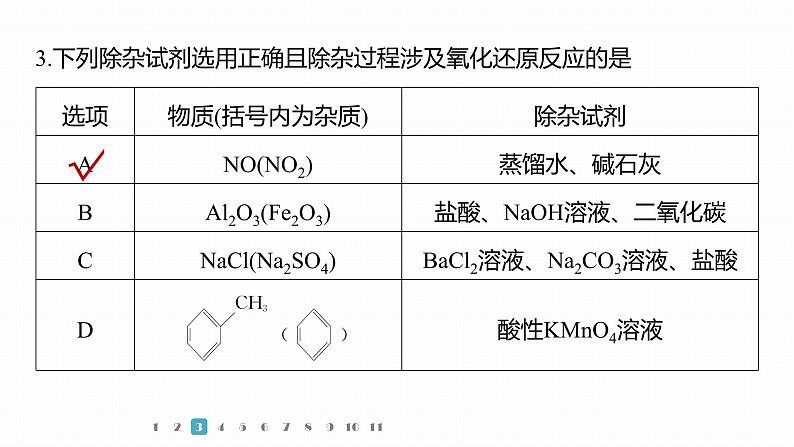
3.下列除杂试剂选用正确且除杂过程涉及氧化还原反应的是
除去NO中的NO2,先通入蒸馏水中,发生反应:3NO2+H2O=== 2HNO3+NO,再通过碱石灰干燥得到纯净的NO,其除杂过程涉及氧化还原反应,故A选;除去Al2O3中含有的Fe2O3,先加入盐酸,涉及反应Al2O3+6H+=== 2Al3++3H2O、Fe2O3+6H+===2Fe3++3H2O,再加入过量NaOH溶液,过滤,向滤液中通入过量二氧化碳,得到Al(OH)3沉淀,加热分解得到
除去NaCl中含有的Na2SO4,先加过量BaCl2溶液发生反应Ba2++===BaSO4↓,再加过量Na2CO3溶液发生反应Ba2++ ===BaCO3↓,过滤,最后向滤液中加入盐酸调pH至中性,发生反应 +2H+=== CO2↑+H2O,然后蒸发结晶得到NaCl,不涉及氧化还原反应,故C不选;除去甲苯中的苯,加入酸性KMnO4溶液,主体物质甲苯被氧化,没有达到除杂目的,故D不选。
4.(2023·南京中华中学调研)化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是A.用食醋除去水壶内的水垢:CaCO3+2H+===Ca2++CO2↑+H2OB.纯碱溶液呈碱性的原因: +2H2O H2CO3+2OH-C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O===4OH-D.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH= -571.6 kJ·ml-1
CH3COOH是弱电解质,不可拆分,A错误;纯碱溶液呈碱性是由于 的水解,而 的水解是分步的,B错误;钢铁发生吸氧腐蚀时,正极上O2得到电子发生还原反应,故正极反应式为O2+4e-+2H2O===4OH-,C正确;表示H2燃烧热的热化学方程式中,H2前的化学计量数应为1,D错误。
5.(2023·郑州模拟)能正确表示下列反应的离子方程式的是A.将H2O2溶液滴入NaCl溶液中:H2O2+2Cl-===2OH-+Cl2↑B.将NO2通入NaOH溶液中:C.FeI2溶液中通入少量Cl2:Cl2+2Fe2+===2Fe3++2Cl-D.明矾溶液中滴入Ba(OH)2溶液使 恰好完全沉淀:2Ba2++3OH- +Al3++ ===2BaSO4↓+Al(OH)3↓
氧化性:Cl2>H2O2,因此H2O2不能将Cl-氧化为Cl2,A错误;将NO2通入NaOH溶液,反应生成NaNO3、NaNO2和水,离子方程式为I-还原性强于Fe2+,通入少量Cl2先与I-反应,离子方程式为2I-+Cl2 ===I2+2Cl-,C错误;正确的离子方程式为+2H2O,D错误。
6.(2022·湖南,9)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的 转化为N2进入大气层,反应过程如图所示。
7.氯化钯可以催化乙烯制备乙醛(Wacker法),反应过程如图:
下列叙述错误的是A.CuCl被氧化的反应为2CuCl +2HCl+ O2===2CuCl2+ H2OB.催化剂PdCl2再生的反应为 2CuCl2+Pd===PdCl2+2CuClC.制备乙醛的总反应为CH2==CH2+ CH3CHOD.如果原料为丙烯,则主要产物是丙醛
若原料为丙烯,则得到的产物为丙酮,D错误。
8.(2023·湖南邵阳一模)用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2,下列说法正确的是A.a气体是氯气,b气体是氢气B.食盐水电解槽内每生成1 ml a气体,转移1 ml e-C.ClO2发生器中阴极的电极反 应式为 +2H++e-===ClO2↑+H2OD.为使a、b气体恰好完全反应,理论上每生产1 ml ClO2需要补充44.8 L b气体
由题给流程可知,食盐水电解槽内发生的反应为电解饱和食盐水得到氯酸钠和氢气,则a为氢气;氯酸钠溶液和盐酸在二氧化氯发生器中电解得到氯化钠、氯气、二氧化氯气体和水,则b为氯气,故A错误;食盐水电解槽内每生成1 ml 氢气,转移电子的物质的量为2 ml,故B错误;缺标准状况,无法计算每生产1 ml二氧化氯需要补充氯气的体积,故D错误。
9.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 。(1)请写出金属钒与浓硝酸反应的离子方程式:_______________________________________。(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:_________________________________。(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:____________________________________________。
+5NO2↑+3H2O
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为 ),溶于强酸生成含钒氧离子( )的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_________、___________。(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450 ℃时发生V2O5与VO2之间的转化:V2O5+SO2===2VO2+SO3、4VO2+O2 ===2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是____________________。
10.工业上利用氟碳铈矿(主要成分为CeCO3F)提取CeCl3的一种工艺流程如图。
请回答下列问题:(1)“氧化焙烧”的化学方程式为________________________________________________。(2)“酸浸”的离子方程式为______________________________________。
2CeO2+6H++H2O2===2Ce3++4H2O+O2↑
11.硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式:__________________________________________。(2)“净化除杂”需先加H2O2溶液,作用是_________________;然后再调节溶液的pH约为5,目的是___________________________________。
Mg2B2O5·H2O+2H2SO4
===2MgSO4+2H3BO3
将Fe2+氧化为Fe3+
使Al3+与Fe3+形成氢氧化物沉淀而除去
(3)“粗硼酸”中的主要杂质是________(填名称)。(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______________。(5)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:___________________________________________________。
B组1.(2023·广东茂名一模)植物对氮元素的吸收过程如下,下列说法正确的是
A.高温有利于加快过程①B.浇水和松土有利于过程②C.过程③中 被还原D.过程④叫做氮的固定
过程①有根瘤菌参与催化,不能高温下进行,A错误;
氮的固定是将空气中游离态的氮转化为含氮化合物的过程,过程④是氮的化合物中氮的转变,D错误。
2.(2023·北京顺义一模)下列方程式与所给事实不相符的是A.用碳酸钠溶液处理锅炉水垢:B.Cl2通入水中制氯水:Cl2+H2O 2H++Cl-+ClO-C.氢氧化亚铁暴露于空气中变色:4Fe(OH)2+O2+2H2O===4Fe(OH)3D.常温下0.1 ml·L-1氨水的pH约为11:NH3·H2O +OH-
3.(2023·成都调研)我国城市自来水厂现常用ClO2替代氯气消毒,工业上可用2NaClO3+SO2+X===2ClO2+2NaHSO4 制备ClO2,下列说法错误的是A.X为H2SO4B.反应中还原产物与氧化产物的物质的量之比为1∶1C.该反应中SO2只作还原剂D.该反应中氧化性强弱顺序为NaClO3>NaHSO4
根据元素守恒可知,X为H2SO4,A正确;该反应中二氧化硫中的硫由+4价变为+6价,则1个硫酸氢钠为氧化产物,氯酸钠中的+5价的氯变为+4价的氯,则2个ClO2为还原产物,则还原产物与氧化产物的物质的量之比为2∶1,B错误;由选项B分析可知,二氧化硫为还原剂,C正确;在该反应中氯酸钠是氧化剂,硫酸氢钠为氧化产物,则氧化性强弱顺序为NaClO3>NaHSO4,D正确。
4.(2023·河南驻马店高三模拟)在高温条件下,碳酸锂(Li2CO3)、葡萄糖(C6H12O6)和磷酸铁(FePO4)可制备电极材料磷酸亚铁锂(LiFePO4),发生反应的化学方程式为12FePO4+6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑。下列说法错误的是A.反应中氧化剂和还原剂的物质的量之比为12∶1B.反应中LiFePO4是还原产物,CO是氧化产物C.生成1 ml LiFePO4时,转移2 ml电子D.1 ml H2O中所含的中子总数为8NA
反应12FePO4+6Li2CO3+C6H12O6 12LiFePO4+6CO↑+6CO2↑+6H2O↑中铁元素化合价从+3价降低到+2价,FePO4是氧化剂,葡萄糖中碳元素化合价从0价升高到+2价,葡萄糖是还原剂,因此氧化剂和还原剂的物质的量之比为12∶1,A正确;FePO4是氧化剂,LiFePO4是还原产物,葡萄糖是还原剂,CO是氧化产物,B正确;铁元素化合价从+3价降低到+2价,生成1 ml LiFePO4时,转移1 ml电子,C错误;H2O中含有8个中子,1 ml H2O中所含的中子总数为8NA,D正确。
5.(2023·上海一模)以卤水(富含I-)为原料用高分子树脂提取碘的工艺流程如图所示,下列说法错误的是
A.“氧化1”过程既可以用Cl2,也可以用H2O2B.“解脱”过程指在酸性条件下用Na2SO3将I2还原为I-,离子方程式为C.用高分子树脂“吸附”,再“解脱”是为了便于分离富集碘元素D.“提纯”过程是先萃取分液、蒸馏得到粗产品,再升华纯化
“氧化1”过程既可以用Cl2,也可以用H2O2,原理分别为2I-+Cl2=== 2Cl-+I2,2I-+H2O2+2H+===I2+2H2O,A正确;“解脱”过程指在酸性条件下用Na2SO3将I2还原为I-,故其离子方程式为 ,B错误;由于海水中I-的浓度非常小,故用高分子树脂“吸附”,再“解脱”是进行分离富集碘元素,C正确;
由于I2在水中的溶解度非常小,而易溶于有机溶剂苯或CCl4中,且具有升华的性质,故“提纯”过程是先萃取分液,得到I2的有机溶液,然后再蒸馏得到粗产品,再升华纯化,D正确。
6.已知HClO的电离常数Ka介于H2CO3的Ka1与Ka2之间,能正确表示下列反应的离子方程式的是A.向等物质的量浓度的NaOH和Na2CO3的混合溶液中滴加3倍体积的等 浓度的稀盐酸:B.将少量的双氧水滴入酸性高锰酸钾溶液中:7H2O2+ +6H+ ===10H2O+2Mn2++6O2↑C.将少量SO2通入“84”消毒液中:SO2+3ClO-+H2O=== 2HClOD.将少量氯气通入纯碱溶液中:
7.(2023·福建泉州模拟)检验 的反应有如下两种途径。下列说法正确的是A.反应①中 被还原B.乙醚与CrO5中的铬元素形成共 价键,有利于蓝色现象的观察C.反应②为2CrO5·O(C2H5)2+6H+ ===2Cr3++3O2↑+3H2O+2C2H5OC2H5D.反应③中溶液的pH越小,反应速率越慢
反应① 、CrO5中Cr元素化合价均为+6,此反应不是氧化还原反应,A错误;由题中信息乙醚与CrO5中的铬元素形成共价键,蓝色可稳定几分钟,有利于蓝色现象的观察,B正确;反应②为4CrO5·O(C2H5)2+12H+===4Cr3++7O2↑+6H2O+4C2H5OC2H5,C错误;反应③ +8H++3H2O2===3O2↑+2Cr3++7H2O,溶液的pH越小,H+浓度越大,反应速率越快,D错误。
8.过一硫酸氢钾(KHSO5)因其可提供超强有效的非氯氧化电势和微生物效能,而被广泛应用于工业生产和消毒领域,把一片过一硫酸氢钾片剂放入装有适量稀盐酸的烧杯中,很快就可以明显闻到有刺激性气味且持续一定时间,写出该反应的离子方程式:__________________________________________。
9.(2023·福建一模)某工厂利用如下流程处理废旧电池正极材料(主要成分为LiCO2、LiMn2O4、LiFePO4),制备三元锂电池正极材料 。
回答下列问题:(1)“酸浸”中LiCO2发生反应的离子方程式为___________________________________________________;H2O2也与部分LiFePO4发生了反应,“酸浸”中H2O2的作用是________________。
2LiCO2+H2O2+6H+
===2C2++2Li++O2↑+4H2O
(2) 与Li2CO3焙烧生成 的总反应方程式为______________________________________________________________。
10.锰广泛存在于自然界中,工业可用软锰矿(主要成分是MnO2)制备锰。资料:①MnCO3难溶于水,可溶于稀酸。②在Mn2+催化下,SO2在水溶液中被氧化成H2SO4。Ⅰ.制备(1)写出铝热法还原MnO2制备锰的化学方程式:_______________________________。
铝热法还原MnO2制备锰即高温条件下铝单质和MnO2反应得到氧化铝和Mn单质,化学方程式为4Al+3MnO2 3Mn+2Al2O3。
(2)工业上制备锰时,会产生大量废水和锰渣。锰渣煅烧会产生含高浓度SO2的烟气,可用以下方法处理。方法一:①用软锰矿进行脱硫可生成硫酸锰,从而达到资源的循环使用。写出一定条件下利用MnO2进行脱硫的化学方程式:__________________________。
根据题意可知MnO2会将SO2氧化得到MnSO4,化学方程式应为MnO2+SO2 MnSO4。
②研究表明,用Fe2+/Fe3+可强化脱硫效果,其过程如图所示:
过程Ⅰ:……过程Ⅱ:2Fe3++SO2+2H2O===2Fe2++ +4H+过程Ⅰ的离子方程式是_________________________________________。
2Fe2++MnO2+4H+===Mn2++2Fe3++2H2O
方法二:③用MnCO3进行脱硫,可提高脱硫率。结合化学用语解释原因:___________________________________________________________________________________________________________________________________________________________________________。
Ⅱ.废水中锰含量的测定(3)取1 mL废水置于20 mL磷酸介质中,加入HClO4 ,将溶液中的Mn2+氧化为Mn3+,用c ml·L-1 (NH4)2 Fe(SO4)2溶液进行滴定,达到滴定终点时,滴定管刻度由V0 mL变为V1 mL,废水中锰的含量为__________________ g·mL-1。
55c(V1-V0)×10-3
滴定时发生反应:Fe2++Mn3+===Fe3++Mn2+,所以n(Mn)=n(Mn3+)=c(V1-V0)×10-3 ml,所取废水为1 mL,所以废水中锰的含量为55c(V1-V0)×10-3 g·mL-1。
11.湿法炼锌净化钴渣中含有Zn、C、Cu、Fe的单质及Zn(OH)2,可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:
回答下列问题:(1)“酸浸”时,将钴渣研细的目的是__________________________________________________。
增大与酸的接触面积,加快酸浸
(2)写出酸浸时,可能发生反应的离子方程式为____________________________________________________________________________________________________。(3)“除铁”工艺中H2O2的作用,用离子方程式表示_________________________________,由流程可知:C2+的还原性______(填“强于”或“弱于”)Fe2+。
Zn+2H+===Zn2++H2↑、
C+2H+===C2++H2↑、Fe+2H+===Fe2++H2↑、Zn(OH)2+2H+===Zn2++2H2O
2Fe2++H2O2+2H+
===2Fe3++2H2O
(4)氨水可代替沉钴工序中的NaOH生成滤渣Ⅱ,发生反应的离子方程式为_____________________________________________________。
第一篇 主题三 选择题6 离子反应及离子方程式-2024年高考化学二轮复习课件: 这是一份第一篇 主题三 选择题6 离子反应及离子方程式-2024年高考化学二轮复习课件,文件包含第一篇主题三选择题6离子反应及离子方程式pptx、第一篇主题三选择题6离子反应及离子方程式docx、第一篇主题三选择题6离子反应及离子方程式学生版docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
第一篇 主题三 选择题5 氧化还原反应的规律及应用-2024年高考化学二轮复习课件: 这是一份第一篇 主题三 选择题5 氧化还原反应的规律及应用-2024年高考化学二轮复习课件,文件包含第一篇主题三选择题5氧化还原反应的规律及应用pptx、第一篇主题三选择题5氧化还原反应的规律及应用docx、第一篇主题三选择题5氧化还原反应的规律及应用学生版docx等3份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
第一篇 主题二 题型抢分练-2024年高考化学二轮复习课件: 这是一份第一篇 主题二 题型抢分练-2024年高考化学二轮复习课件,文件包含第一篇主题二题型抢分练pptx、第一篇主题二题型抢分练docx等2份课件配套教学资源,其中PPT共44页, 欢迎下载使用。












