











所属成套资源:2024年高考化学二轮复习课件(含练习)
第一篇 主题五 综合大题题型研究(Ⅰ)——化学实验 类型2 以有机物制备、提取、纯化为主线的综合实验-2024年高考化学二轮复习课件
展开
这是一份第一篇 主题五 综合大题题型研究(Ⅰ)——化学实验 类型2 以有机物制备、提取、纯化为主线的综合实验-2024年高考化学二轮复习课件,文件包含第一篇主题五综合大题题型研究Ⅰ化学实验类型2以有机物制备提取纯化为主线的综合实验pptx、第一篇主题五综合大题题型研究Ⅰ化学实验类型2以有机物制备提取纯化为主线的综合实验docx、第一篇主题五综合大题题型研究Ⅰ化学实验类型2以有机物制备提取纯化为主线的综合实验学生版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
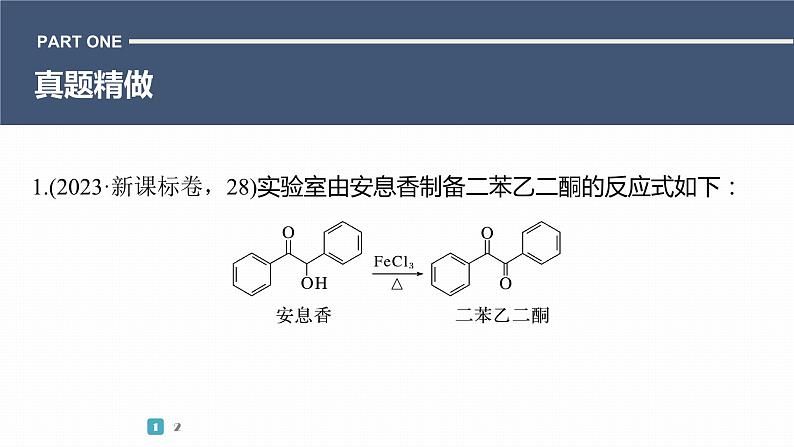
1.(2023·新课标卷,28)实验室由安息香制备二苯乙二酮的反应式如下:
装置示意图如右图所示,实验步骤为:①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。
③加入50 mL水,煮沸后冷却,有黄色固体析出。④过滤,并用冷水洗涤固体3次,得到粗品。⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。
回答下列问题:(1)仪器A中应加入______(填“水”或“油”)作为热传导介质。
该实验需要加热使冰乙酸沸腾,冰乙酸的沸点超过了100 ℃,应选择油浴加热。
(2)仪器B的名称是____________;冷却水应从______(填“a”或“b”)口通入。
根据仪器的结构特征可知,B为球形冷凝管,为了充分冷却,冷却水应从a口进,b口出。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_________。
步骤②中,若沸腾时加入安息香,会引起暴沸,所以需要待沸腾平息后加入。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为________;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行?_______,简述判断理由___________________________________________________________。
FeCl3为氧化剂,则铁元素的化合价降低,还原产物为FeCl2,若采用催化量的FeCl3并通入空气制备二苯乙二酮,空气可以将还原产物FeCl2又氧化为FeCl3,FeCl3可循环参与反应。
产物FeCl2又氧化为FeCl3,FeCl3可循环参与反应
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止_____________。
氯化铁易水解,所以步骤①~③中,乙酸除做溶剂外,另一主要作用是防止氯化铁水解。
(6)若粗品中混有少量未氧化的安息香,可用少量_____洗涤的方法除去(填字母)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水 b.乙酸c.冷水 d.乙醇
根据安息香和二苯乙二酮的溶解特征,安息香溶于热水,二苯乙二酮不溶于水,所以可以用热水洗涤粗品除去安息香。
(7)本实验的产率最接近于______(填字母)。a.85% b.80%c.75% d.70%
2.0 g安息香(C14H12O2)的物质的量约为0.009 4 ml,理论上可产生二苯乙二酮(C14H10O2)的物质的量约为0.009 4 ml,质量约为1.98 g,产率为 ×100%≈80.8%,最接近80%。
2.(2023·辽宁,17)2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。Ⅳ.水解。恢复室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
回答下列问题:(1)步骤Ⅰ中液体A可以选择_____。a.乙醇 b.水c.甲苯 d.液氨
步骤Ⅰ制钠砂过程中,液体A不能和Na反应,而乙醇、水和液氨都能和金属Na反应,故选c。
(2)噻吩沸点低于吡咯( )的原因是_________________________________________。(3)步骤Ⅱ的化学方程式为_________________________________。
吡咯中含有—NH—,可以形成
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是____________________________________________________。(5)步骤Ⅳ中用盐酸调节pH的目的是______________________________________。
将环氧乙烷溶液沿烧杯壁缓缓加入,并不断用玻璃棒搅拌
与水解生成的OH-反应,使水解更
2-噻吩乙醇钠水解生成2-噻吩乙醇的过程中有NaOH生成,用盐酸调节pH的目的是将NaOH中和,使平衡正向移动,增大反应物的转化率。
(6)下列仪器在步骤Ⅴ中无需使用的是______________________(填名称):无水MgSO4的作用为________。
步骤Ⅴ中的操作有过滤、蒸馏,蒸馏的过程中需要直形冷凝管不能用球形冷凝管,无需使用的是球形冷凝管和分液漏斗。
(7)产品的产率为________(用Na计算,精确至0.1%)。
解有机物制备类实验题的思维模型
1.己二酸是一种二元弱酸,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。制备己二酸的一种反应机理如下: +HNO3(浓) HOOC(CH2)4COOH+NO2↑+H2O(未配平)。制备己二酸的装置如图所示(夹持、加热装置省略)。向三颈烧瓶中加入2 mL 浓HNO3,再缓慢滴加1.5 g环己醇,保持80 ℃持续反应2 h。反应结束冷却至室温后,在冰水浴中继续冷却,分离出己二酸粗品。
(1)图中冷凝管的名称:_____________,冷却水从______(填“a”或“b”)口流入。(2)为了防止污染空气,图中还缺少的装置是___________________。
根据题目中的已知信息判断有污染性气体二氧化氮产生,故需要尾气处理。
(3)将己二酸粗品提纯的方法是________,洗涤沉淀的方法为______(填字母)。A.用乙醇洗涤B.用乙醇的水溶液洗涤C.用冰水洗涤
因为己二酸常温下为固体,温度较低时会从溶液中析出,所以己二酸粗品提纯的方法是重结晶;己二酸在温度较低时溶解度小,为了减小洗涤时溶解损耗,洗涤沉淀的方法为冰水洗涤。
(4)若制得纯己二酸的质量为1.5 g,则己二酸的产率为________(结果保留一位小数)。
(5)环己烯、环己酮也可被双氧水氧化成己二酸。所需双氧水理论用量环己烯________(填“大于”“小于”或“等于”)环己酮。
根据环己烯、环己酮的分子式的特点与双氧水的分子式判断,生成己二酸所需双氧水的量少的是环己酮。
2.(2023·成都校联考二模)对乙酰氨基酚( ,M=151 g·ml-1)具有解热镇痛的效果,其解热作用缓慢而持久,具有刺激性小、极少有过敏反应等优点。某化学小组在实验室进行对乙酰氨基酚的制备、物质转化流程如下(部分产物已略去):
(1)步骤Ⅰ中,亚硝酸因不稳定易分解产生体积比为1∶1的NO和NO2,工业上常通入空气进行废物利用制备硝酸,请写出该反应的化学方程式:_______________________________。
H2O+NO+NO2+O2===2HNO3
(2)步骤Ⅱ为对亚硝基苯酚的还原过程,其装置如图1所示。该化学小组通过实验测定了不同温度下对亚硝基苯酚的还原产率,数据如下表:
①通过实验,步骤Ⅱ中最佳反应温度为______℃。
由不同温度下对亚硝基苯酚的还原产率数据可知,45 ℃时步骤Ⅱ中对亚硝基苯酚还原产率最高。
②该反应放热易导致反应速率过快,要适当控制反应速率,结合装置最有效的操作是_________________________。
该反应放热易导致反应速率过快,可以通过关闭分液漏斗并停止加热的方式来控制反应速率。
③步骤Ⅱ中主要发生的反应为
化学反应中通常可以采取增加某种反应物的用量的措施来提高另一种反应物的转化率。
实际操作中,硫化钠的实际用量比理论量高些,其目的是____________________________。
(3)步骤Ⅲ中须用硫酸酸化步骤Ⅱ反应后的混合溶液,以便析出对氨基苯酚。若加入硫酸过多、过快,可能导致发生副反应的离子方程式为_________________________________。
步骤Ⅱ反应后的混合溶液中含有对氨基苯酚钠( )、Na2S2O3,步骤Ⅲ中用硫酸酸化以析出对氨基苯酚,若加入硫酸过多、过快,可能导致Na2S2O3与硫酸发生反应生成S和SO2。
(4)步骤Ⅳ为对氨基苯酚的乙酰化反应,实验装置如图2所示。其中,冷凝管的进水口是______(填“a”或“b”);反应结束后,得到的晶体需用冰水洗涤,其目的是__________________________________。
洗去杂质并降低对乙酰氨基酚的损失
球形冷凝管进出水是下进上出,所以进水口是a;根据流程,步骤Ⅳ是将对氨基苯酚( )转化为对乙酰氨基酚( ),反应结束后,得到的
晶体用冰水洗涤的目的是洗去杂质并降低对乙酰氨基酚的损失。
(5)该化学小组用0.2 ml苯酚进行实验,该实验中对乙酰氨基酚总产率为55%,实际得到对乙酰氨基酚________g。
用0.2 ml苯酚进行实验,则理论上生成0.2 ml对乙酰氨基酚,质量为0.2 ml×151 g·ml-1=30.2 g,已知该实验中对乙酰氨基酚总产率为55%,则实际产量为30.2 g×55%=16.61 g。
相关课件
这是一份第一篇 主题五 综合大题题型研究(Ⅰ)——化学实验 类型3 以物质性质探究为主的综合实验-2024年高考化学二轮复习课件,文件包含第一篇主题五综合大题题型研究Ⅰ化学实验类型3以物质性质探究为主的综合实验pptx、第一篇主题五综合大题题型研究Ⅰ化学实验类型3以物质性质探究为主的综合实验docx、第一篇主题五综合大题题型研究Ⅰ化学实验类型3以物质性质探究为主的综合实验学生版docx等3份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
这是一份第一篇 主题五 综合大题题型研究(Ⅰ)——化学实验 类型1 以无机物制备为主线的综合实验-2024年高考化学二轮复习课件,文件包含第一篇主题五综合大题题型研究Ⅰ化学实验类型1以无机物制备为主线的综合实验pptx、第一篇主题五综合大题题型研究Ⅰ化学实验类型1以无机物制备为主线的综合实验docx、第一篇主题五综合大题题型研究Ⅰ化学实验类型1以无机物制备为主线的综合实验学生版docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
这是一份第一篇 主题五 热点题空8 有机物制备实验中产率的计算-2024年高考化学二轮复习课件,文件包含第一篇主题五热点题空8有机物制备实验中产率的计算pptx、第一篇主题五热点题空8有机物制备实验中产率的计算docx、第一篇主题五热点题空8有机物制备实验中产率的计算学生版docx等3份课件配套教学资源,其中PPT共14页, 欢迎下载使用。









