









所属成套资源:2024年高考化学二轮复习课件(含练习)
第一篇 主题十 综合大题题型研究(Ⅳ)——工艺流程-2024年高考化学二轮复习课件
展开
这是一份第一篇 主题十 综合大题题型研究(Ⅳ)——工艺流程-2024年高考化学二轮复习课件,文件包含第一篇主题十综合大题题型研究Ⅳ工艺流程pptx、第一篇主题十综合大题题型研究Ⅳ工艺流程docx、第一篇主题十综合大题题型研究Ⅳ工艺流程学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
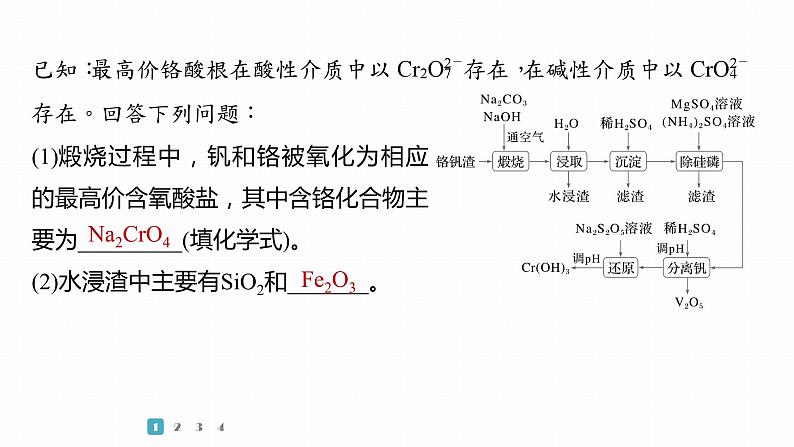
1.(2023·新课标卷,27)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为_________(填化学式)。(2)水浸渣中主要有SiO2和_______。
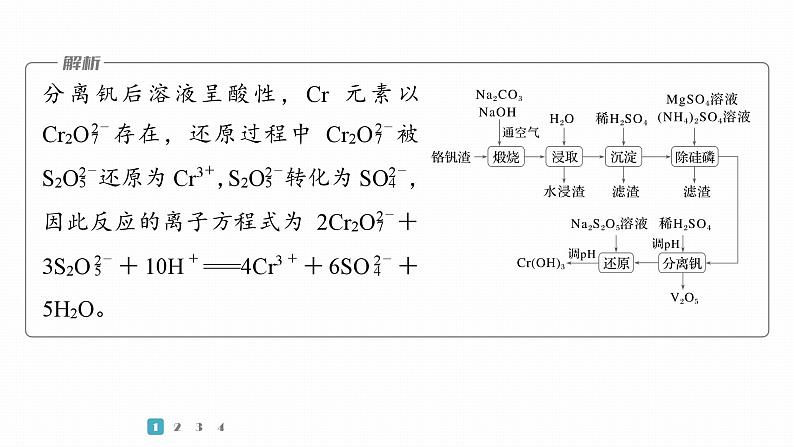
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是________。(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH9时,会导致______________________________________________。
成Mg(OH)2沉淀,不利于形成MgSiO3沉淀
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为____________________________________________。
2.(2023·湖北,16)SiCl4是生产多晶硅的副产物。利用SiCl4对废弃的锂电池正极材料LiCO2进行氯化处理以回收Li、C等金属,工艺路线如下:
回答下列问题:(1)C位于元素周期表第___周期,第___族。(2)烧渣是LiCl、CCl2和SiO2的混合物,“500 ℃焙烧”后剩余的SiCl4应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因________________________________________________________________________________________________。
SiCl4+3H2O===H2SiO3+4HCl[或SiCl4+4H2O===H4SiO4+4HCl或SiCl4+(2+n)H2O===SiO2·nH2O+4HCl]
(3)鉴别洗净的“滤饼3”和固体Na2CO3常用方法的名称是_________。
由流程和题中信息可知,LiCO2粗品与SiCl4在500 ℃焙烧时生成氧气和烧渣,烧渣是LiCl、CCl2和SiO2的混合物;烧渣经水浸、过滤后得滤液1和滤饼1,滤饼1的主要成分是SiO2和H2SiO3;滤液1用氢氧化钠溶液沉钴,过滤后得滤饼2[主要成分为C(OH)2]和滤液2(主要溶质为LiCl);滤饼2置于空气中在850 ℃煅烧得到C3O4;滤液2经碳酸钠溶液沉锂,得到滤液3和滤饼3,滤饼3为Li2CO3。常用焰色试验鉴别Li2CO3和Na2CO3。
(4)已知Ksp[C(OH)2]=5.9×10-15,若“沉钴过滤”的pH控制为10.0,则溶液中C2+浓度为__________ ml·L-1。“850 ℃煅烧”时的化学方程式为_________________________________。
6C(OH)2+O2 2C3O4+6H2O
(5)导致SiCl4比CCl4易水解的因素有____(填标号)。a.Si—Cl键极性更大b.Si的原子半径更大c.Si—Cl键键能更大d.Si有更多的价层轨道
a项,Si—Cl键极性更大,易受到极性强的H2O的影响,易水解;b项,Si的原子半径大,非金属性弱,Si—Cl键的极性强,分子中Si原子带有一定的正电荷,容易受到极性强的H2O的吸引,使之容易水解;c项,Si—Cl键键能更大,更稳定,与水解无关,d项,Si位于第三周期,3d轨道更易和H2O分子中的O原子配位。
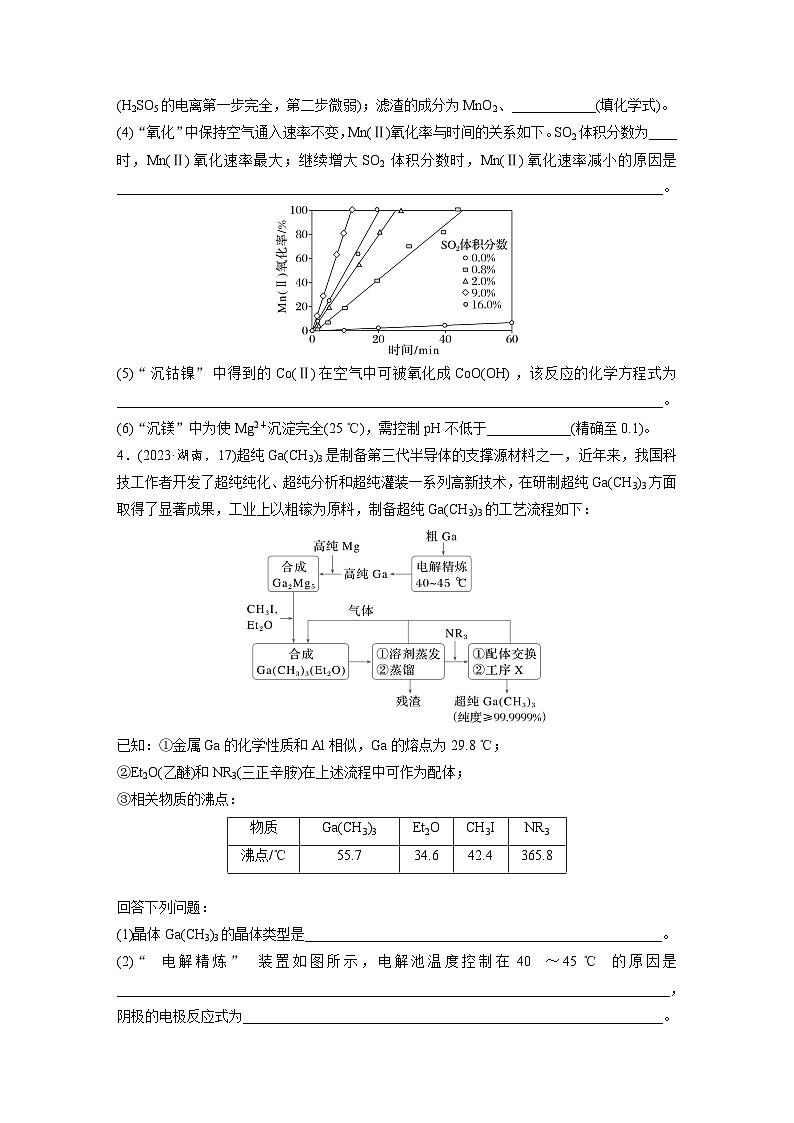
3.(2023·辽宁,16)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、C2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
回答下列问题:(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为__________________________________________(答出一条即可)。(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 ml H2SO5中过氧键的数目为____。
将镍钴矿粉碎(或浸取时搅拌或适当升高温度)
H2SO5的结构式为 ,所以1 ml H2SO5中过氧键的数目为NA。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为__________________________________________(H2SO5的电离第一步完全,第二步微弱);滤渣的成分为MnO2、________________(填化学式)。
Fe(OH)3、CaSO4
Ksp[Fe(OH)3]=10-37.4,当铁离子完全沉淀时,溶液中c(Fe3+)=10-5 ml·L-1,Ksp[Fe(OH)3]=c3(OH-)·c(Fe3+)=c3(OH-)×10-5=10-37.4,c(OH-)=10-10.8 ml·L-1,pH=3.2,此时溶液的pH=4,则铁离子完全水解,生成氢氧化铁沉淀,Ca2+与 结合生成CaSO4沉淀。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为______时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是____________________________。
SO2具有还原性,能还原H2SO5
(5)“沉钴镍”中得到的C(Ⅱ)在空气中可被氧化成CO(OH),该反应的化学方程式为________________________________。(6)“沉镁”中为使Mg2+沉淀完全(25 ℃),需控制pH不低于_____(精确至0.1)。
4C(OH)2+ O2===4CO(OH)+2H2O
Ksp[Mg(OH)2]=10-10.8,当镁离子完全沉淀时,c(Mg2+)=10-5 ml·L-1,可求得c(OH-)=10-2.9 ml·L-1,则c(H+)=10-11.1 ml·L-1,所以溶液的pH=11.1。
4.(2023·湖南,17)超纯Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯Ga(CH3)3的工艺流程如下:
已知:①金属Ga的化学性质和Al相似,Ga的熔点为29.8 ℃;②Et2O(乙醚)和NR3(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
回答下列问题:(1)晶体Ga(CH3)3的晶体类型是__________。
晶体Ga(CH3)3的沸点较低,晶体类型是分子晶体。
(2)“电解精炼”装置如图所示,电解池温度控制在40~45 ℃的原因是_____________,阴极的电极反应式为_______________________________。
(3)“合成Ga(CH3)3(Et2O)”工序中的产物还包括MgI2和CH3MgI,写出该反应的化学方程式:__________________________________________________________。
8CH3I+ 2Et2O +Ga2Mg5===2CH3MgI+ 3MgI2+ 2Ga(CH3)3(Et2O)
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_____。
“残渣”含CH3MgI,经纯水处理,能产生可燃性气体CH4。
(5)下列说法错误的是___。A.流程中Et2O得到了循环利用B.流程中,“合成Ga2Mg5”至“工序 X”需在无水无氧的条件下进行C.“工序X”的作用是解配Ga(CH3)3(NR3), 并蒸出Ga(CH3)3D.用核磁共振氢谱不能区分Ga(CH3)3和CH3I
由已知②③,结合流程图可知,溶剂蒸发、配体交换时Et2O得以循环利用,A项正确;高纯Ga能与H2O、O2反应,CH3I、Ga(CH3)3能与水反应,有机物能与O2反应,故B项正确;
配体交换时NR3和Ga(CH3)3(Et2O)反应得到Ga(CH3)3(NR3)和Et2O,则工序X为解配Ga(CH3)3(NR3),并利用Ga(CH3)3和NR3的沸点相差较大蒸出Ga(CH3)3,C项正确;Ga(CH3)3和CH3I中均只有1种氢原子,核磁共振氢谱均只有一组吸收峰,但吸收强度不同,可以鉴别,D项错误。
(6)直接分解Ga(CH3)3(Et2O)不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是______________________________________________________________________________________。
Ga(CH3)3和Et2O的沸点接近,而Ga(CH3)3和NR3的沸点相差较大,解配后可以分离出Ga(CH3)3
直接分解Ga(CH3)3(Et2O)时由于Et2O的沸点较低,与Ga(CH3)3一起蒸出,不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是根据题给相关物质沸点可知,NR3沸点远高于Ga(CH3)3,与Ga(CH3)3易分离。
(7)比较分子中的C—Ga—C键角大小:Ga(CH3)3____Ga(CH3)3(Et2O)(填“>”“O>H; 中心S原子价层电子对数=4+ =4,则中心S原子为sp3杂化,其空间结构为正四面体形。
(4)钒的浸出率与焙烧温度、硫酸加入量的关系如图1、2所示。指出适宜的工艺条件为___________________________________________________________。
温度:820 ℃左右(800~830均可)、硫酸加入量:6%(6~6.5均可)
(5)“氧化”时,每消耗0.5 ml NaClO3,可得到 ___ ml。
(6)单质V晶胞属于体心立方晶胞,晶胞参数为a pm,两个共顶点的晶胞结构如图3所示,计算出A、B原子的间距为_____pm。
考向二 以废料、废渣提取重要物质为情景的综合题4.钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。回答下列问题:(1)为提高“酸浸”速率,对“赤泥”的处理方式为_______________;滤渣Ⅰ的主要成分是___________(填化学式)。
(2)“氧化”时加入足量H2O2的目的是______________________________________________;氧化后溶液中Fe3+浓度为0.001 ml·L-1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为_____(忽略调pH前后溶液的体积变化)。
将Fe2+氧化为Fe3+,便于后续
调节pH以除去Fe3+
“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,FeO、Fe2O3、Sc2O3与盐酸反应生成 Fe2+、Fe3+、Sc3+,过滤的滤渣主要成分为SiO2、TiO2,滤液中加入H2O2将Fe2+氧化为Fe3+便于后续调节pH以除去Fe3+,加氨水调节pH沉淀铁离子,过滤得滤渣Ⅱ为Fe(OH)3,向滤液中加入草酸,得到草酸钪晶体,过滤、洗涤、干燥后,在空气中加热可得Sc2O3固体。
由分析可知,氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH以除去Fe3+;当pH=3时,溶液中c(OH-)=10-11 ml·L-1,此时c(Fe3+)=
(3)已知25 ℃时,Kh1( )=a,Kh2( )=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4 Sc2(C2O4)3↓+6H+,该反应的平衡常数K=_____(用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热至550 ℃时生成Sc2O3、CO2和H2O,写出反应的化学方程式:_________________________________________________。
2Sc2(C2O4)3·6H2O+3O2 2Sc2O3+12CO2+
Sc2(C2O4)3·6H2O在空气中加热至550 ℃时生成Sc2O3、CO2和H2O,草酸根被氧化为二氧化碳,说明氧气参与反应。
5.(2023·山东枣庄二模)钯(Pd)是一种贵金属,性质与铂(Pt)类似。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:
已知:Ⅰ.阴、阳离子交换树脂的基本工作原理分别为R—Cl+M-R—M+Cl-、R—Na+N+ R—N+Na+(R—表示树脂的有机成分)。Ⅱ.“沉钯”时得到氯钯酸铵 固体,不溶于冷水,可溶于稀盐酸。(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为_________________。
70 ℃,固液比3∶1
(2)“浸取”时,加入试剂A的目的为_______________。(3)“浸取”时,加入NaClO3有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(H2PdCl4)为二元强酸。加入浓盐酸和NaClO3后主要反应的离子方程式:_______________________________________。
(4)“离子交换除杂”应使用___(填“阳”或“阴”)离子交换树脂,“洗脱”时应使用的洗脱液为___(填字母)。A.硫酸 B.盐酸 C.无水乙醇
离子交换时发生的反应为阴、阳离子交换树脂的基本工作原理:R—Cl+M- R—M+Cl-、R—Na+N+ R—N+Na+,其中氯离子被除掉,故应该选用阴离子交换树脂;由题给信息可知洗脱时得到 ,则此时应该选用盐酸,故选B。
(5)“还原”过程N2H4转化为N2,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为____,且该产物可循环利用至____________(填环节名称)环节。
由流程图可知,还原时N2H4和(NH4)2PdCl4反应生成单质钯,根据反应器出口处器壁内侧有白色晶体生成和元素守恒可知,副产物为HCl;由于在浸取与洗脱时都使用了盐酸,故可以循环至浸取与洗脱环节循环利用。
(6)以上流程污染性较强且复杂,通常使用电解法回收钯。将“浸取”后的溶液与钯离子脱附试剂MH混合,形成 配离子,电解可得高纯度钯,装置如图。电解时,当浓缩室里共得到5 L 0.7 ml·L-1的较浓盐酸时(体积变化忽略不计),理论上能得到Pd____g,但实际生产中得不到相应质量的Pd,原因是_______________________。
阴极有H+得电子生成H2
盐酸的浓度由0.1 ml·L-1变为0.7 ml·L-1,则生成的氯化氢的物质的量n(HCl)=5 L×(0.7 ml·L-1-0.1 ml·L-1)=3 ml,则此时转移电子的物质的量为3 ml,根据Pd~2e-,则生成Pd的物质的量为1.5 ml,其质量为106 g·ml-1×1.5 ml=159 g;而实际电解过程中可能有氢离子在阴极得到电子,故实际生产中得不到相应质量的Pd。
相关课件
这是一份第一篇 主题九 综合大题题型研究(Ⅲ)——化学反应原理-2024年高考化学二轮复习课件,文件包含第一篇主题九综合大题题型研究Ⅲ化学反应原理pptx、第一篇主题九综合大题题型研究Ⅲ化学反应原理docx、第一篇主题九综合大题题型研究Ⅲ化学反应原理学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份第一篇 主题七 综合大题题型研究(Ⅱ)——有机推断与有机合成-2024年高考化学二轮复习课件,文件包含第一篇主题七综合大题题型研究Ⅱ有机推断与有机合成pptx、第一篇主题七综合大题题型研究Ⅱ有机推断与有机合成docx、第一篇主题七综合大题题型研究Ⅱ有机推断与有机合成学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份第一篇 主题五 综合大题题型研究(Ⅰ)——化学实验 类型4 以定量测定为主的综合实验-2024年高考化学二轮复习课件,文件包含第一篇主题五综合大题题型研究Ⅰ化学实验类型4以定量测定为主的综合实验pptx、第一篇主题五综合大题题型研究Ⅰ化学实验类型4以定量测定为主的综合实验docx、第一篇主题五综合大题题型研究Ⅰ化学实验类型4以定量测定为主的综合实验学生版docx等3份课件配套教学资源,其中PPT共49页, 欢迎下载使用。









