











所属成套资源:2024年高考化学二轮复习课件(含练习)
第二篇 专题二 重温理论体系框架-2024年高考化学二轮复习课件
展开
这是一份第二篇 专题二 重温理论体系框架-2024年高考化学二轮复习课件,文件包含第二篇专题二重温理论体系框架pptx、第二篇专题二重温理论体系框架docx、第二篇专题二重温理论体系框架学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
二、化学反应速率及化学平衡
1.电子运动状态的各种特征(以Mn为例,1s22s22p63s23p63d54s2)(1)不同运动状态的电子数:___。(2)不同空间运动状态的电子数:___。(3)形状不同的电子云种类:__。(4)不同能级(能量)的电子种类:__。(5)最高能级的电子数:__。(6)最高能层的电子数:__。
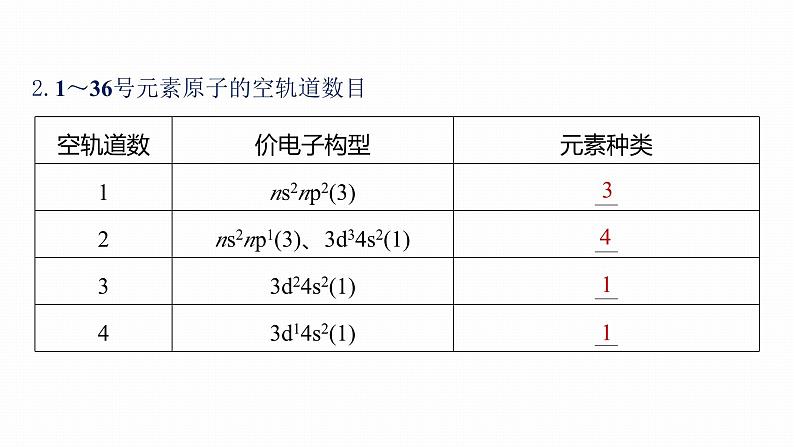
2.1~36号元素原子的空轨道数目
3.1~36号元素原子的未成对电子数(m)(1)m=1:ns1(4)、ns2np1(3)、ns2np5(3)、3d14s2(1)、3d104s1(1),共___种。(2)m=2:ns2np2(3)、ns2np4(3)、3d24s2(1)、3d84s2(1),共__种。(3)m=3:ns2np3(3)、3d34s2(1)、3d74s2(1),共__种。(4)m=4:3d64s2(1),共__种。(5)m=5:3d54s2(1),共__种。(6)m=6:3d54s1(1),共__种。
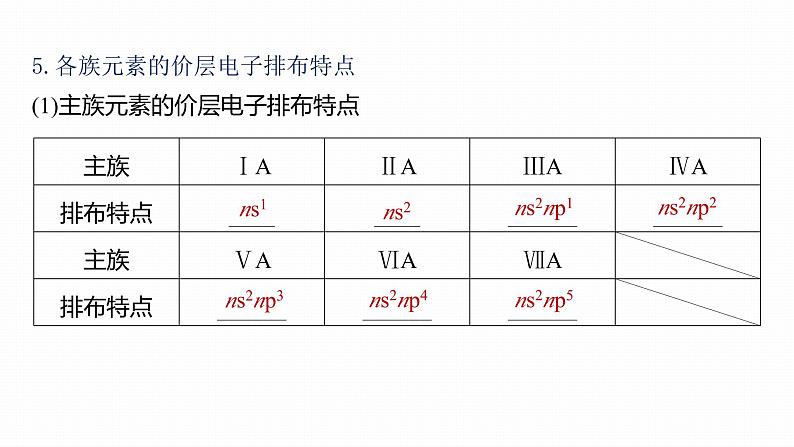
5.各族元素的价层电子排布特点(1)主族元素的价层电子排布特点
(2)0族元素的价层电子排布:He为1s2;其他为ns2np6。(3)过渡元素(副族)的价层电子排布:(n-1)d1~10ns1~2(除钯、镧系、锕系外)。(4)各区价层电子排布特点
6.元素第一电离能的周期性变化规律
7.元素周期表中特殊位置的元素(1)族序数=周期数的短周期元素:H、Be、Al。(2)族序数=周期数2倍的元素:C、S;3倍的元素:O。(3)周期数是族序数2倍的元素:Li;3倍的元素:Na。(4)最高正价与最低负价代数和为零的短周期元素:C、Si;最高正价是最低负价绝对值3倍的短周期元素:S。(5)除H外,原子半径最小的元素:F。
判断下列说法是否正确,正确的打“√”,错误的打“×”(1)最外层电子数为2的元素一定在第ⅡA族( )(2)第ⅠA族元素的金属性一定比同周期的第ⅡA族的强( )(3)第三周期元素的离子半径从左至右逐渐减小( )(4)CH4和SiH4中H元素化合价均为+1价( )(5)碳酸的酸性强于次氯酸,因而碳的非金属性强于氯( )(6)镓是第三周期第ⅢA族元素( )
(7)同主族元素非金属性越强,其简单阴离子的还原性越强( )(8)三氟化硼分子中,B原子最外层满足8电子结构( )(9)第ⅠA族元素与第ⅦA族元素结合时,所形成的化学键都是离子键( )
元素推断1.(2023·北京海淀统考二模)四种常见元素基态原子的结构信息如下表。下列大小关系不一定正确的是
A.电负性:Y>XB.第一电离能:YZ
X有5个原子轨道填充有电子,有3个未成对电子,可知X的核外电子排布式为1s22s22p3,X为N;Y有8个不同运动状态的电子,则Y有8个核外电子,Y为O;Z的核外电子排布式为1s22s22p2,则Z为C;Q的价层电子排布式为 3d104s1,则Q为Cu。
2.短周期主族元素X、Y、Z、W、T的原子序数依次增大,其中,X存在不含中子的核素,基态Y原子2p能级含2个空轨道,Z与T位于同一主族,二者可形成三原子、四原子的二元化合物,W存在两种常见单质,其中一种在空气中易发生自燃。下列说法正确的是A.简单离子半径:W>T>ZB.可发生自燃的W单质中,键角为109°28′C.Y的最高价氧化物的水化物为三元酸D.电负性:Z>W>T
短周期主族元素X、Y、Z、W、T的原子序数依次增大,X存在不含中子的核素,则X为H;基态Y原子2p能级含2个空轨道,则Y为B;Z与T位于同一主族,二者可形成三原子、四原子的二元化合物,则Z为O、T为S,形成的三原子、四原子的二元化合物分别为二氧化硫、三氧化硫;W存在两种常见单质,其中一种在空气中易发生自燃,则两种单质分别为白磷和红磷,W为P。
3.某盐用作一种新型电池的电解质,能有效提高电池性能,其结构如图所示。R、X、Y、Z、W为原子序数依次增大的五种短周期元素,W是电负性最强的元素,R+的电子对数与非空原子轨道数相等。下列说法错误的是A.Y是形成化合物种类最多的元素B.R、X、Y、Z、W的最高化合价依次增大C.Z、W简单氢化物的熔、沸点比同主族其他元素氢化物的熔、沸点高D.该盐的阴离子中存在配位键
由题干信息可知R、X、Y、Z、W是原子序数依次增大的五种短周期主族元素,R+的电子对数与非空原子轨道数相等,则R为Li,Z能够形成2个共价键,则Z为O,W能够形成1个共价键且电负性最强,则W为F,Y能够形成4个共价键,则Y为C,X形成了3个共价键和一个配位键,则X为B。
化学反应速率及化学平衡
3.化学平衡移动模型思考化学平衡研究的是密闭体系中的可逆反应,当可逆反应达到化学平衡状态时,遇到平衡移动问题,我们解题的步骤和方法是:第一步:关注已达平衡的可逆反应特点。第二步:关注题干条件,是恒温恒容还是恒温恒压。第三步:如果改变影响平衡的一个因素,我们可以根据平衡移动原理,即勒夏特列原理分析平衡移动的方向。
但有些题目不仅仅需要我们判断平衡移动的方向,还通常在判断平衡移动方向后让我们比较前后两次平衡的关系,碰到这种问题我们经常先建立一个与平衡“等效”的模型,再根据题目中的要求通过改变模型分析平衡移动的方向和结果。当然,分析化学平衡问题时应该注意平衡的建立与途径没有关系,研究平衡问题时注意矛盾的主次,应用守恒的思想和极限的思想解答问题。
判断下列说法是否正确,正确的打“√”,错误的打“×”(1)已知乙酸与乙醇的酯化反应为放热反应,加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大( )(2)在恒温条件下,增大压强,化学反应速率一定加快( )(3)在一定条件下,增加反应物的量,化学反应速率一定加快( )(4)某温度,FeO(s)+CO(g) Fe(s)+CO2(g)达到平衡时n(CO)∶n(CO2)=4∶1。则该反应此温度时的平衡常数K=0.25( )
(5)正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动( )(6)加入催化剂加快了反应速率,改变了反应吸收或放出的热量( )(7)在一定条件下,平衡向正反应方向移动,正反应速率变大( )(8)在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中,加入KCl固体,颜色变浅( )(9)平衡向正反应方向移动,反应物的转化率都增大( )
(10)恒温恒压时,充入“惰性气体”反应速率不变,平衡不移动( )(11)NH3的体积分数不变能说明NH2COONH4(s) 2NH3(g)+CO2(g)达到平衡状态( )(12)升高温度,化学平衡一定发生移动( )
常考图像识图解答下列问题(1)已知甲酸的分解反应为HCOOH CO+H2O ΔH。在H+催化作用下反应历程为
①正反应的最高活化能是____。②甲酸分解的反应热ΔH=_____。③写出图像中第一个峰对应的过渡态表示符号:_______。④使用催化剂后,正、逆反应速率如何变化?平衡移动方向如何?________________________________________。
根据过渡态理论,其反应过程中的能量变化如图所示(E1、E2、E3均大于0):
正、逆反应速率同等程度增大,平衡不移动
(2)将2 ml CH4和5 ml H2O(g)通入恒压容器中发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率与温度、压强的关系如图:①压强为p1,平衡时若容器的体积为1 L,则100 ℃时该反应的平衡常数K=_______。
CH4(g)+H2O(g) CO(g)+3H2(g)开始/ml 2 5 0 0转化/ml 1 1 1 3平衡/ml 1 4 1 3
②若图中的p1c( ( )(18)NH4HSO4溶液中各离子浓度的大小关系是c(H+)> >c(OH-)( )(19)0.1 ml·L-1氨水中加入CH3COONH4固体, 比值变大( )
答案 CH3COONH4电离的 抑制氨水的电离,c(OH-)减小,c(NH3·H2O)增大,因而比值减小
(20)用标准NaOH溶液滴定未知浓度的CH3COOH溶液到终点时,c(Na+)=c(CH3COO-)( )(21)25 ℃时,用0.01 ml·L-1盐酸滴定20 mL某浓度的氨水时,应选用酚酞作为指示剂( )(22)向含AgCl、AgBr的浊液中加入少量AgNO3,溶液中 不变( )(23)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强( )
答案 溶液的导电性与离子浓度和离子所带电荷数有关
答案 滴定终点的生成物为CH3COONa,CH3COO-水解,因而c(Na+)>c(CH3COO-)
答案 盐酸滴定氨水,终点呈酸性,应选用甲基橙作指示剂
(24)H2CO3的电离常数表达式:Ka= ( )(25)常温下,将pH=3的酸和pH=11的碱等体积混合,所得溶液的pH=7( )(26)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA( )(27)向硫酸铝溶液中滴加碳酸钠溶液的离子方程式为2Al3++ ===Al2(CO3)3↓( )
答案 多元弱酸分步电离,平衡常数表达式应分步书写
答案 未指明酸碱的强弱,无法判断
答案 Fe(OH)3胶粒是大量Fe(OH)3的集合体
答案 Al2(CO3)3在水溶液中不存在,应生成氢氧化铝沉淀和二氧化碳气体
电解质溶液图像1.(2023·江苏南通模拟)常温下,肼(N2H4)的水溶液显碱性,存在如下平衡:N2H4+H2O +OH-; +H2O +OH-。平衡时溶液中含氮微粒的分布分数δ[δ(N2H4)= ]与溶液pOH[pOH=-lg c(OH-)]的关系如图所示。向10.00 mL 0.01 ml·L-1 N2H4的水溶液中逐滴滴加0.005 ml·L-1的稀硫酸,下列说法正确的是
N2H4完全转变为(N2H5)2SO4需要加入10.00 mL稀硫酸,所以加入5.00 mL稀硫酸后溶液中溶质为(N2H5)2SO4和N2H4,
2.(2023·河南新乡二模)常温下,用0.11 ml·L-1 NaOH溶液滴定40 mL 0.025 ml· L-1 CuSO4和0. 025 ml·L-1 MgCl2的混合溶液(含有少量抑制金属离子水解的硫酸),pH变化曲线如图所示[已知:Cu(OH)2和Mg(OH)2的Ksp分别为2.2×10-20、5.6 ×10-12,当c(X2+)≤10-5ml·L-1时认为X2+沉淀完全,lg 22=1.34,lg 56=1.75]。下列说法错误的是
A.a~b段主要发生反应:H+ +OH- ===H2OB.c点时,溶液的pH=6.67C.能通过调节pH分离Cu2+和Mg2+D.d~e段生成的沉淀为Cu(OH)2
CuSO4和MgCl2的混合溶液中含有少量抑制金属离子水解的硫酸,滴加NaOH时,首先与硫酸发生反应,所以a~b段主要发生反应:H+ +OH-===H2O,A正确;
因为Ksp[Cu(OH)2]
相关课件
这是一份第二篇 专题四 有机化学考前再叮咛-2024年高考化学二轮复习课件,文件包含第二篇专题四有机化学考前再叮咛pptx、第二篇专题四有机化学考前再叮咛docx、第二篇专题四有机化学考前再叮咛学生版docx等3份课件配套教学资源,其中PPT共16页, 欢迎下载使用。
这是一份第二篇 专题一 化学基本概念 化学用语-2024年高考化学二轮复习课件,文件包含第二篇专题一化学基本概念化学用语pptx、第二篇专题一化学基本概念化学用语docx、第二篇专题一化学基本概念化学用语学生版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
这是一份2023届高考化学二轮复习专题二化学计量及其应用课件,共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,球形冷凝管,量筒托盘天平,答案A等内容,欢迎下载使用。










