

- 2024年高中化学新教材同步讲义 选择性必修第三册 第1章 体系构建 体验高考(含解析) 学案 0 次下载
- 2024年高中化学新教材同步讲义 选择性必修第三册 第1章 提升课1 有机化合物结构的确定(含解析) 学案 0 次下载
- 2024年高中化学新教材同步讲义 选择性必修第三册 第2章 第1节 第2课时 烷烃的命名及同分异构体的书写(含解析) 学案 0 次下载
- 2024年高中化学新教材同步讲义 选择性必修第三册 第2章 第2节 第1课时 烯烃(含解析) 学案 0 次下载
- 2024年高中化学新教材同步讲义 选择性必修第三册 第2章 第2节 第2课时 烯烃的加成、加聚及氧化规律(含解析) 学案 0 次下载
人教版 (2019)选择性必修3第一节 烷烃优质第1课时导学案
展开第1课时 烷烃的结构和性质
[核心素养发展目标] 1.知道烷烃的物理性质的变化与分子中碳原子数目的关系。2.认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。3.了解同系物的概念,学会判断物质是否互为同系物。
一、烷烃的结构
1.烃
仅含碳、氢两种元素的有机化合物。
根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。
2.烷烃的结构
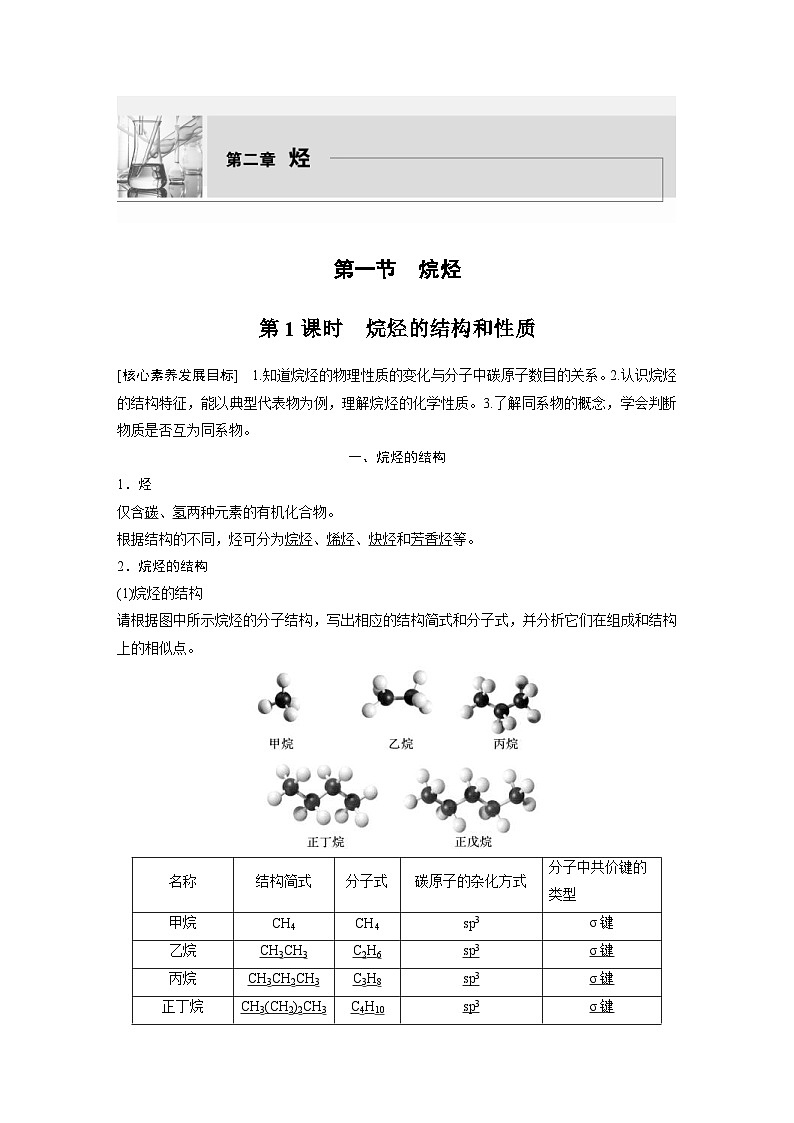
(1)烷烃的结构
请根据图中所示烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点。
(2)烷烃的结构特点
①杂化方式:烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp3杂化,以伸向四面体4个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
②空间结构:以碳原子为中心形成若干四面体空间结构,碳链呈锯齿状排列。
③键的类型:烷烃分子中的共价键全部是单键(C—C、C—H)。
(3)链状烷烃的通式:CnH2n+2(n≥1)。
3.同系物
(1)概念:结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。如甲烷、乙烷、丙烷互为同系物。
(2)性质:同系物因组成和结构相似,化学性质相似,而物理性质一般呈规律性变化,如烷烃的熔点、沸点、密度等。
(1)烷烃的碳原子均采取sp3杂化( )
(2)分子通式为CnH2n+2的烃一定是烷烃( )
(3)烷烃分子中的所有原子不可能共平面( )
(4)丙烷分子中所有碳原子在一条直线上( )
(5)同系物一定具有相同的通式,官能团的种类、数目也相同( )
答案 (1)√ (2)√ (3)√ (4)× (5)√
1.(2023·南昌高二月考)下列叙述正确的是( )
A.甲烷分子的空间结构是正四面体,所以CH2Cl2有两种不同的结构
B.C3H6、C5H10、C7H16都属于链状烷烃
C.正丁烷属于直链烷烃,分子中所有的碳原子均可在同一条直线上
D.烷烃的含碳量随着分子组成中碳原子数的增多逐渐升高
答案 D
解析 甲烷分子的空间结构是正四面体,所以CH2Cl2只有一种结构,A项错误;C3H6、C5H10不满足链状烷烃的通式,B项错误;根据烷烃的结构可知,正丁烷分子中所有的碳原子呈锯齿状连接,不在同一条直线上,C项错误。
2.(2022·北京石景山高二期末)下列物质互为同系物的是( )
A.C2H6和C6H14
B.CH3CH2Cl和CH2ClCH2CH2Cl
C.和
D.CH2==CHCH2CH3和
答案 A
解析 C2H6和C6H14都为烷烃,结构相似,分子组成上相差4个CH2原子团,二者互为同系物,故A正确;CH3CH2Cl和CH2ClCH2CH2Cl含有的氯原子数目不同,二者结构不相似,不互为同系物,故B错误;和,前者属于酚类,后者属于醇类,二者结构不相似,不互为同系物,故C错误;CH2==CHCH2CH3和的结构不同,前者含碳碳双键,后者不含,二者不互为同系物,故D错误。
二、烷烃的性质
回忆甲烷的物理性质及化学性质,体会同系物物理性质的规律性变化及化学性质的相似性。
1.物理性质
(1)甲烷
纯净的甲烷是无色、无臭的气体,难溶于水,密度比空气的小。
(2)烷烃
2.化学性质
(1)甲烷
甲烷的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。甲烷的主要化学性质表现为能在空气中燃烧(可燃性)和能在光照下与氯气发生取代反应。
(2)烷烃
①稳定性
常温下烷烃的化学性质比较稳定,与强酸、强碱、强氧化剂、溴的四氯化碳溶液等都不发生反应。
②可燃性
烷烃可在空气或氧气中完全燃烧生成CO2和H2O,链状烷烃燃烧的通式为CnH2n+2+eq \f(3n+1,2)O2eq \(――→,\s\up7(点燃))nCO2+(n+1)H2O。
③取代反应
烷烃可与卤素单质在光照条件下发生取代反应生成卤代烃和卤化氢。如乙烷与氯气反应生成一氯乙烷的化学方程式为CH3CH3+Cl2eq \(――→,\s\up7(光))CH3CH2Cl+HCl。
注意 a.烷烃的取代反应是在光照条件下与纯净的卤素单质的反应。b.连续反应:反应过程不会停留在某一步,所以产物较为复杂,不适合制备物质。c.定量关系:1 ml卤素单质只能取代1 ml H,同时生成1 ml HX。
④分解反应——高温裂化或裂解
甲烷高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃。如:
CH4eq \(――→,\s\up7(催化剂),\s\d5(高温))C+2H2;
C16H34eq \(――――→,\s\up7(催化剂),\s\d5(加热、加压))C8H16+C8H18;
C8H18eq \(――――→,\s\up7(催化剂),\s\d5(加热、加压))C4H10+C4H8。
(1)所有的烷烃在光照条件下都能与氯气发生取代反应( )
(2)在光照下,乙烷通入溴水中,可使溴水褪色( )
(3)1 ml丙烷与氯气发生取代反应,最多能消耗Cl2的物质的量为8 ml( )
(4)标准状况下,11.2 L己烷所含共价键的数目为9.5NA( )
(5)戊烷的三种同分异构体中,沸点最低的是新戊烷( )
答案 (1)√ (2)× (3)√ (4)× (5)√
1.在1.013×105 Pa下,测得某些烷烃的沸点如表所示。据表分析,下列选项正确的是( )
A.在标准状况下,新戊烷是气体
B.在1.013×105 Pa、20 ℃时,C5H12都是液体
C.烷烃随碳原子数的增加,沸点降低
D.C5H12随着支链数的增加,沸点降低
答案 D
解析 新戊烷的沸点是9.5 ℃,标准状况下是液体,在1.013×105 Pa、20 ℃时是气体,A、B项错误;由表中数据可知,随碳原子数的增加,烷烃的沸点逐渐升高,C项错误;由表中数据可知,C5H12的3种同分异构体中,随着支链数的增加,沸点逐渐降低,D项正确。
2.(2022·厦门高二期末)甲基环戊烷()常用作溶剂及色谱分析标准物质,也可用于有机合成。下列有关该有机化合物的说法错误的是( )
A.分子式为C6H12
B.光照下可以与Cl2发生取代反应
C.易溶于水及苯
D.不能使酸性KMnO4溶液褪色
答案 C
解析 甲基环戊烷的分子式为C6H12,光照下可以与Cl2发生取代反应,A、B项正确;不能使酸性KMnO4溶液褪色,D项正确;烷烃均难溶于水,C项错误。
3.已知链状烷烃A的密度是相同条件下H2密度的36倍。
(1)链状烷烃A的分子式为_______________________________________________________。
(2)写出A可能存在的结构简式:__________________________________________________
______________________________________________________________________________。
(3)若A的某种同分异构体B的一氯代物只有一种。
①B与Cl2发生反应生成一氯代物的化学方程式为___________________________________。
②B完全燃烧的化学方程式为______________________________________________________
_______________________________________________________________________________。
答案 (1)C5H12
(2)CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4
(3)①C(CH3)4+Cl2eq \(――→,\s\up7(光))C(CH3)3CH2Cl+HCl
②C(CH3)4+8O2eq \(――→,\s\up7(点燃))5CO2+6H2O
解析 (1)根据A的密度是相同条件下H2密度的36倍,推知其相对分子质量为72,设其分子式为CnH2n+2,求得n=5,则分子式为C5H12。
题组一 烷烃的结构及同系物的概念
1.(2022·成都高二月考)甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
A.CHCl3不存在同分异构体
B.CH2Cl2不存在同分异构体
C.CH4中的C—H是极性键
D.CH4分子中四个键的键角、键长都相等
答案 B
解析 无论甲烷是正四面体结构还是正方形的平面结构,CHCl3只有1种结构,不存在同分异构体,A不符合题意;若甲烷是正方形的平面结构,CH2Cl2有2种结构(相邻或对角线上的氢原子被Cl原子取代),而实际上其二氯代物只有一种结构,B符合题意;甲烷无论是正四面体结构还是正方形的平面结构,C—H都是极性键,C不符合题意;甲烷分子中四个碳氢键完全相同,则甲烷无论是正四面体结构还是正方形的平面结构,四个键的键角、键长都相等,D不符合题意。
2.下列说法不正确的是( )
A.分子式为C3H8与C6H14的两种有机化合物一定互为同系物
B.同分异构体之间一定不互为同系物
C.互为同系物的两种有机化合物相对分子质量数值一定相差14
D.互为同系物的两种有机物的组成元素相同,且结构相似
答案 C
解析 分子式为C3H8与C6H14的两种有机化合物都是饱和链状烷烃,二者分子组成上相差3个CH2原子团,因此二者互为同系物,故A正确;互为同分异构体的物质的分子式相同,而同系物的分子组成上一定相差n个CH2(n为正整数)原子团,所以互为同分异构体的物质一定不互为同系物,故B正确;同系物是指结构相似、分子组成上相差一个或若干个CH2原子团的有机化合物,所以互为同系物的两种有机化合物组成元素相同,相对分子质量数值一定相差14n(n为正整数),故C错误、D正确。
3.下列各组中的物质不互为同系物的是( )
A.CH3CH3、、CH3CH2CH2CH2CH3
B.CH2==CH2、CH2==CH—CH3、CH3CH==CHCH3
C.、、
D.CH3CH2CH2CH2CH3、、
答案 D
解析 D项,三种物质的分子式相同,不符合同系物的定义。
4.(2023·太原检测)下列物质一定互为同系物的是( )
① ② ③ ④C2H4 ⑤CH2==CH—CH==CH2 ⑥CH2==CHCH2OH⑦ ⑧
A.④和⑧ B.①、②和③
C.⑤、⑦和⑧ D.⑥和⑧
答案 A
解析 ④C2H4为乙烯,属于单烯烃,⑧为2-甲基丙烯,属于单烯烃,二者结构相似,分子组成上相差2个CH2原子团,互为同系物,故A正确;①为甲苯,属于单环芳香烃,②为多环芳香烃,③分子中除苯环外还含有碳碳双键,三者的结构不相似,不互为同系物,故B不正确;⑤CH2==CH—CH==CH2为共轭二烯烃,⑦为共轭二烯烃,⑧为单烯烃,⑤与⑦结构相似,分子组成上相差1个CH2原子团,互为同系物,但是⑤、⑦与⑧的结构不相似,三者不互为同系物,故C不正确;⑥CH2==CHCH2OH含有碳碳双键和羟基,⑧为单烯烃,二者官能团的种类不同,结构不相似,不互为同系物,故D不正确。
题组二 烷烃的物理性质
5.下列有关烷烃的叙述不正确的是( )
A.烷烃同系物的熔、沸点随着相对分子质量的增大逐渐升高
B.烷烃同系物的密度随着相对分子质量的增大逐渐增大
C.常温下的状态由气态递变到液态,相对分子质量大的则为固态
D.同种烷烃的同分异构体中,支链数越多其沸点越高
答案 D
解析 烷烃同系物的组成、结构相似,随着相对分子质量增大,分子间作用力逐渐增大,故熔、沸点逐渐升高,A正确;烷烃同系物的密度都比水小,随着相对分子质量增大密度逐渐增大,B正确;同种烷烃的同分异构体中,支链数越多其沸点越低,D错误。
6.根据以下数据推断丙烷的沸点可能是( )
A.约-40 ℃ B.低于-160 ℃
C.低于-89 ℃ D.高于36 ℃
答案 A
解析 烷烃的熔、沸点随分子中碳原子数的增加而升高,丙烷的沸点应介于乙烷和正丁烷之间。
题组三 烷烃的化学性质
7.在常温、常压下,取下列四种气态烃各1 ml,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.CH4 B.C3H8 C.C4H10 D.C2H6
答案 C
解析 根据燃烧通式CxHy+(x+0.25y)O2eq \(――→,\s\up7(点燃))xCO2+0.5yH2O进行计算,气态烃各1 ml,甲烷燃烧需要2 ml氧气,丙烷燃烧需要5 ml氧气,丁烷燃烧需要6.5 ml氧气,乙烷燃烧需要3.5 ml氧气,故消耗氧气最多的是丁烷。
8.液化气的主要成分之一是丙烷,下列有关丙烷的叙述不正确的是( )
A.丙烷是链状烷烃,但分子中碳原子不在同一直线上
B.在光照条件下能够与Cl2发生取代反应
C.丙烷比其同分异构体丁烷易液化
D.1 ml 丙烷完全燃烧消耗5 ml O2
答案 C
解析 丙烷分子中的碳原子为饱和碳原子,3个碳原子呈锯齿形排列,故3个碳原子不在同一直线上,A正确;丙烷在光照条件下与Cl2发生取代反应,B正确;丙烷与丁烷互为同系物,C错误;1 ml丙烷(C3H8)完全燃烧消耗O2的物质的量为(3+eq \f(8,4)) ml=5 ml,D正确。
9.已知有一种烃的结构类似自行车(如图),简称“自行车烃”,下列关于它的叙述正确的是( )
A.易溶于水
B.可以发生取代反应
C.其密度大于水的密度
D.与环己烷互为同系物
答案 B
解析 烃都难溶于水且密度比水小,A、C项错误;“自行车烃”属于饱和烃,具有类似甲烷的化学性质,光照下能与卤素单质发生取代反应,B项正确;环己烷(C6H12)分子中只含有1个碳环,而“自行车烃”(C16H30)分子中含有2个碳环,在分子组成上相差C10H18,不满足相差若干个CH2原子团的条件,二者不互为同系物,D项错误。
10.正己烷是优良的有机溶剂,其球棍模型为,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法正确的是( )
A.X分子中可能含有三个甲基
B.X的一氯代物可能有三种(不考虑立体异构)
C.标准状况下2.24 L X完全燃烧,将生成的气体通过装有足量无水CaCl2的干燥管,干燥管会增重12.6 g
D.X能使溴的四氯化碳溶液褪色
答案 B
解析 根据题意X可能为(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3,分子中都含有4个甲基,故A错误;X若为(CH3)2CHCH(CH3)2,分子中有2种氢原子,一氯代物只有2种,X若为(CH3)3CCH2CH3,分子中有3种氢原子,一氯代物有3种,故B正确;标准状况下X为液态,无法用气体摩尔体积进行计算,故C错误;(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3都属于烷烃,与溴的四氯化碳溶液不反应,不能使溴的四氯化碳溶液褪色,故D错误。
11.(2022·长沙高二开学考试)1 ml某链状烷烃在氧气中充分燃烧,需要消耗标准状况下的氧气246.4 L,它在光照的条件下与氯气反应能生成4种不同的一氯代物(不考虑立体异构),该烃的结构简式是( )
A.(CH3)3CCH2CH2CH3
B.CH3CH2CH(CH3)2
C.CH3CH2CH2CH2CH3
D.(CH3CH2)2C(CH3)2
答案 A
解析 链状烷烃分子通式为CnH2n+2(n≥1),在氧气中充分燃烧的化学方程式为CnH2n+2+eq \f(3n+1,2)O2eq \(――→,\s\up7(点燃))nCO2+(n+1)H2O。由题可知,O2的物质的量为eq \f(246.4 L,22.4 L·ml-1)=11 ml,可得n=7,该烷烃的分子式为C7H16,故B、C错误;(CH3)3CCH2CH2CH3分子中含有4种不同化学环境的H,其一氯代物有4种,故A正确;(CH3CH2)2C(CH3)2分子中含有3种不同化学环境的H,其一氯代物有3种,故D错误。
12.烷烃与氯气的取代反应属于常见的自由基反应,其中甲烷反应的部分历程如下:
①引发:Cl2―→Cl·+Cl·等
②链反应:Cl·+CH4―→CH3·+HCl,CH3·+Cl2―→Cl·+CH3Cl等
③终止:Cl·+Cl·―→Cl2,Cl·+CH3·―→CH3Cl等
下列说法不正确的是( )
A.引发时可以通过热辐射、光照等条件
B.链反应可以反复进行
C.反应产物只有四种
D.产物中将出现CH3CH3
答案 C
解析 烷烃与氯气反应的条件为光照,所以引发时可以通过热辐射、光照等条件,A正确;依据反应历程可知Cl·在链反应中消耗后又生成,所以链反应可以周而复始、反复进行,B正确;甲烷与氯气反应可以生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、HCl,C错误;两个·CH3可以结合生成CH3—CH3,D正确。
13.某烷烃X分子中碳与氢的质量比为36∶7。现取两支试管,分别加入适量溴水,实验操作及现象如下:
下列有关X的说法正确的是( )
A.相同条件下,X的密度比水大
B.X的分子式为C5H12
C.X能与Br2发生加成反应使溴水褪色
D.实验后试管2中的有机层是上层还是下层,可通过加水确定
答案 D
解析 烷烃X分子中碳与氢的质量比为36∶7,则C、H原子数目之比为eq \f(36,12)∶eq \f(7,1)=3∶7,故X分子式为C6H14,故B错误;烷烃X能萃取溴水中的溴,上层呈橙红色,说明X的密度比水小,故A错误;X为烷烃,不能与溴发生加成反应使溴水褪色,故C错误;C6H14能发生取代反应得到溴代烃,溴代烃不溶于水,向试管中加水,若上层液体体积变大,则说明试管2中的有机层在下层,故D正确。
14.某化学学习小组欲探究己烷的性质,用己烷进行下列实验:
实验1:溴水eq \(―――――→,\s\up7(+己烷,振荡),\s\d5(操作①))eq \(――→,\s\up7(静置))分层,下层为几乎无色的液体eq \(―――→,\s\d5(操作②))橙色溶液。
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:利用如图所示实验装置在一定条件下分解己烷生成丙烷和丙烯(CH3CH==CH2),且丙烯能被酸性KMnO4溶液氧化。
(1)实验1中用到的玻璃仪器主要有_______________________________________(填名称)。
(2)由实验1可知,己烷的物理性质有________________________________________________
_______________________________________________________________________________。
(3)实验2中的橙色溶液颜色逐渐变浅的原因是________(填字母)。
A.己烷与溴发生了取代反应
B.溴己烷为无色物质
C.液溴向外挥发浓度降低
D.己烷与液溴发生了加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3中装置Ⅱ的作用是______________________________________________________。
(5)试管C中的现象是____________________________________________________________。
(6)试写出装置Ⅰ中发生反应生成丙烷和丙烯的化学方程式:___________________________。
答案 (1)烧杯、分液漏斗 (2)密度比水小,难溶于水,可溶解溴 (3)AB (4)冷凝己烷分解产生的气体 (5)酸性高锰酸钾溶液的紫红色褪去 (6)CH3(CH2)4CH3eq \(――――→,\s\up7(一定条件))CH3CH2CH3↑+CH3CH==CH2↑
解析 (1)实验1的主要操作是分液,需要的玻璃仪器主要是烧杯和分液漏斗。(2)溴水和己烷混合后,下层几乎是无色的,且分液后得到橙色溶液,这说明己烷密度比水小,难溶于水,可溶解溴。(3)由于打开瓶盖瓶口出现白雾,这说明有溴化氢生成。己烷是烷烃,能和溴发生取代反应生成溴己烷和溴化氢。(4)实验3的装置Ⅱ为冰水浴,所以该装置的作用是冷凝己烷分解产生的气体。(5)己烷裂化有气态的烯烃生成,烯烃含有碳碳双键,能被酸性高锰酸钾溶液氧化,因此看到试管C中酸性高锰酸钾溶液的紫红色褪去。(6)在一定条件下,己烷裂化生成丙烷和丙烯,反应的化学方程式是CH3(CH2)4CH3eq \(――――→,\s\up7(一定条件))CH3CH2CH3↑+CH3CH==CH2↑。
15.环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
回答下列问题:
(1)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是______________(填名称),判断依据为____________________________________________________________________。
(2)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为__________________________________________(不需注明反应条件)。
(3)写出鉴别环丁烷与丁烯的一种方法:___________________________________________。
答案 (1)环丙烷 环丙烷与H2反应所需温度最低 (2)+HBr―→CH3CH2CH2CH2Br (3)利用酸性KMnO4溶液,能使酸性KMnO4溶液褪色的为丁烯,不能使酸性KMnO4溶液褪色的为环丁烷(答案合理即可)名称
结构简式
分子式
碳原子的杂化方式
分子中共价键的类型
甲烷
CH4
CH4
sp3
σ键
乙烷
CH3CH3
C2H6
sp3
σ键
丙烷
CH3CH2CH3
C3H8
sp3
σ键
正丁烷
CH3(CH2)2CH3
C4H10
sp3
σ键
正戊烷
CH3(CH2)3CH3
C5H12
sp3
σ键
物理性质
递变规律
状态
烷烃常温下的存在状态随碳原子数的增加由气态→液态→固态
C1~C4气态,C5~C16液态
[新戊烷C(CH3)4在常温常压下是气体],C17以上为固态
熔、沸点
①随碳原子数的增加,即烷烃的相对分子质量越大,烷烃的熔、沸点越高
②碳原子数相同(相对分子质量相同),支链越多,熔、沸点越低
密度
随碳原子数的增多而逐渐增大,但都小于水的密度
溶解性
烷烃都难溶于水,易溶于有机溶剂
物质名称
沸点/℃
正丁烷CH3(CH2)2CH3
-0.5
正戊烷CH3(CH2)3CH3
36.1
异戊烷CH3CH2CH(CH3)2
27.9
新戊烷C(CH3)4
9.5
正己烷CH3(CH2)4CH3
69.0
物质
甲烷
乙烷
正丁烷
正戊烷
沸点
-164 ℃
-89 ℃
-0.5 ℃
36 ℃
结构简式
Br—CH2—CH2—CH(CH3)—CH2—Br
键线式
BrBr
高中化学人教版 (2019)选择性必修3第二章 烃第一节 烷烃优质第2课时学案设计: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002463_t4/?tag_id=42" target="_blank">第二章 烃第一节 烷烃优质第2课时学案设计</a>,共12页。
化学必修 第二册第七章 有机化合物第一节 认识有机化合物第1课时导学案: 这是一份化学必修 第二册<a href="/hx/tb_c4000046_t4/?tag_id=42" target="_blank">第七章 有机化合物第一节 认识有机化合物第1课时导学案</a>,共13页。
化学必修 第一册第一节 原子结构与元素周期表第3课时导学案: 这是一份化学必修 第一册<a href="/hx/tb_c161996_t4/?tag_id=42" target="_blank">第一节 原子结构与元素周期表第3课时导学案</a>,共14页。













