


人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应优秀ppt课件
展开酸和碱混合在一起,会发生化学反应吗?
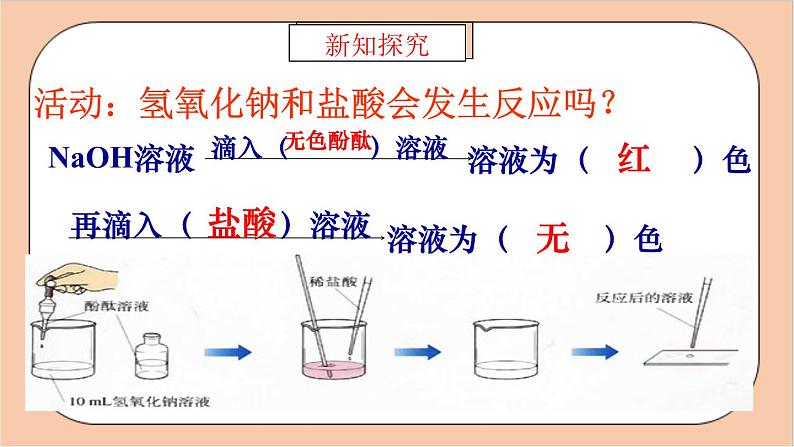
活动:氢氧化钠和盐酸会发生反应吗?
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸?
1. 酚酞在实验中起什么作用?
滴加盐酸至红色恰好变成无色时即止。否则盐酸过量。
结论:酸和碱能发生反应
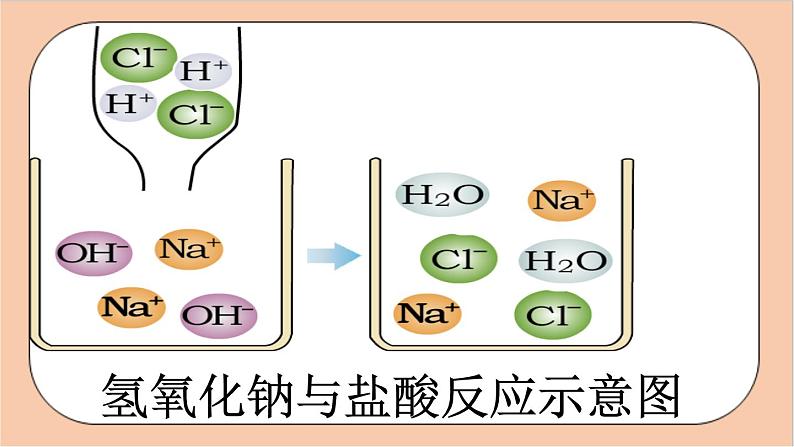
氢氧化钠与盐酸反应示意图
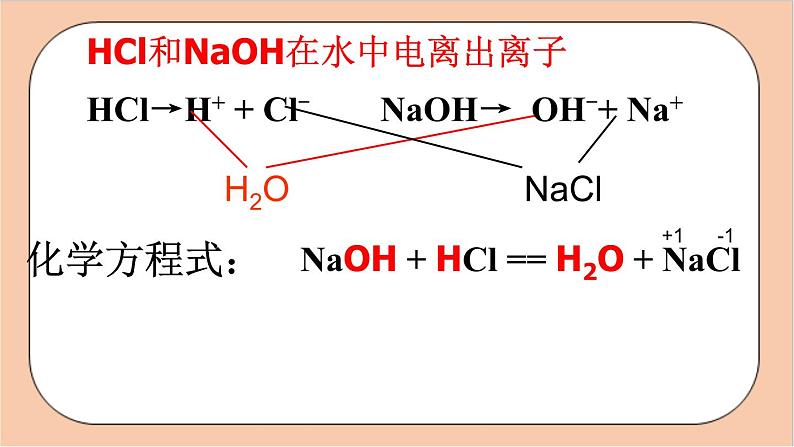
HCl→H+ + Cl-
NaOH→ OH-+ Na+
HCl和NaOH在水中电离出离子
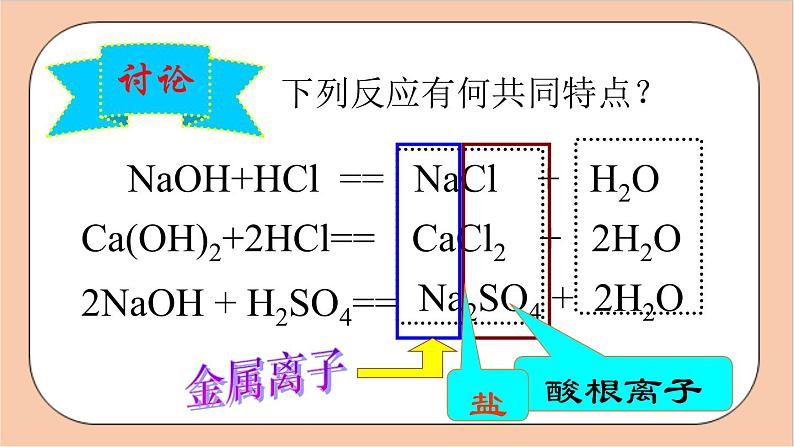
下列反应有何共同特点?
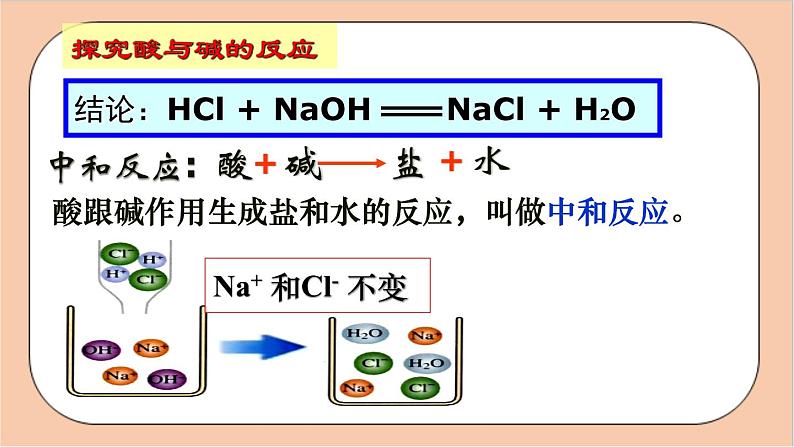
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
结论:HCl + NaOH NaCl + H2O
酸跟碱作用生成盐和水的反应,叫做中和反应。
Na+ 和Cl- 不变
酸中的 和碱中的 ,结合成了_____。
H2O
C
下列哪些是中和反应( ) A、Ca(OH)2+CO2=CaCO3↓+H2O B、Fe2O3+6HCl=2FeCl3+3H2O C、Cu(OH)2+H2SO4=CuSO4+2H2O
结合刚才所学到的知识,你能写出 ①H2SO4 (硫酸)和NaOH(氢氧化钠)反应 ②盐酸和熟石灰反应的化学方程式吗?
2HCl + Ca(OH)2 == CaCl2 +2 H2O
以下的反应均生成盐和水,它们是不是中和反应呢?生成盐和水的反应都是中和反应吗?CO2+2NaOH=Na2CO3+H2O不是中和反应。Fe2O3+6HCl=2FeCl3+3H2O不是中和反应。
注意:有盐和水生成的反应,不一定是中和反应。如酸+金属氧化物→盐+水、碱+非金属氧化物→盐+水的反应不是中和反应。
1.下列物质属于盐的是( )A CuO B Cu(OH)2 C CuSO4 D HCl
2.填写下表(类别按酸、碱、盐、氧化物填写)
3.下列反应,属于中和反应的是( )A Zn +2HCl == ZnCl2 + H2B CuO + 2HCl == CuCl2 + H2OC Cu(OH)2 + H2SO4 == CuSO4 + 2H2OD AgNO3 + HCl == AgCl + HNO3
4、下列各组物质通常借助指示剂才能证明是否反应的是( )A、氢氧化铜和稀盐酸B、石灰石和稀盐酸C、氢氧化钙与碳酸钠反应D、烧碱和稀硫酸
讨论:为什么向酸性土壤中加入熟石灰,而不可以加入 氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
2. 处理工厂的废水
⑴ 如何处理硫酸厂生产中形成的含硫酸的污水?
⑵ 请写出有关反应的化学方程式:
⑶用CaO来中和污水行不行?
H2SO4+ Ca(OH)2 = CaSO4 + 2 H2O
CaO + H2O =Ca(OH)2
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
Al(OH)3 + 3HCl=AlCl3 + 3H2O
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
制作面条时,需加入碱性的 Na2CO3 ,用来防止面粉因发酵 而产生酸味。
松花蛋加工的主要原料:食盐、生石灰、纯碱、水等。
上述两种食品食用时,可添加什么佐料,使食品的味道更为可口?
如何知道食醋和柠檬汁哪种酸性更强?
使用石蕊溶液可以吗?
如NaClNa2SO4等溶液
如HCl、H2SO4等溶液
如Na2CO3、 Ca(OH)2 、NaOH等溶液
能使酚酞试液变红,石蕊试液变蓝
石蕊和酚酞试液都不变色
溶液酸碱度的表示法——pH
1.pH的范围:0~14之间
测定溶液是酸性还是碱性的。(用酸碱指示剂检验)
表示溶液酸碱性的强弱程度。 (用pH试纸测定)
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
如NaCl、Na2SO4等溶液
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
2:溶液的酸碱性与pH的关系:
0 7 14
pH的测定——用pH试纸测定
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
4. 了解溶液的酸碱度有重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
[注:正常雨水的pH约为5.6,酸雨的pH小于5.6];
CO2+H2O=H2CO3
几种作物生长最适宜的pH范围
人体内的一些液体和排泄物的正常pH范围
碱溶液的浓度越大; pH值越大
酸溶液的浓度越大, pH值越小
pH值与同一酸、同一碱浓度的关系:
⑴使酸性溶液的pH升高应采取哪些办法?
⑵使碱性溶液的pH降低应采取哪些办法?
⑴加碱:pH增大至=或﹥ 7
⑵加水:pH增大至≈7
⑴加酸:pH减小到=或﹤ 7
⑵加水:pH减小至≈7
向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液变为______色,此时溶液的pH______________,向此溶液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色时,溶液呈______________性,pH______________;继续滴入稀HCl,溶液呈______________色,pH________,在整个实验过程中,溶液发生了____________反应,化学方程式为_____________________________。
HCl + NaOH === NaCl + H2O
盐酸与氢氧化钠反应过程中溶液酸碱性变化的表示
1、酸加入碱中 当把酸加进碱的时候 ,碱的性质逐渐改变。当全部碱刚好被中和时,溶液的pH值很快地转变至pH=7,如果将更多的酸加入时,酸碱度便会降至pH=7以下。
(中和过程pH的变化)
请思考碱加入酸中pH怎样变化?
思考:在向氢氧化钠溶液中滴加稀盐酸时,溶液的pH是怎样变化的?你能说出曲线上坐标为(18,7)的点所表示的意义吗?
NaOH溶液与盐酸恰好完全反应,溶液显中性pH=7
滴入的稀盐酸的量较少,溶液显碱性
滴入的稀盐酸的量较多,溶液显酸性
(1)NaOH+HCl=NaCl+H2O(2)氢氧化钠溶液 (3)HCl、NaCl (4)红
在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 (1)该反应的化学方程式为: 。(2)该实验操作是将 滴加到另一种溶液中。(3)当加入溶液的质量为a g时,所得溶液中的溶质为(写化学式) 。(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
1. 某无色溶液中滴加石蕊试液显示蓝色,该溶液的pH__________7(填“>”、“=”或“<”).若向该无色溶液中滴加酚酞试液,溶液显示_______色,然后逐滴滴加稀盐酸,溶液的pH会逐渐____________(填“增大”或“减小”),最后观察到的现象是_________________。 2. 某同学想用pH试纸分别测定食盐、稀盐酸、氢氧化钠溶液的pH值。他的操作如下:在玻璃片上依次放好三片pH试纸,先用蒸馏水将三片pH试纸润湿后,将被测的三种溶液分别滴到三片pH试纸上,把试纸显示的颜色与标准比色卡比较,得到三种溶液的pH.请你: (1)指出他操作上的错误____________________. (2)具体分析他测得三种溶液的pH与三种溶液实际pH的关系分别是:食盐________、稀盐酸______、氢氧化钠________。
测试前,先用蒸馏水将三片pH试纸润湿
3.包裹松花蛋用的泥灰配料中有纯碱、食盐、生石灰、草木灰(K 2 CO 3 ),如果去皮后直接食用会有涩味感,要想除去涩味,食用时应加入少量下列物质中的( ) A.白糖 B.食醋 C.酱油 D.调料酒
4.表示用盐酸中和氢氧化钠溶液时,溶液pH与滴加盐酸质量的关系如图,能正确表示pH随加入盐酸质量变化的图象是( )
5.某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛,在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是 ( )
初中化学人教版九年级下册课题2 酸和碱的中和反应优质课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">课题2 酸和碱的中和反应优质课件ppt</a>,共41页。PPT课件主要包含了想一想,金属离子,酸根离子,中和反应的实质,H2O,小试牛刀,中和反应的应用,探究结论,反思提升等内容,欢迎下载使用。
化学九年级下册第十单元 酸和碱课题2 酸和碱的中和反应备课ppt课件: 这是一份化学九年级下册第十单元 酸和碱课题2 酸和碱的中和反应备课ppt课件,共36页。PPT课件主要包含了发现问题,知识讲解,归纳小结,酸碱性,酸碱度,利用下表归纳相关规律,一些物质的pH,进行实验,提出疑问,实验现象无明显现象等内容,欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应图片课件ppt: 这是一份初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应图片课件ppt,共16页。PPT课件主要包含了金属离子,酸根离子,处理工厂的废水,中和硫酸工厂废水,用于医药等内容,欢迎下载使用。













