





还剩40页未读,
继续阅读
成套系列资料,整套一键下载
人教版化学九年级下册 第十一单元《盐 化肥》复习课件
展开
这是一份人教版化学九年级下册 第十一单元《盐 化肥》复习课件,共48页。
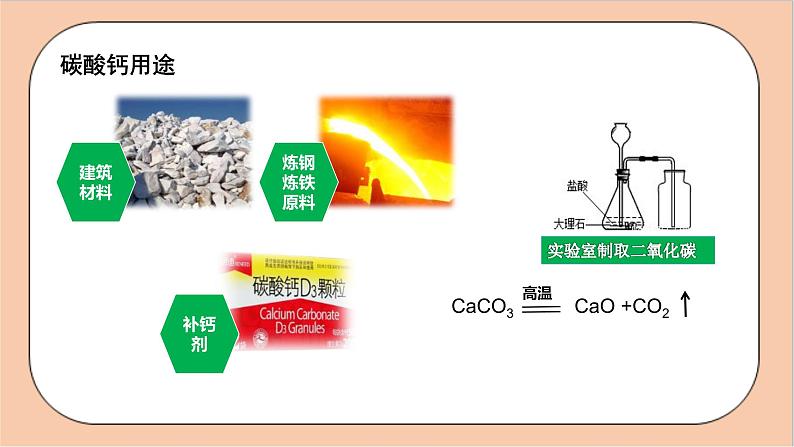
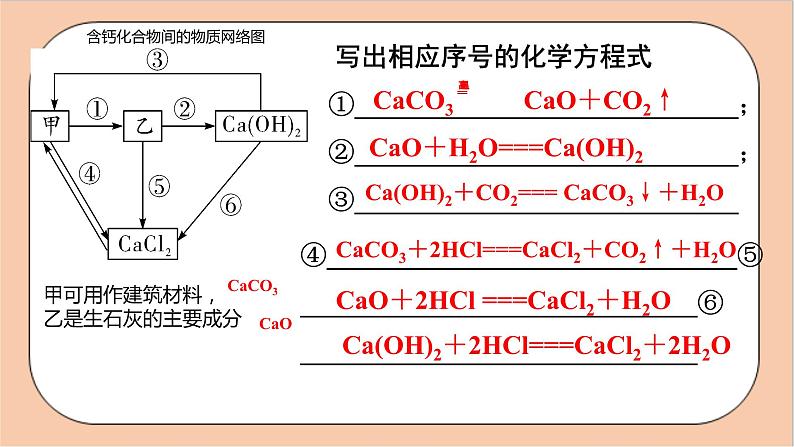
人教版化学九年级下册第十一单元《盐 化肥》复习 盐的定义:在水溶液中解离时产生是 的化合物。 金属离子和酸根离子 食盐是盐,盐就是食盐。你认为是否正确?思考Na2CO3、KCl、CaCO3 、KMnO4 、 NaHCO3都属于盐食盐是由Na+和Cl-组成的化合物。 常见的盐 1、氯化钠NaCl1.物理性质:白色晶体、易溶于水、有咸味2.氯化钠的用途:1)调味品(腌制食品/防腐)2)医疗:生理盐水是0.9%的氯化钠溶液 氯化钠的用途3)农业:用氯化钠来选种4)公路:用氯化钠来消除积雪5)工业:以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等2.碳酸钙 CaCO3 俗称:大理石、石灰石 白色粉末;不溶于水,能溶于酸。用途:实验室和工业上制取CO2的原料,可用作建筑材料、补钙剂等碳酸钙用途含钙化合物间的物质网络图甲可用作建筑材料,乙是生石灰的主要成分CaCO3CaO 写出相应序号的化学方程式①_____________________________;②_____________________________;③_____________________________CaO+H2O===Ca(OH)2Ca(OH)2+CO2=== CaCO3↓+H2O④_______________________________⑤______________________________⑥______________________________CaCO3+2HCl===CaCl2+CO2↑+H2OCaO+2HCl ===CaCl2+H2OCa(OH)2+2HCl===CaCl2+2H2O(1)俗名:纯碱、苏打;(2)化学式: Na2CO3;(3)性状:白色粉末状固体,易溶于水,水溶液显碱性。3.碳酸钠纯碱不是碱,而是盐,但显碱性(4)化学性质:(1)与酸反应(2)与碱反应工业制作烧碱:3.碳酸钠Na2CO3+2HCl=== 2NaCl+CO2↑+H2ONa2CO3+Ca(OH)2=== CaCO3↓+2NaOHNa2CO3+H2SO4=== Na2SO4+H2O+CO2↑(5)碳酸钠的用途:用于玻璃、造纸、纺织和洗涤剂的生产等如何检验CO32-1.加酸 CO32-+2H+==CO2↑+H2O 滴加________,观察到有气泡产生,产生的气体可使澄清石灰水________。2.加Ca2+、Ba2+的溶液 Ca2++CO32-=== CaCO3↓ Ba2++CO32-=== BaCO3↓ 碳酸根有一怕,就怕酸/遇到酸变气水 滴加________溶液,观察到产生白色沉淀,且白色沉淀溶于稀酸。变浑浊稀 盐酸氯化钡实验探究实验〖11-1〗碳酸钠、碳酸氢钠与盐酸反应白色固体溶解,放出使澄清石灰水变浑浊的无色气体白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠能与盐酸反应生成二氧化碳碳酸氢钠能与盐酸反应生成二氧化碳Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑组成里含有碳酸根或者碳酸氢根的盐都能与盐酸反应生成二氧化碳气体实验探究实验〖11-2〗碳酸钠与氢氧化钙反应有白色沉淀生成碳酸钠能与氢氧化钙反应工业制烧碱的反应(1)俗名:小苏打;(2)性状:白色粉末状固体,能溶于水,水溶液有 弱的碱性,较易分解。4.碳酸氢钠 NaHCO3(发酵粉)浓硫酸不慎滴到手里面怎么处理?NaHCO3+H2SO4===以Na2CO3为核心的物质网络图甲_____ 乙__________丙_______HClCa(OH)2CaCl2 相应序号的化学方程式①____________________________________;②____________________________________;③___________________________________;④______________________________。Na2CO3+2HCl=== 2NaCl+CO2↑+H2ONa2CO3+Ca(OH)2=== CaCO3↓+2NaOHNa2CO3+CaCl2=== CaCO3↓+2NaClCO2+2NaOH=== Na2CO3+H2ONaCl 食盐白色固体易溶调味品、生理盐水、消除公路积雪、农业选种、工业原料等Na2CO3纯碱、苏打白色固体易溶玻璃、造纸、纺织、洗涤剂的生产等NaHCO3小苏打白色固体易溶发酵粉、治疗胃酸过多、灭火剂等CaCO3白色固体难溶建筑材料、补钙剂等归纳总结大理石或石灰石的主要成分5.硫酸铜CuSO4无水CuSO4 粉末 白色CuSO4 ·H2O晶体 蓝色 CuSO4 溶液 蓝色作用:无水CuSO4 粉末可用于检验水 可溶性铜盐,如硫酸铜(CuSO4)、氯化铜(CuCl2) (1)CuO→CuSO4:______________________________________(2)CuSO4→Cu(OH)2:___________________________________(3)CuSO4→Cu:________________________________________CuO+H2SO4=== CuSO4+H2OCuSO4+2NaOH=== Cu(OH)2↓+Na2SO4CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4盐的化学性质常见的碱类只溶“钾、钠、氨、钙、钡”。即氢氧化钾、氢氧化钠、氨水、氢氧化钙(微溶)、氢氧化钡可溶于水,其他的碱大多数不溶于水。初中常见的八个沉淀CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3:不溶于 水,但溶于酸AgCl、BaSO4:不溶于水,也不溶于酸化学性质金属+可溶性盐→ 新金属+新盐(置换反应)条件:金属单质(K、Ca、Na除外)的活动性要强 于盐中金属举例:Zn+CuSO4=== ______________酸+盐→ 新酸+新盐条件:生成物中有沉淀或气体或水 碳酸钠与稀硫酸:_____________________ _____________________ 碳酸钙与稀盐酸:_________________________ _______________复分解反应ZnSO4+CuNa2CO3+H2SO4=== CaCO3+2HCl=== CaCl2Na2SO4+H2O+CO2↑+H2O+CO2↑举例复分解反应可溶性盐1+可溶性盐2→ 新盐1+新盐2条件:生成物中有沉淀 Ca(NO3)2+Na2CO3=== CaCO3↓+________ K2SO4+______=== BaSO4↓+2KCl CuCl2+2AgNO3=== ____________________化学性质可溶性碱+可溶性盐→ 新碱+新盐条件:生成物中有沉淀或气体或水 Na2CO3+Ca(OH)2=== _________________ MgCl2+____NaOH=== ____NaCl+Mg(OH)2↓CaCO3↓+2NaOH2BaCl222NaNO32AgCl↓+Cu(NO3)2 举例举例(1)Cl-的检验:先加入___________,有白色沉淀生成,再加入稀硝酸,白色沉淀不溶解。(2) 的检验:先加入___________,有白色沉淀生成,再加入稀硝酸,白色沉淀不溶解。硝酸银溶液硝酸钡溶液小结:盐的化学性质与金属反应盐的化学性质Fe+CuSO4=Cu+FeSO4Na2CO3+2HCl=2NaCl+H2O+CO2↑与酸反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH与某些碱反应 Na2SO4+BaCl2=BaSO4↓+2NaCl与某些盐反应观察这五个反应有什么共同特点?(1)HCl+NaOH==H2O+NaCl 由两种化合物互相交换成分,生成另外两种化合物(2)CaCO3+2HCl==CaCl2+H2O+CO2↑(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓(4)Na2SO4+BaCl2==2NaCl+BaSO4↓ 复分解反应(5)Fe2O3+6HCl==2FeCl3+3H2O↓总结规律复分解反应发生的条件两交换,价不变探究所提供的五种溶液之间的反应,√√√×2NaOH+H2SO4= Na2SO4 + 2H2ONaCl+ H2SO4=不反应K2CO3+H2SO4= K2SO4 + H2O + CO2 Ba(NO3)2+ H2SO4= BaSO4 + 2HNO3中和反应,有水生成有气体生成有白色沉淀生成物质混合物纯净物单质化合物盐氧化物酸碱Cu、Fe、Ag N2 、O2 、C H2O 、CO2 、 CuOHCl、H2SO4 NaOH 、Ca(OH)2 BaSO4、 Na2CO3 (一种物质)(多种物质)(一种元素)(多种元素)溶液、合金、混合气体(如空气)、矿石等 物质的分类 B 2.将下列各组物质分别混合后同时加入水中,能得到无色透明溶液的组别是( )A.FeCl3、KNO3、NaOH B.AgNO3、NaNO3、CaCl2C.CuSO4、Na2SO4、NaOH D.Na2CO3、Na2SO4、KCl D Ba(OH)2 Ba(OH)2或Ca(OH)2 HCl BaCl2 HCl AgNO3 【课堂练习2】常见液体除杂:1.NaNO3(NaCl):加入适量的 溶液,过滤。 2.NaCl(Na2CO3):加入足量的 溶液,蒸发。 3.NaCl(Na2SO4):加入适量的 溶液,过滤。 4.NaCl(NaOH):加入足量的 溶液,蒸发。 5.NaOH(Na2CO3):加入适量的 溶液,过滤。 6.NaCl(CuSO4):加入适量的 溶液,过滤。 第二课时 化肥第十一单元 盐 化肥肥料简单分类肥料化学肥料农家肥料:人畜粪便、植物体等沤制的天然有机肥料等。氮肥磷肥钾肥复合肥料以化学和物理的方法制成的含农作物生长所需营养元素的化学肥料。简称化肥。1.氮肥作用:氮是作物体内蛋白质、核酸和叶绿素的重要成分, 氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。常见的氮肥尿素:CO(NH2)2氨水:NH3·H2O铵盐:NH4HCO3、NH4Cl、(NH4)2SO4硝酸盐:NH4NO3、NaNO3植物缺氮时的表现缺氮植株矮小瘦弱,叶片发黄2.磷肥作用:磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,参与各种重要的代谢活动。磷可促进作物生长,使之穗粒饱满,还可促进作物根系发达,增强抗寒、抗旱能力。常见的磷肥磷矿粉:Ca3(PO4)2钙镁磷肥:钙和镁的磷酸盐重过磷酸钙:Ca(H2PO4)2过磷酸钙:Ca(H2PO4)2+CaSO4植物缺磷时的表现缺磷植株生长迟缓、穗粒少而不饱满3.钾肥作用:钾在植物代谢活跃的器官和组织中分布量较高。钾具有保证各种代谢过程顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能。 常见的钾肥:硫酸钾(K2SO4)、氯化钾(KCl)、碳酸钾(K2CO3 ,草木灰,显碱性)叶尖及叶缘呈黄色,甚至焦枯茎秆软弱,易倒伏植物缺钾时的表现3.复合肥作用:复合肥料是含有两种或两种以上营养元素的化肥,能同时均匀地供给多种养分,有效成分高常见的复合肥:磷酸二氢铵(NH4H2PO4)磷酸氢二铵(NH4)2HPO4、硝酸钾(KNO3)二 化肥、农药的使用对环境的影响1.化肥的使用对环境的影响营养元素含量高,营养全面,肥效快原料广泛,可工业化生产,降低劳动强度提高农作物的产量具有重要作用土壤污染:重金属元素、有毒有机物和放射性物质大气污染:N2O、NH3、H2S水污染:水中氮、磷含量高,水体富营养化2.农药的使用对环境的影响保证农业的高产丰收 农药本身是有毒物质,在杀死病虫害的同时也带来了对自然环境的污染和对人体健康的危害 化肥考点1 分类概念:含有营养元素(氮、磷、钾)中___元素的化肥;如尿素 [CO(NH2)2]、碳酸氢铵(NH4HCO3)和氯化铵(NH4Cl)作用:促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质的含量氮肥磷肥概念:含有营养元素(氮、磷、钾)中___元素的化肥;如磷矿粉 [Ca3(PO4)2]作用:促进作物生长,增强作物抗寒、抗旱能力氮磷概念:含有营养元素(氮、磷、钾)中___元素的化肥;如 硫酸钾(K2SO4)、氯化钾(KCl)作用:促进植物生长、增强抗病虫害和抗倒伏能力概念:含有营养元素(氮、磷、钾)中___________元素的化肥; 如硝酸钾(KNO3)、磷酸二氢铵(NH4H2PO4)作用:同时提供两种或三种营养元素钾肥复合肥钾两种或三种鉴别化肥与农药利:促进植物生长,提高粮食产量弊:大量使用会造成污染,如使土壤酸化或退化、使水体富营养化等⇒要 合理施用液 化肥考点2 (2021省卷8题3分)下表是某番茄无土栽培营养液的配方,其中属于磷肥的是( )A. MgSO4 B. Ca(NO3)2 C. KNO3 D. NH4H2PO4D (2016省卷13题2分)公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是( )A. NH4HCO3 B. KNO3 C. Ca(H2PO4)2 D. (NH4)3PO4B (省卷真题组合)化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是________。A. 尿素[CO(NH2)2]属于复合肥料B. 大量施用化肥以提高农作物产量C. 铵态氮肥与草木灰混用,会降低肥效D. 棉花叶片枯黄,应施用硫酸钾等钾肥E. 如果庄稼的茎长得不好,可施用钾肥F. 氮肥氯化铵与碱研磨可放出氨气,氮肥尿素与碱研磨也能放出氨气G. 施用农药造成污染,应禁止使用答案:CE课程结束
人教版化学九年级下册第十一单元《盐 化肥》复习 盐的定义:在水溶液中解离时产生是 的化合物。 金属离子和酸根离子 食盐是盐,盐就是食盐。你认为是否正确?思考Na2CO3、KCl、CaCO3 、KMnO4 、 NaHCO3都属于盐食盐是由Na+和Cl-组成的化合物。 常见的盐 1、氯化钠NaCl1.物理性质:白色晶体、易溶于水、有咸味2.氯化钠的用途:1)调味品(腌制食品/防腐)2)医疗:生理盐水是0.9%的氯化钠溶液 氯化钠的用途3)农业:用氯化钠来选种4)公路:用氯化钠来消除积雪5)工业:以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等2.碳酸钙 CaCO3 俗称:大理石、石灰石 白色粉末;不溶于水,能溶于酸。用途:实验室和工业上制取CO2的原料,可用作建筑材料、补钙剂等碳酸钙用途含钙化合物间的物质网络图甲可用作建筑材料,乙是生石灰的主要成分CaCO3CaO 写出相应序号的化学方程式①_____________________________;②_____________________________;③_____________________________CaO+H2O===Ca(OH)2Ca(OH)2+CO2=== CaCO3↓+H2O④_______________________________⑤______________________________⑥______________________________CaCO3+2HCl===CaCl2+CO2↑+H2OCaO+2HCl ===CaCl2+H2OCa(OH)2+2HCl===CaCl2+2H2O(1)俗名:纯碱、苏打;(2)化学式: Na2CO3;(3)性状:白色粉末状固体,易溶于水,水溶液显碱性。3.碳酸钠纯碱不是碱,而是盐,但显碱性(4)化学性质:(1)与酸反应(2)与碱反应工业制作烧碱:3.碳酸钠Na2CO3+2HCl=== 2NaCl+CO2↑+H2ONa2CO3+Ca(OH)2=== CaCO3↓+2NaOHNa2CO3+H2SO4=== Na2SO4+H2O+CO2↑(5)碳酸钠的用途:用于玻璃、造纸、纺织和洗涤剂的生产等如何检验CO32-1.加酸 CO32-+2H+==CO2↑+H2O 滴加________,观察到有气泡产生,产生的气体可使澄清石灰水________。2.加Ca2+、Ba2+的溶液 Ca2++CO32-=== CaCO3↓ Ba2++CO32-=== BaCO3↓ 碳酸根有一怕,就怕酸/遇到酸变气水 滴加________溶液,观察到产生白色沉淀,且白色沉淀溶于稀酸。变浑浊稀 盐酸氯化钡实验探究实验〖11-1〗碳酸钠、碳酸氢钠与盐酸反应白色固体溶解,放出使澄清石灰水变浑浊的无色气体白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠能与盐酸反应生成二氧化碳碳酸氢钠能与盐酸反应生成二氧化碳Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑组成里含有碳酸根或者碳酸氢根的盐都能与盐酸反应生成二氧化碳气体实验探究实验〖11-2〗碳酸钠与氢氧化钙反应有白色沉淀生成碳酸钠能与氢氧化钙反应工业制烧碱的反应(1)俗名:小苏打;(2)性状:白色粉末状固体,能溶于水,水溶液有 弱的碱性,较易分解。4.碳酸氢钠 NaHCO3(发酵粉)浓硫酸不慎滴到手里面怎么处理?NaHCO3+H2SO4===以Na2CO3为核心的物质网络图甲_____ 乙__________丙_______HClCa(OH)2CaCl2 相应序号的化学方程式①____________________________________;②____________________________________;③___________________________________;④______________________________。Na2CO3+2HCl=== 2NaCl+CO2↑+H2ONa2CO3+Ca(OH)2=== CaCO3↓+2NaOHNa2CO3+CaCl2=== CaCO3↓+2NaClCO2+2NaOH=== Na2CO3+H2ONaCl 食盐白色固体易溶调味品、生理盐水、消除公路积雪、农业选种、工业原料等Na2CO3纯碱、苏打白色固体易溶玻璃、造纸、纺织、洗涤剂的生产等NaHCO3小苏打白色固体易溶发酵粉、治疗胃酸过多、灭火剂等CaCO3白色固体难溶建筑材料、补钙剂等归纳总结大理石或石灰石的主要成分5.硫酸铜CuSO4无水CuSO4 粉末 白色CuSO4 ·H2O晶体 蓝色 CuSO4 溶液 蓝色作用:无水CuSO4 粉末可用于检验水 可溶性铜盐,如硫酸铜(CuSO4)、氯化铜(CuCl2) (1)CuO→CuSO4:______________________________________(2)CuSO4→Cu(OH)2:___________________________________(3)CuSO4→Cu:________________________________________CuO+H2SO4=== CuSO4+H2OCuSO4+2NaOH=== Cu(OH)2↓+Na2SO4CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4盐的化学性质常见的碱类只溶“钾、钠、氨、钙、钡”。即氢氧化钾、氢氧化钠、氨水、氢氧化钙(微溶)、氢氧化钡可溶于水,其他的碱大多数不溶于水。初中常见的八个沉淀CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3:不溶于 水,但溶于酸AgCl、BaSO4:不溶于水,也不溶于酸化学性质金属+可溶性盐→ 新金属+新盐(置换反应)条件:金属单质(K、Ca、Na除外)的活动性要强 于盐中金属举例:Zn+CuSO4=== ______________酸+盐→ 新酸+新盐条件:生成物中有沉淀或气体或水 碳酸钠与稀硫酸:_____________________ _____________________ 碳酸钙与稀盐酸:_________________________ _______________复分解反应ZnSO4+CuNa2CO3+H2SO4=== CaCO3+2HCl=== CaCl2Na2SO4+H2O+CO2↑+H2O+CO2↑举例复分解反应可溶性盐1+可溶性盐2→ 新盐1+新盐2条件:生成物中有沉淀 Ca(NO3)2+Na2CO3=== CaCO3↓+________ K2SO4+______=== BaSO4↓+2KCl CuCl2+2AgNO3=== ____________________化学性质可溶性碱+可溶性盐→ 新碱+新盐条件:生成物中有沉淀或气体或水 Na2CO3+Ca(OH)2=== _________________ MgCl2+____NaOH=== ____NaCl+Mg(OH)2↓CaCO3↓+2NaOH2BaCl222NaNO32AgCl↓+Cu(NO3)2 举例举例(1)Cl-的检验:先加入___________,有白色沉淀生成,再加入稀硝酸,白色沉淀不溶解。(2) 的检验:先加入___________,有白色沉淀生成,再加入稀硝酸,白色沉淀不溶解。硝酸银溶液硝酸钡溶液小结:盐的化学性质与金属反应盐的化学性质Fe+CuSO4=Cu+FeSO4Na2CO3+2HCl=2NaCl+H2O+CO2↑与酸反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH与某些碱反应 Na2SO4+BaCl2=BaSO4↓+2NaCl与某些盐反应观察这五个反应有什么共同特点?(1)HCl+NaOH==H2O+NaCl 由两种化合物互相交换成分,生成另外两种化合物(2)CaCO3+2HCl==CaCl2+H2O+CO2↑(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓(4)Na2SO4+BaCl2==2NaCl+BaSO4↓ 复分解反应(5)Fe2O3+6HCl==2FeCl3+3H2O↓总结规律复分解反应发生的条件两交换,价不变探究所提供的五种溶液之间的反应,√√√×2NaOH+H2SO4= Na2SO4 + 2H2ONaCl+ H2SO4=不反应K2CO3+H2SO4= K2SO4 + H2O + CO2 Ba(NO3)2+ H2SO4= BaSO4 + 2HNO3中和反应,有水生成有气体生成有白色沉淀生成物质混合物纯净物单质化合物盐氧化物酸碱Cu、Fe、Ag N2 、O2 、C H2O 、CO2 、 CuOHCl、H2SO4 NaOH 、Ca(OH)2 BaSO4、 Na2CO3 (一种物质)(多种物质)(一种元素)(多种元素)溶液、合金、混合气体(如空气)、矿石等 物质的分类 B 2.将下列各组物质分别混合后同时加入水中,能得到无色透明溶液的组别是( )A.FeCl3、KNO3、NaOH B.AgNO3、NaNO3、CaCl2C.CuSO4、Na2SO4、NaOH D.Na2CO3、Na2SO4、KCl D Ba(OH)2 Ba(OH)2或Ca(OH)2 HCl BaCl2 HCl AgNO3 【课堂练习2】常见液体除杂:1.NaNO3(NaCl):加入适量的 溶液,过滤。 2.NaCl(Na2CO3):加入足量的 溶液,蒸发。 3.NaCl(Na2SO4):加入适量的 溶液,过滤。 4.NaCl(NaOH):加入足量的 溶液,蒸发。 5.NaOH(Na2CO3):加入适量的 溶液,过滤。 6.NaCl(CuSO4):加入适量的 溶液,过滤。 第二课时 化肥第十一单元 盐 化肥肥料简单分类肥料化学肥料农家肥料:人畜粪便、植物体等沤制的天然有机肥料等。氮肥磷肥钾肥复合肥料以化学和物理的方法制成的含农作物生长所需营养元素的化学肥料。简称化肥。1.氮肥作用:氮是作物体内蛋白质、核酸和叶绿素的重要成分, 氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。常见的氮肥尿素:CO(NH2)2氨水:NH3·H2O铵盐:NH4HCO3、NH4Cl、(NH4)2SO4硝酸盐:NH4NO3、NaNO3植物缺氮时的表现缺氮植株矮小瘦弱,叶片发黄2.磷肥作用:磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,参与各种重要的代谢活动。磷可促进作物生长,使之穗粒饱满,还可促进作物根系发达,增强抗寒、抗旱能力。常见的磷肥磷矿粉:Ca3(PO4)2钙镁磷肥:钙和镁的磷酸盐重过磷酸钙:Ca(H2PO4)2过磷酸钙:Ca(H2PO4)2+CaSO4植物缺磷时的表现缺磷植株生长迟缓、穗粒少而不饱满3.钾肥作用:钾在植物代谢活跃的器官和组织中分布量较高。钾具有保证各种代谢过程顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能。 常见的钾肥:硫酸钾(K2SO4)、氯化钾(KCl)、碳酸钾(K2CO3 ,草木灰,显碱性)叶尖及叶缘呈黄色,甚至焦枯茎秆软弱,易倒伏植物缺钾时的表现3.复合肥作用:复合肥料是含有两种或两种以上营养元素的化肥,能同时均匀地供给多种养分,有效成分高常见的复合肥:磷酸二氢铵(NH4H2PO4)磷酸氢二铵(NH4)2HPO4、硝酸钾(KNO3)二 化肥、农药的使用对环境的影响1.化肥的使用对环境的影响营养元素含量高,营养全面,肥效快原料广泛,可工业化生产,降低劳动强度提高农作物的产量具有重要作用土壤污染:重金属元素、有毒有机物和放射性物质大气污染:N2O、NH3、H2S水污染:水中氮、磷含量高,水体富营养化2.农药的使用对环境的影响保证农业的高产丰收 农药本身是有毒物质,在杀死病虫害的同时也带来了对自然环境的污染和对人体健康的危害 化肥考点1 分类概念:含有营养元素(氮、磷、钾)中___元素的化肥;如尿素 [CO(NH2)2]、碳酸氢铵(NH4HCO3)和氯化铵(NH4Cl)作用:促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质的含量氮肥磷肥概念:含有营养元素(氮、磷、钾)中___元素的化肥;如磷矿粉 [Ca3(PO4)2]作用:促进作物生长,增强作物抗寒、抗旱能力氮磷概念:含有营养元素(氮、磷、钾)中___元素的化肥;如 硫酸钾(K2SO4)、氯化钾(KCl)作用:促进植物生长、增强抗病虫害和抗倒伏能力概念:含有营养元素(氮、磷、钾)中___________元素的化肥; 如硝酸钾(KNO3)、磷酸二氢铵(NH4H2PO4)作用:同时提供两种或三种营养元素钾肥复合肥钾两种或三种鉴别化肥与农药利:促进植物生长,提高粮食产量弊:大量使用会造成污染,如使土壤酸化或退化、使水体富营养化等⇒要 合理施用液 化肥考点2 (2021省卷8题3分)下表是某番茄无土栽培营养液的配方,其中属于磷肥的是( )A. MgSO4 B. Ca(NO3)2 C. KNO3 D. NH4H2PO4D (2016省卷13题2分)公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是( )A. NH4HCO3 B. KNO3 C. Ca(H2PO4)2 D. (NH4)3PO4B (省卷真题组合)化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是________。A. 尿素[CO(NH2)2]属于复合肥料B. 大量施用化肥以提高农作物产量C. 铵态氮肥与草木灰混用,会降低肥效D. 棉花叶片枯黄,应施用硫酸钾等钾肥E. 如果庄稼的茎长得不好,可施用钾肥F. 氮肥氯化铵与碱研磨可放出氨气,氮肥尿素与碱研磨也能放出氨气G. 施用农药造成污染,应禁止使用答案:CE课程结束
相关资料
更多









