所属成套资源:【讲通练透】高考化学一轮复习知识大盘点(思维导图+知识解读+易混易错+典例分析)
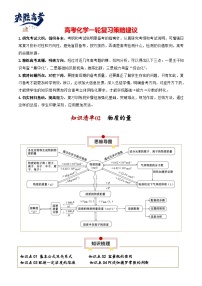
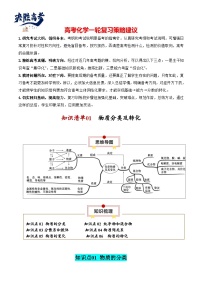
【讲通练透】高考化学知识清单21 化学反应速率与化学平衡(思维导图+知识解读+易混易错+典例分析)
展开
这是一份【讲通练透】高考化学知识清单21 化学反应速率与化学平衡(思维导图+知识解读+易混易错+典例分析),共37页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力,1,与0,06等内容,欢迎下载使用。
2.精练高考真题,明确方向。经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药。要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力。复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
知识清单21 化学反应速率与化学平衡
知识点01 化学反应速率
1.概念:用来衡量化学反应进行快慢的物理量
2.表示:单位时间内某种量的变化量
3.化学反应速率的计算
(1)常规公式:v==
①常用单位:ml·L-1·s-1或ml·L-1·min-1或ml·L-1·h-1
②适用范围:表示气体物质或溶液中可溶性物质的速率,不表示固体或纯液体物质的速率
(2)非常规公式:v=(X代表n、P、m、V等量)
①常用单位:ml·min-1、Pa·min-1、g·min-1、L·min-1
②适用范围:任何物质的反应速率
(3)利用关系式计算
①应用前提:同一化学反应
②常用关系:速率比=化学计量数比=物质的量浓度变化比=物质的量变化比
4.大小比较
(1)比较前提:同一反应,同一物质,同一单位
(2)换算方法:各物质的速率除以相应的化学计量数,数大的速率快
5.说明
(1)化学反应速率表示某段时间内的平均反应速率,不表示即时速率
(2)化学反应速率只有正值,没有负值
(3)随着反应的进行,反应物的浓度等量逐渐减小,反应速率越来越慢
1.速率大小比较“三步骤”
(1)“一看”单位是否一致,不一致转化为同一单位。
(2)“二化”将不同物质表示的反应速率转化为同一物质表示的化学反应速率。
(3)“三比较”比较数值大小。
2.比较反应速率快慢的常用方法:
(1)定性描述——通过在相同时间点,不同的实验现象来判断反应的快慢。
①观察产生气泡的快慢;
②观察试管中剩余锌粒的多少;
③用手接触试管,感受试管外壁温度的高低。
(2)定量描述——通过实验测量来判断反应的快慢。
①测定气体的体积或体系的压强;
②测定物质的物质的量的变化;
③测定物质或离子的浓度变化;
④测定体系的温度或反应的热量变化。
若有多种测量方案时,一般采取易操作,现象明显的实验方案。
【典例01】(2023春·四川内江·高三四川省资中县第二中学校考开学考试)对于可逆反应,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.B.
C.D.
【答案】B
【分析】速率比等于化学计量数比,都转化为用A物质表示的反应速率,速率的单位都用ml/(L·min),然后进行比较。
【解析】A.;B.v(A)=v(B)= ×1.5 ml⋅L−1⋅min−1=1.0 ml⋅L−1⋅min−1;C.v(A)= v(D)=0.8 ml⋅L−1⋅min−1;D.v(A)=v(C)=×0.1 ml⋅L−1⋅min−1=0.05ml⋅L−1⋅min−1;可见反应速率最大的是1ml⋅L−1⋅min−1;故选B。
【典例02】(2023·辽宁丹东·统考一模)恒温恒容条件下,向密闭容器中加入一定量X,反应X=2Z经历两步:①X→Y;②Y→2Z。图为该体系中X、Y、Z浓度随时间变化的曲线。下列说法正确的是
A.a为随t的变化曲线
B.时,Y的消耗速率大于生成速率
C.随着的减小,反应①、②速率均降低
D.体系中
【答案】B
【解析】A.反应X=2Z经历两步:①X→Y;②Y→2Z,可知c(Y)先增大,后减小,A错误;B.t1时Y的浓度在下降,消耗速率大于生成速率,B正确;C.由图甲中的信息可知,随c(X)的减小,c(Y)先增大后减小,c(Z)增大,因此,反应①的速率随c(X)的减小而减小,而反应②的速率先增大后减小,C错误;D.根据体系中发生的反应可知,在Y的浓度达到最大值之前,单位时间内X的减少量等于Y和Z的增加量,因此,v(X)=v(Y)+v(Z),但是,在Y的浓度达到最大值之后,单位时间内Z的增加量等于Y和X的减少量,故2v(X)+2v(Y)=v(Z),D错误;故选B。
知识点02 影响化学反应速率的因素
1.主要原因:反应物本身的性质
2.基本规律:外界条件越高,速率越快
(1)温度:温度越高,化学反应速率越快
(2)压强:气体反应的压强越大,化学反应速率越快
(3)浓度:浓度越大,化学反应速率越快
(4)催化剂:显著的改变(加快或减慢)正逆反应速率,一般有催化剂,化学反应速率越快
(5)接触面积:反应物的颗粒越小,接触面积越大,化学反应速率越快
(6)原电池:形成原电池,可以加快氧化还原反应的速率
3.特殊情况
(1)温度
①催化反应,升高温度,催化剂可能失活,反应速率减慢
②有机反应,升高温度,有可能发生副反应,主反应速率减慢
(2)压强
①改变非气体反应的压强,反应速率不变
②改变等体反应的压强,v正和v逆变化幅度相同
(3)浓度
①固体和纯液体的浓度为定值,改变固体或纯液体的用量,反应速率不变
②加入固体物质,有可能改变接触面积,反应速率可能加快
(4)无关气体
①恒容容器通无关气体,压强增大,浓度不变,速率不变
②恒压容器通无关气体,体积变大,浓度减小,速率减慢
4.活化分子、有效碰撞与反应速率的关系实质
5.速率-时间图像
(1)温度:升高温度,瞬间v正和v逆均增大
或
(2)压强:增大压强,气体物质的浓度均增大,瞬间v正和v逆均增大
或
(3)浓度
①增大反应物浓度,瞬间v正增大,v逆不变
②增大生成物浓度,瞬间v正不变,v逆增大
或
③恒压:增大反应物浓度,瞬间v正增大,v逆减慢
④恒压:增大生成物浓度,瞬间v正减慢,v逆增大
(4)催化剂:能够同等程度改变正逆反应速率
6.全程速率-时间图像
(1)OB段反应速率变化的可能原因为:
①反应放热,使温度升高,反应速率加快
②反应生成催化剂,反应速率加快
(2)BC段反应速率变化的可能原因为:反应物浓度降低,反应速率减慢
7.探究外界条件对化学反应速率的影响
(1)方法:控制变量法
(2)溶液反应:加水调节溶液的总体积不变,以保证某种成分的浓度不变
(3)实例:探究Y溶液浓度对反应速率的影响
8.速率方程
(1)意义:表示反应物浓度与反应速率的定量关系
(2)举例:A2(g)+B2(g)2AB(g),v=kcα(A2)·cβ(B2)
(3)测定方法:α、β必须通过实验测定,无法直接写出。
①H2+Cl22HCl,v=k[c(H2)][c(Cl2)]1/2
②N2(g)+3H2(g)2NH3(g),v=kc(N2)·c1.5(H2)·c-1(NH3)
(4)反应速率常数
①符号:反应速率方程中的比例系数k
②意义:通常k越大,反应进行得越快,反应的活化能越小
③影响因素:温度、催化剂、固体表面性质
不同的外界条件对化学反应速率影响的注意点:
1.浓度:增大浓度、速率增大;减少浓度、速率减小;改变纯固体或纯液体的量对化学反应速率没有影响。
2.压强:①必须有气体参加;②压强的改变实质是改变浓度。
3.温度:无论是吸热反应还是放热反应,升高温度,速率增大,降低温度,速率减小。
4.催化剂:催化剂只改变反应速率,不改变反应的方向,也不改变反应热的大小,若是可逆反应,则同等程度改变正、逆反应速率。
【典例03】(2023·浙江宁波·镇海中学校考模拟预测)一定温度下,利用测压法在刚性反应器中研究固体催化剂作用下的A的分解反应:。体系的总压强p随时间t的变化如表所示:
下列说法不正确的是
A.100~150min,消耗A的平均速率为
B.其他条件不变,420min时向刚性容器中再充入少量A,反应速率比原420min时大
C.推测x为18.1
D.升高体系温度,不一定能加快反应速率
【答案】B
【解析】A.反应,反应前后气体压强变化和生成C的量成正比,同时A的变化为变化量的,用压强代表浓度,则100~150min体系压强变化=13.9kPa-13.3kPa=0.06kPa,消耗A的平均速率==0.006kPa⋅min-1,故A正确;B.其他条件不变,420min时向刚性容器中再充入少量A,相当于增大压强,反应在固体催化剂表面进行,固体表面积一定,反应速率不变,故B错误;C.0~100min,压强变化为1.2kPa,150min~250min,压强变化1.2kPa,则100kPa~500kPa,体系压强变化1.2×4kPa=4.8kPa,则500min时,体系压强=13.3kPa+4.8kPa=18.1kPa,故C正确;D.反应在催化剂表面反应,升高体系温度,催化剂活性减小时,反应速率减小,不一定能加快反应速率,故D正确;故选:B。
【典例04】(2023·北京西城·统考一模)探究影响H2O2分解速率的影响因素,实验方案如图。
下列说法不正确的是
A.对比①②,可探究FeCl3溶液对H2O2分解速率的影响
B.对比②③④,可探究温度对H2O2分解速率的影响
C.H2O2是直线形的非极性分子
D.H2O2易溶于水,主要是由于H2O2与H2O分子之间能形成氢键
【答案】C
【解析】A.实验②是在实验①的溶液中加入催化剂FeCl3,与实验①做对比实验,可探究FeCl3溶液对H2O2分解速率的影响,A正确;B.实验②是参照,③、④相当于在②的基础上升高和降低温度,可探究温度对H2O2分解速率的影响,B正确;C.H2O2的分子结构为,分子结构不对称,为极性分子,C不正确;D.H2O2为极性分子,水也为极性分子,H2O2易溶于水,满足相似相溶原理,更主要是H2O2与H2O分子之间能形成氢键,D正确;故选C。
知识点03 可逆反应
1.可逆反应的判断:反应形式相反,反应条件相同
2.可逆反应的特点
(1)同步性:正逆反应同时进行
(2)等同性:反应条件完全相同
(3)共存性
①反应不可能进行到底,即反应体系中反应物与生成物共存
②各组分的浓度都大于零
3.证明某反应为可逆反应
(1)检验出某种生成物
(2)检验量少的反应物是否有剩余
4.化学平衡状态的特征
【典例05】已知:溶液是检验的试剂,若溶液中存在,将产生蓝色沉淀。将的KI溶液和的溶液等体积混合后,取混合液分别完成下列实验,其中能说明溶液中存在化学平衡“”的是
A.①B.②和④C.③和④D.①和②
【答案】A
【详解】的溶液c(Fe3+)为0.1,与0.2 的KI等体积混合反应,I-过量。
①检验出Fe3+,说明过量的KI仍不能使Fe3+完全转化,该反应为可逆反应;②由于KI过量,不管反应是否可逆,一定能检验到I-;③检验到Fe2+,只能证明反应已发生,与可逆反应无关;④同③,证明反应已发生;因此,实验①可证明反应为可逆反应;
答案选A。
【典例06】在一密闭容器中进行反应:2SO2(g)+O2(g)⇌2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.1 ml/L、0.05 ml/L、0.3 ml/L。当反应达到平衡时,可能存在的数据是
A.SO2为0.4 ml/L,O2为0.2 ml/L
B.SO2、SO3均为0.8 ml/L
C.SO3为0.4 ml/L
D.SO2为0.35 ml/L
【答案】D
【分析】,该反应为可逆反应,物质浓度范围:0<c(SO2)<0.4 ml/L,0<c(O2)<0.2 ml/L,0<c(SO3)<0.4 ml/L。
【详解】A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度分别为0.4ml/L、0.2ml/L,三氧化硫不可能完全转化,故A错误;
B.根据分析和硫原子守恒可知c(SO2)+ c(SO3)=0.4ml/L,当SO2、SO3均为0.8 ml/L时,0.8 ml/L+0.8 ml/L
相关试卷
这是一份【讲通练透】高考化学知识清单17 晶体结构与性质(思维导图+知识解读+易混易错+典例分析),共19页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。
这是一份【讲通练透】高考化学知识清单16 分子结构与性质(思维导图+知识解读+易混易错+典例分析),共22页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。
这是一份【讲通练透】高考化学知识清单15 原子结构与性质(思维导图+知识解读+易混易错+典例分析),共15页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。