

辽宁省沈阳市第二中学2023-2024学年高三下学期4月份阶段测试化学试卷(含答案)
展开考试时间为75分钟,满分100分
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 F-19 Na-23 Xe-131
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.化学推动着社会的进步和科技的发展。下列说法正确的是( )
A.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
B.燃煤脱硫可有效地减少空气污染,且有利于实现“碳达峰、碳中和”
C.“天和”核心舱中使用的氮化硼陶瓷基复合材料属于有机高分子材料
D.以和为原料人工合成淀粉的过程中发生了氧化还原反应
2.硫及硫的化合物在生产、生活中有广泛应用。、和三聚的,的分子结构如图所示,下列有关叙述正确的是( )
A.的熔点高于的熔点
B.分子和分子都是极性分子
C.分子呈正八面体形且键角为120°
D.和和中S原子的杂化类型均为杂化
3.代表阿伏加德罗常数的值。下列说法正确的是( )
A.1m1与足量充分反应时转移个电子
B.在氯碱工业中,制备80g烧碱时,阴极生成气体的分子数为
C.1L溶液中含氧原子数目为
D.25℃时,,则饱和溶液中数目为
4.下列物质的性质与用途的对应关系正确的是( )
A.具有漂白性,可用作葡萄酒的添加剂
B.稀硝酸具有强氧化性,常温下可清洗附着在试管内壁的银镜
C.石墨晶体内含大键,可用作润滑剂
D.非金属性C>Si,工业上用焦碳与反应制备粗Si
5.已知甲、乙都为单质,丙为化合物,能实现下述转化关系。下列说法正确的是( )
甲+乙丙溶液甲
A.若丙溶于水后得到强碱溶液,则甲可能是
B.若溶液丙遇放出气体,则甲不可能是
C.若溶液丙中滴加NaOH溶液有蓝色沉淀生成,则甲一定为Cu
D.若溶液丙中滴加NaOH溶液有白色沉淀生成后沉淀溶解,则甲可能为Al
6.下列装置适用于实验室制氨并验证氨的某化学性质,其中能达到实验目的的是( )
A.①是氨气发生装置B.②检验铜与浓硫酸反应的氧化产物
C.③可验证氨气的还原性D.④是氨气的吸收装置
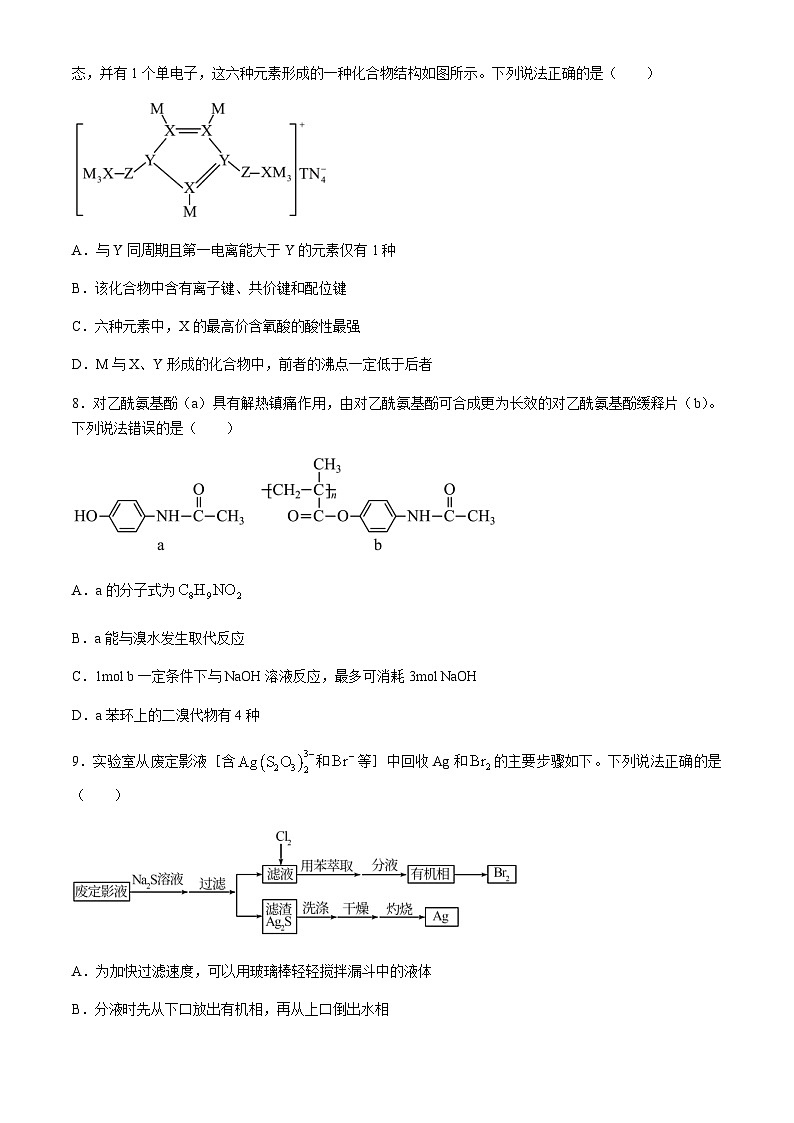
7.M、N、Z、Y、X、T是原子半径依次增大的短周期主族元素,基态N原子核外电子有5种空间运动状态,并有1个单电子,这六种元素形成的一种化合物结构如图所示。下列说法正确的是( )
A.与Y同周期且第一电离能大于Y的元素仅有1种
B.该化合物中含有离子键、共价键和配位键
C.六种元素中,X的最高价含氧酸的酸性最强
D.M与X、Y形成的化合物中,前者的沸点一定低于后者
8.对乙酰氨基酚(a)具有解热镇痛作用,由对乙酰氨基酚可合成更为长效的对乙酰氨基酚缓释片(b)。下列说法错误的是( )
A.a的分子式为
B.a能与溴水发生取代反应
C.1ml b一定条件下与NaOH溶液反应,最多可消耗3ml NaOH
D.a苯环上的二溴代物有4种
9.实验室从废定影液[含和等]中回收Ag和的主要步骤如下。下列说法正确的是( )
A.为加快过滤速度,可以用玻璃棒轻轻搅拌漏斗中的液体
B.分液时先从下口放出有机相,再从上口倒出水相
C.从有机相提取的操作中需要的玻璃仪器有酒精灯、蒸馏烧瓶、球形冷凝管等
D.由制备金属银时,需将置于坩埚中隔绝空气高温焙烧
10.微生物脱盐电池既可以处理废水中的和,又可以实现海水淡化,原理如图所示。下列说法错误的是( )
A.离子交换膜a为阴离子交换膜
B.出口R处为淡水
C.生物电极M的电极反应式为
D.每生成2.24L(标准状况),电路中转移0.6ml电子
11.科研工作者合成了低温超导化合物M,再利用低温去插层法,获得了一个新化合物N。二者的晶体结构如图所示,下列说法正确的是( )
A.去插层过程中Cs元素均转化为Cs单质B.N的化学式为
C.M中与Cs原子最邻近的Se原子有2个D.N中V原子填充了Se原子构成的正八面体空隙
12.利用下列实验药品,能达到相应实验目的的是( )
A.AB.BC.CD.D
13.大豆素结构简式如图所示,大豆素中的大豆异黄酮及其衍生物具有优良的生理活性而备受关注。下列关于大豆素的说法,错误的是( )
A.该分子中所有碳原子一定共平面
B.苯环上的氢发生氯代时,一氯代物有5种
C.该物质能使酸性高锰酸钾溶液褪色
D.NaOH溶液和溶液均可与该物质发生反应
14.一种利用水催化促进和转化的化学新机理如图所示。电子传递可以促进中O―H键的解离,进而形成中间体,或通过“水分子桥”将电子快速转移给周围的气相分子。下列叙述错误的是( )
A.观察图可知,“水分子桥”与氢键形成有关
B.转化过程中存在O―H键的解离和硫氧键的生成
C.在整个转化过程中,水仅作催化剂,为中间产物
D.与间发生的总反应的离子方程式为
15.25℃时,向的溶液()中通入HCl或加入NaOH调节pH,不考虑溶液体积变化且过程中无气体逸出。含碳(或氮)微粒的分布分数[如:]与pH关系如图。下列说法错误的是( )
A.溶液在时存在:
B.曲线M表示的分布分数随pH变化
C.的
D.该体系在时,溶液中
二、非选择题:本题共4小题,共55分。
16.(14分)硫酸镍广泛应用于电镀、电池等工业。现以红土镍矿(主要成分为NiO,含MgO、、、FeOOH、、CuO、ZnO、等杂质)为原料制备硫酸镍,工艺流程如下:
已知:①相关金属离子形成氢氧化物沉淀的pH范围如下:
②当离子完全沉淀时,。
③硫酸镍晶体可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
④硫酸镍在水中溶解度随温度变化的曲线如图所示。回答下列问题:
(1)为加快“酸溶”速率,可采取的措施有______(任写一条)。“滤渣2”的主要成分有S和______(填化学式)。
(2)写出“氧化除杂”过程中加入涉及反应的离子方程式______。
(3)“氧化除杂”中加入的作用是______,溶液的pH应调节为______~6之间。
(4)萃取后的所得的水相“系列操作”包括______、______、过滤、洗涤得到硫酸镍晶体。
(5)洗涤过程中最好选择______进行洗涤。
A.蒸馏水B.无水乙醇C.乙醚D.稀盐酸
(6)滤渣4的成分为和。若滤液1中,当滤液4中时,除钙率为______%(保留小数点后一位,忽略沉淀前后溶液体积变化)。(已知:、)
17.(14分)氙的氟化物被广泛用作刻蚀剂、氧化剂和氟化剂,稀有气体Xe和混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)关于上述反应,下列有关说法正确的是______(填标号)。
A.当体系总压不再改变时,反应达到平衡
B.当Xe与的投料比为1∶1时,的平衡转化率大于Xe
C.达到平衡后将从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
(2)升高温度,平衡______(填“正向移动”“逆向移动”或“不移动”),理由是______(根据数据计算说明)。
(3)已知:选择性是指生成所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n ml的Xe和4ml的,初始压强为,测得在相同时间内,上述反应Xe的转化率和的选择性与温度的关系如图1所示,则制取的最适宜温度为______;当超过1000℃,选择性随着温度升高而降低的可能原因是______。
图1
(4)晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为,Xe和F的最短距离为b nm。
①Q点原子坐标参数为______。
②该晶体的密度为______。
18.(14分)亚硝酰硫酸(,)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
已知:ⅰ.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
ⅱ.实验室制备亚硝酰硫酸的原理为,。
(1)仪器Ⅰ的名称为______,按照气流从左到右的顺序,上述仪器的连接顺序为______(填仪器接口的字母,字母之间用“→”连接,部分仪器可以重复使用)。
(2)为了控制通入B中的的通入速率,可以采取的措施是______。
(3)装置B中三颈烧瓶需置于冷水浴中并维持反应体系温度不得高于20℃,若装置B中温度过高将导致产品产率降低,可能的原因是______(任写一个原因即可得分)。
(4)装置C的作用为防止亚硝酰硫酸遇水反应,请写出亚硝酰硫酸与水反应化学方程式______。
(5)测定亚硝酰硫酸的纯度:
步骤①:准确称取25.4g产品,在特定条件下配制成250mL溶液。
步骤②:取25.00mL溶液于锥形瓶中,加入60.00mL未知浓度溶液(过量)和10.00mL25%的溶液,摇匀,发生反应
步骤③:向该溶液中滴加标准溶液进行滴定,消耗溶液的体积为20.00mL。
步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗溶液的体积为60.00mL。滴定终点时的现象为______,亚硝酰硫酸的纯度为______(精确到0.1%)。
19.(13分)化合物H是一种医药中间体,H的一种合成路线如下。
已知:①RCHORCH=CHCOOH
②
回答下列问题:
(1)A→B的化学方程式为______,检验C中是否含有D的试剂为______。
(2)E的结构简式为______。
(3)H中含氧官能团的名称为______。
(4)B的同分异构体中含有苯环且可以发生水解反应的有______种,其中核磁共振氢谱的峰面积之比为3∶2∶2∶1的结构简式为______(任写一种)。
(5)综合上述信息,写出以和为原料(无机试剂任选)制备聚-2-丁烯酸()的合成路线:______。
沈阳市第二中学2023-2024学年高三下学期4月份阶段测试化学试题
1D 2A 3B 4B 5A 6C 7B 8C 9D 10C 11B 12A 13A 14C 15D
16.(14分)
(1)适当升高温度或适当增大硫酸浓度或将红土镍矿粉碎(1分) CuS(1分)
(2)
(3)调节溶液的pH,使、完全沉淀 4.7
(4)加热浓缩(1分) 冷却结晶(1分) (5)B (6)99.7
17.(14分)(1)AB
(2)逆向移动 该反应的平衡常数,250℃时,,400℃时,,升高温度平衡常数减小,平衡逆向移动
(3)1000℃ 平衡向左移动或催化剂活性降低
(4)① ②
18(14分)(1)①蒸馏烧瓶 ②a→d→e→c→b→d→e→f
(2)控制A中滴加浓硫酸的速率
(3)温度过高,浓硝酸会分解或挥发或溶解度减小逸出,合理即得分
(4)
(5)①溶液由浅紫色变为无色,且半分钟内颜色不再恢复 ②50.0%
19(13分)(1)① ②溶液(1分)
(2)① (3)羟基、醚键、酯基
(4)①6 ②或或
(5)
实验目的
实验药品
与铜离子结合能力:
溶液,NaOH溶液,氨水
蔗糖是否发生水解
蔗糖,稀硫酸,新制的悬浊液
检验溴乙烷消去的产物
溴乙烷,NaOH,乙醇,高锰酸钾溶液
用标准浓度的盐酸测定未知浓度的溶液
盐酸,酚酞
金属离子
开始沉淀的pH
6.3
1.8
3.4
8.9
6.2
6.9
沉淀完全的pH
8.3
3.2
4.7
10.9
8.2
8.9
温度/℃
250
400
辽宁省沈阳市第二十中学2023-2024学年高二下学期4月阶段测试化学试题(PDF版含答案): 这是一份辽宁省沈阳市第二十中学2023-2024学年高二下学期4月阶段测试化学试题(PDF版含答案),共14页。
辽宁省沈阳市第二中学2023-2024学年高三下学期4月份阶段测试化学试卷: 这是一份辽宁省沈阳市第二中学2023-2024学年高三下学期4月份阶段测试化学试卷,文件包含辽宁省沈阳市第二中学2023-2024学年高三下学期4月份阶段测试化学试卷pdf、沈阳二中24届高三4月份阶段测试化学试题答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
辽宁省沈阳市第二中学2023-2024学年高三下学期寒假阶段测试(开学考)化学试卷(含答案): 这是一份辽宁省沈阳市第二中学2023-2024学年高三下学期寒假阶段测试(开学考)化学试卷(含答案),文件包含沈阳市第二中学2023-2024学年高三下学期寒假阶段测试化学试卷docx、沈阳二中24届高三寒假阶段测试答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。












