
2024届江西省南昌市高三下学期二模考试化学试题(含答案)
展开可能用到的相对原子质量:H:1Li:7C:12O:16S:32Cu:64Zn:65Se:79Pb:207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.消防安全事关人民群众生命财产安全,社会的和谐稳定。下列说法错误的是
A.家用电器着火,可用二氧化碳灭火器灭火B.野营结束后,可用湿沙土将火源盖灭
C.实验室酒精灯着火,可用湿抹布盖灭D.家中油锅着火,可迅速用水扑灭
2.下列化学用语表示正确的是
A.中子数为10的氧原子:816OB.H2O的VSEPR模型是V形
C.基态Si原子电子排布式为:1s22s22p63s23p2D.异戊二烯的键线式为:
3.关于下列实验仪器的使用,说法正确的是
A.容量瓶可代替圆底烧瓶用于组装反应装置B.量筒、锥形瓶都是不能加热的玻璃仪器
C.滴定管在使用前需要检漏、洗涤并烘干D.可用洗净的无锈铁丝代替铂丝进行焰色试验
4.已知NA为阿伏加德罗常数的值,下列说法正确的是
A.1mlN2和3mlH2反应形成的σ键数目为6NA
B.1mlNaCN固体溶于HCN酸所得溶液显中性,CN−的数目为NA
C.1ml[CuNH34]SO4固体中含有氨气分子数目为4NA
D.1mlCl2与H2O充分反应,转移的电子数目为NA
5.下列离子方程式书写正确的是
A.Cl2通入冷的石灰乳中:Cl2+CaOH2=Ca2++Cl−+ClO−+H2O
B.利用覆铜板制作印刷电路板:Fe+Cu2+=Fe2++Cu
C.用惰性电极电解CuCl2溶液:Cu2++2Cl−+2H2O=CuOH2↓+H2↑+Cl2↑
D.向H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH−+18O2↑
6.谷氨酸的结构简式如图所示,下列说法正确的是
A.谷氨酸难溶于水
B.谷氨酸能发生氧化反应和缩聚反应
C.谷氨酸分子中C、N原子的杂化方式都为sp3
D.谷氨酸可发生分子内脱水形成具有四元环状结构的焦谷氨酸
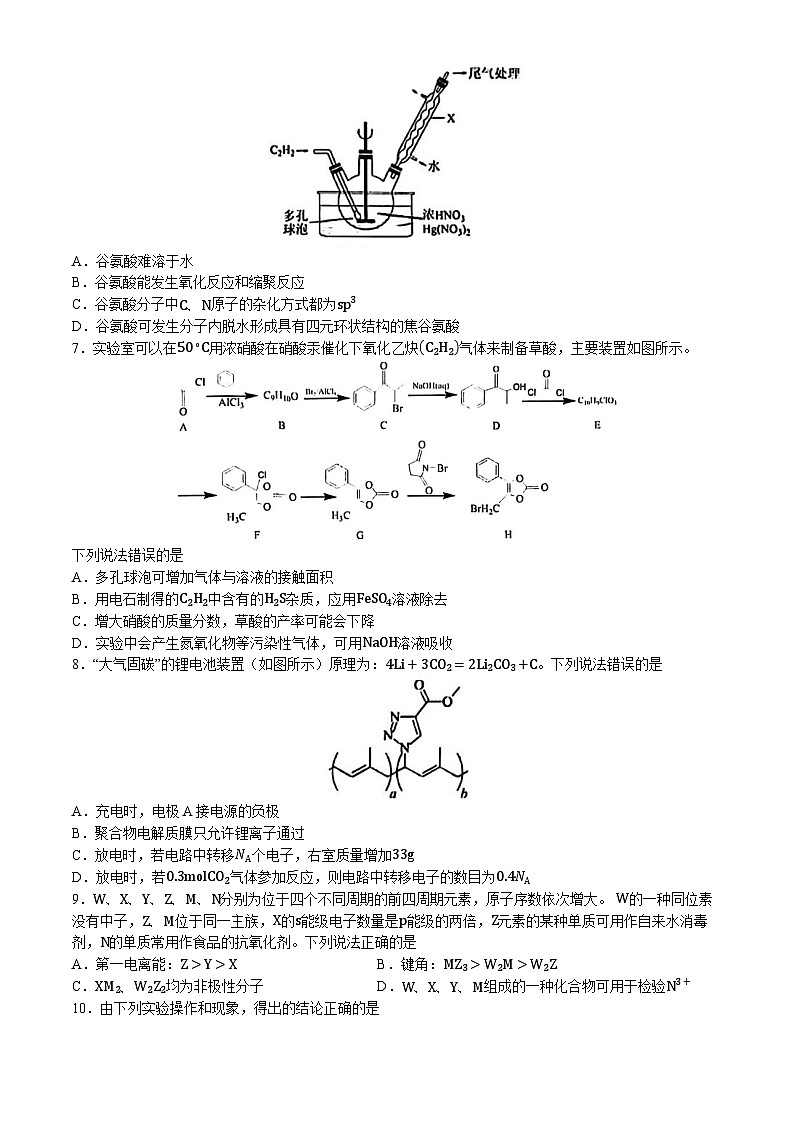
7.实验室可以在50∘C用浓硝酸在硝酸汞催化下氧化乙炔C2H2气体来制备草酸,主要装置如图所示。
下列说法错误的是
A.多孔球泡可增加气体与溶液的接触面积
B.用电石制得的C2H2中含有的H2S杂质,应用FeSO4溶液除去
C.增大硝酸的质量分数,草酸的产率可能会下降
D.实验中会产生氮氧化物等污染性气体,可用NaOH溶液吸收
8.“大气固碳”的锂电池装置(如图所示)原理为:4Li+3CO2=2Li2CO3+C。下列说法错误的是
A.充电时,电极A接电源的负极
B.聚合物电解质膜只允许锂离子通过
C.放电时,若电路中转移NA个电子,右室质量增加33g
D.放电时,若0.3mlCO2气体参加反应,则电路中转移电子的数目为0.4NA
9.W、X、Y、Z、M、N分别为位于四个不同周期的前四周期元素,原子序数依次增大。 W的一种同位素没有中子,Z、M位于同一主族,X的s能级电子数量是p能级的两倍,Z元素的某种单质可用作自来水消毒剂,N的单质常用作食品的抗氧化剂。下列说法正确的是
A.第一电离能:Z>Y>XB.键角:MZ3>W2M>W2Z
C.XM2、W2Z2均为非极性分子D.W、X、Y、M组成的一种化合物可用于检验N3+
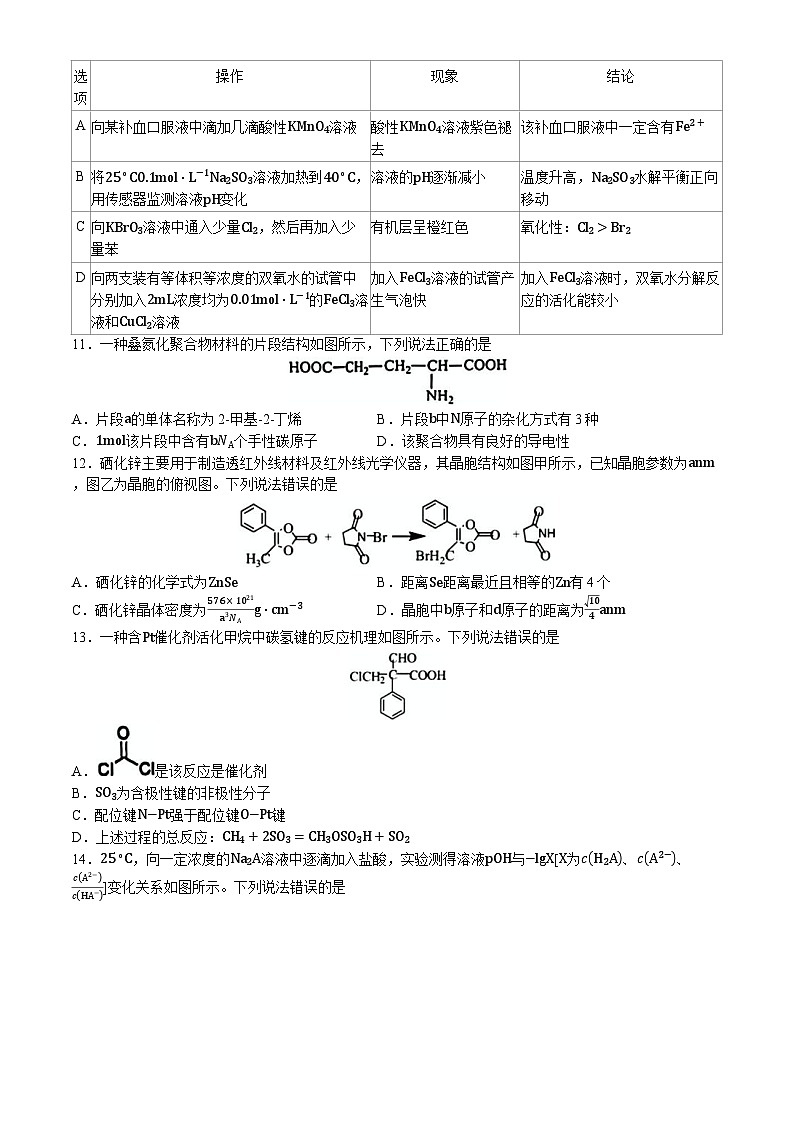
10.由下列实验操作和现象,得出的结论正确的是
11.一种叠氮化聚合物材料的片段结构如图所示,下列说法正确的是
A.片段a的单体名称为2-甲基-2-丁烯B.片段b中N原子的杂化方式有3种
C.1ml该片段中含有bNA个手性碳原子D.该聚合物具有良好的导电性
12.硒化锌主要用于制造透红外线材料及红外线光学仪器,其晶胞结构如图甲所示,已知晶胞参数为anm,图乙为晶胞的俯视图。下列说法错误的是
A.硒化锌的化学式为ZnSeB.距离Se距离最近且相等的Zn有4个
C.硒化锌晶体密度为576×1021a3NAg⋅cm−3D.晶胞中b原子和d原子的距离为104anm
13.一种含Pt催化剂活化甲烷中碳氢键的反应机理如图所示。下列说法错误的是
A.是该反应是催化剂
B.SO3为含极性键的非极性分子
C.配位键N−Pt强于配位键O−Pt键
D.上述过程的总反应:CH4+2SO3=CH3OSO3H+SO2
14.25∘C,向一定浓度的Na2A溶液中逐滴加入盐酸,实验测得溶液pOH与−lgX[X为cH2A、cA2−、cA2−cHA−]变化关系如图所示。下列说法错误的是
A.曲线a表示pOH与−lgcH2A的变化关系
B.当2.8
C.常温下,反应A2−+H2A⇌2HA−的平衡常数为103
D.N点溶液中,cA2−+2cH2A
15.(14分)
一种从火法炼铜烟道灰(主要成分是Pb、Zn、Bi、Cu的硫酸盐,还有少量Pb和As的氧化物)中回收铅,并制取三盐基硫酸铅(3PbO⋅PbSO4⋅H2O,M为990g/ml)的工艺如图:
已知:PbCl2微溶于水
(1)写出铅原子的核外电子排布式:[Xe] ,它位于元素周期表的 区。
(2)转化过程温度选择30∘C,原因是 。
(3)Cu、As元素均进入转化液中,相关的离子分别为 、 (填离子符号)。
(4)转化渣主要成分为碳酸铅和碳酸氧铋[BiO2CO3⋅H2O],写出PbSO4转化为PbCO3的离子反应方程式: 。
(5)加入适量的X酸,X酸宜为 (填序号)。
A.盐酸 B.硫酸 C.硝酸 D.氢硫酸
(6)转化渣除铋的离子方程式为 。
(7)若使用100t烟道灰,最终制得纯度为99.0%的三盐基硫酸铅30t,已知该工艺铅的回收率约为90.0%,则烟道灰中含铅的质量分数为 。
16.(15分)
硫酸肼N2H4⋅H2SO4水溶液呈酸性,不溶于乙醇。其制备过程分为以下二部分。
Ⅰ.水合肼(N2H4⋅H2O,沸点约118∘C)的制备。由尿素[CONH22]水溶液、NaOH和次氯酸钠溶液混合,在20∘C以下反应一段时间;再将剩余的NaOH溶液与催化剂加入其中,迅速升温至100∘C继续反应,生成水合肼。
Ⅱ.合成硫酸肼,其装置以及具体步骤如下:
①将一定量的水合肼80%于仪器A中稀释,在低温浴槽内冷却降温。
②将仪器C内的98%浓硫酸,缓慢滴加至仪器A中,搅拌并保持温度在0∼10∘C左右,当pH值为5~7时停止滴加。
③将溶液缓慢降温,2h后沉降出白色固体。过滤、洗涤、室温风干即可得硫酸肼固休。
回答下列问题:
(1)N2H4分子中N原子的杂化方式为 ,N2H4的结构式为 。
(2)反应物次氯酸钠不能过量,否则产率过低,主要原因是 、 。
(3)合成N2H4⋅H2O时,还生成2种钠盐。写出合成N2H4⋅H2O的总反应方程式 。
(4)装置中仪器B、C的名称分别为 、 。
(5)步骤①中水合肼稀释时放出热量,主要原因是 。
(6)步骤②中,如果pH为4时停止滴加硫酸,产率 (填“增大”“减小”或“不变”),原因是 。
(7)步骤③中固体最好用 洗涤2~3次。
17.(14分)
硅是信息产业、太阳能电池光电转化的基础材料。
(1)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
硅与碳同族,但硅烷在种类和数量上都远不如烷烃多,原因是 。
(2)锌还原四氯化硅是一种有着良好应用前景的制备硅的方法。Zn还原SiCl4的反应如下:
反应1:400∘C∼756∘C,SiCl4g+2Znl⇌Sis+2ZnCl2lΔH1<0
反应2:756∘C∼907∘C,SiCl4g+2Znl⇌Sis+2ZnCl2gΔH2<0
反应3:907∘C∼1410∘C,SiCl4g+2Zng⇌Sis+2ZnCl2gΔH3<0
①对于上述三个反应,下列说法合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.ΔH1<ΔH2<ΔH3 d.Na、Mg可以代替Zn还原SiCl4
②实际制备过程选择“反应3”,选择的理由是 。
(3)工业上也可用SiHCl3制备高纯硅。25∘C时,SiHCl3相关反应的热化学方程式和平衡常数如表:
①则该温度下,ΔH3= kJ⋅ml−1;K3= (用K1和K2表示)。
②对于反应4SiHCl3g⇌SiH4g+3SiCl4g,采用大孔弱碱性阴离子交换树脂催化剂,在T1和T2时SiHCl3的转化率随时间变化的结果如图所示。则T1 T2(填“大于”“小于”或“等于”),T1时平衡常数K= (保留2位小数)。
③在T2下,要提高SiHCl3转化率,可采取的措施是 。
18.(15分)
有机物H(分子式C10H7BrO3)主要用于生产盐酸仑氨西林的中间体,其合成过程如图:
回答下列问题:
(1)有机物中,存在 中心 电子的大π键。
(2)B的结构简式为 。
(3)D中官能团的名称为 。
(4)由F生成G的反应类型为 。
(5)由G生成H为取代反应,其化学方程式为 。
(6)J是E的同分异构体,其苯环上只有1个取代基,且含有手性碳原子,若与银氨溶液反应后,手性碳原子则会消失。满足条件的有机物有 种(不考虑立体异构),请写出其中一种的结构简式 。
(7)
参照上述反应路线,写出以和
为原料制备的合成路线流图(无机试剂和有机溶剂任用) 。
【参考答案】
2024届江西省南昌市高三下学期二模考试
化学
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.D 2.C 3.D 4.B 5.A 6.B 7.B 8.C 9.D 10.D 11.C 12.D 13.D 14.B
二、非选择题:本题共4小题,共58分。
15.(1) 5d106s26p2(1分); p(1分)
(2) 低于30∘C,转化速率慢;高于30∘C,氨水易分解,生成氨气挥发(2分)
(3) [CuNH34]2+; AsO33−或AsO43−(共2分)
(4) PbSO4+HCO3−+NH3⋅H2O=PbCO3+SO42−+NH4++H2O(2分)
(5) C(2分)
(6) 3PbCO3+2Bi3++H2O=BiO2CO3⋅H2O↓+3Pb2++2CO2↑(2分)
(7) 27.6%(2分)
16.(1) sp3(1分); H−NH|−NH|−H(1分)
(2) 有副反应生成(1分); 会氧化生成的N2H4⋅H2O(2分)
(3) CONH22+NaClO+2NaOH=N2H4⋅H2O+NaCl+Na2CO3(2分)
(4) 球形冷凝管(1分); 恒压滴液漏斗(1分)
(5) 肼与水形成氢键而放热(2分)
(6) 减小(1分); 生成了N2H6HSO42产物(1分)
(7) 无水乙醇(2分)
17.(1) Si−Si键的键能比C−C键的键能低,难以形成较长的硅链;Si−H键的键能比C−H键的键能低,使得短链硅烷也不稳定。(2分)
(2) ① bd(2分)
② 温度高,反应速率快;更易于硅的分离。(2分)
(3) ① +114; K13⋅K2(2分)
② 大于(2分); 0.11(2分)
③ 及时分离出产物(2分)
18.(1) 4(1分); 6(1分)
(2) (2分)
(3) 羟基、羰基(2分)
(4) 消去反应(1分)
(5) (2分)
(6) 2(2分); 或(1分)
(7) (3分)选项
操作
现象
结论
A
向某补血口服液中滴加几滴酸性KMnO4溶液
酸性KMnO4溶液紫色褪去
该补血口服液中一定含有Fe2+
B
将25∘C0.1ml⋅L−1Na2SO3溶液加热到40∘C,用传感器监测溶液pH变化
溶液的pH逐渐减小
温度升高,Na2SO3水解平衡正向移动
C
向KBrO3溶液中通入少量Cl2,然后再加入少量苯
有机层呈橙红色
氧化性:Cl2>Br2
D
向两支装有等体积等浓度的双氧水的试管中分别加入2mL浓度均为0.01ml⋅L−1的FeCl3溶液和CuCl2溶液
加入FeCl3溶液的试管产生气泡快
加入FeCl3溶液时,双氧水分解反应的活化能较小
化学键
C−C
C−H
Si−Si
Si−H
键能/kJ⋅ml−1
356
413
226
318
热化学方程式
平衡常数
2SiHCl3g⇌SiH2Cl2g+SiCl4gΔH1=+48kJ⋅ml−1
K1
3SiH2Cl2g⇌SiH4g+2SiHCl3gΔH2=−30kJ⋅ml−1
K2
4SiHCl3g⇌SiH4g+3SiCl4gΔH3
K3
江西省2024届南昌市高三下学期二模考试化学试题: 这是一份江西省2024届南昌市高三下学期二模考试化学试题,共8页。
2024届江西省南昌市高三下学期二模考试化学试题+答案: 这是一份2024届江西省南昌市高三下学期二模考试化学试题+答案,共8页。
2024届江西省南昌市高三下学期二模考试化学试题+答案: 这是一份2024届江西省南昌市高三下学期二模考试化学试题+答案,共8页。












