

2024年北京市海淀区中考化学一模试卷
展开
这是一份2024年北京市海淀区中考化学一模试卷,共32页。试卷主要包含了【生活现象解释】,【科普阅读理解】,【生产实际分析】,【基本实验及其原理分析】,【科学探究】,【实际应用定量计算】等内容,欢迎下载使用。
1.(1分)空气成分中,体积分数约占78%的是( )
A.氧气B.氮气C.二氧化碳D.稀有气体
2.(1分)各种元素在人体中的含量(质量分数)如图,其中含量最多的金属元素是( )
A.氧B.氢C.钙D.镁
3.(1分)做好垃圾分类,有利于保护环境。西瓜皮属于( )
A.厨余垃圾B.其他垃圾C.可回收物D.有害垃圾
4.(1分)下列物质的性质属于化学性质的是( )
A.金呈黄色B.银易导电
C.蔗糖易熔化D.碳酸易分解
5.(1分)下列金属中,活动性最强的是( )
A.CuB.AgC.FeD.Al
6.(1分)2023年10月16日是第43个世界粮食日。下列做法不合理的是( )
A.合理使用化肥,提高粮食产量
B.随意大量施用农药,杀灭病虫害
C.提倡“光盘”行动,减少浪费
D.调节土壤酸碱度以适合农作物的生长
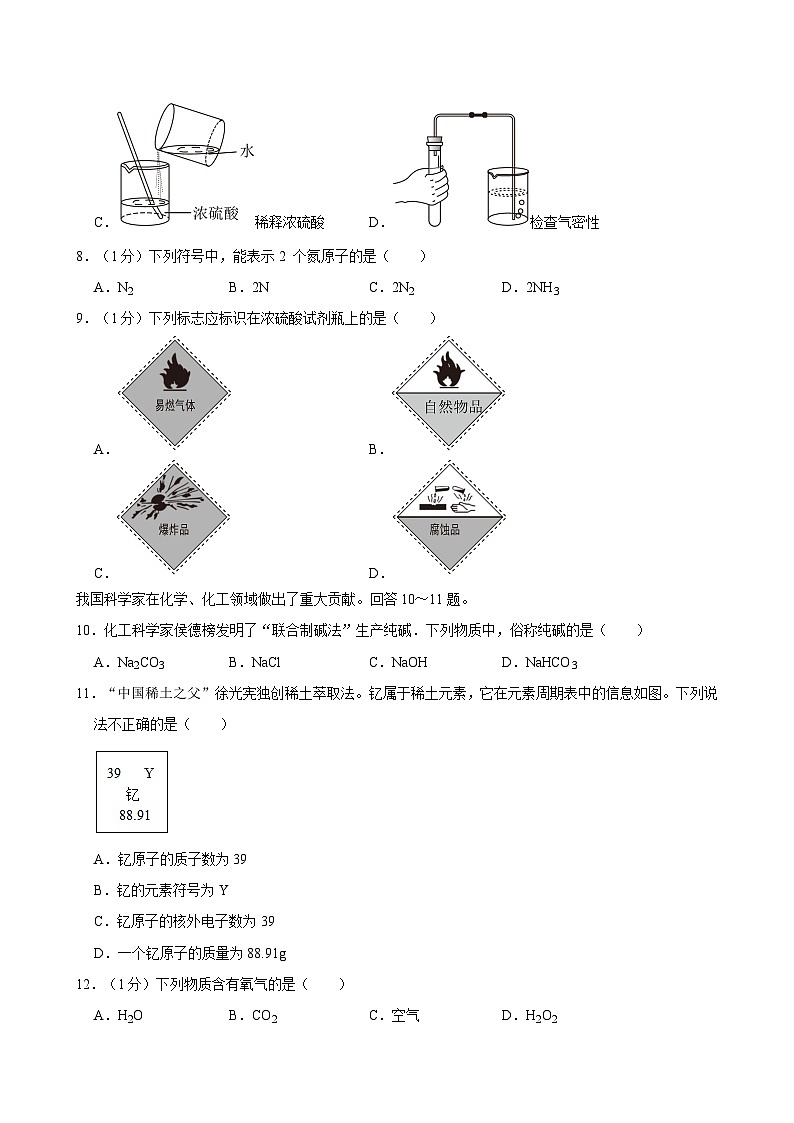
7.(1分)下列实验操作不正确的是( )
A.加热液体B.倾倒液体
C.稀释浓硫酸D.检查气密性
8.(1分)下列符号中,能表示2 个氮原子的是( )
A.N2B.2NC.2N2D.2NH3
9.(1分)下列标志应标识在浓硫酸试剂瓶上的是( )
A.B.
C.D.
我国科学家在化学、化工领域做出了重大贡献。回答10~11题。
10.化工科学家侯德榜发明了“联合制碱法”生产纯碱.下列物质中,俗称纯碱的是( )
A.Na2CO3B.NaClC.NaOHD.NaHCO3
11.“中国稀土之父”徐光宪独创稀土萃取法。钇属于稀土元素,它在元素周期表中的信息如图。下列说法不正确的是( )
A.钇原子的质子数为39
B.钇的元素符号为Y
C.钇原子的核外电子数为39
D.一个钇原子的质量为88.91g
12.(1分)下列物质含有氧气的是( )
A.H2OB.CO2C.空气D.H2O2
13.(1分)下列金属矿石可用来冶炼铜的是( )
A.赤铁矿(主要成分为Fe2O3)
B.辉铜矿(主要成分为Cu2S)
C.铝土矿(主要成分为Al2O3)
D.磁铁矿(主要成分为Fe3O4)
14.(1分)下列关于物质用途的说法不正确的是( )
A.二氧化碳用于灭火
B.氧气用于医疗急救
C.氯化钠用于治疗胃酸过多
D.盐酸用于金属表面除锈
中医药文化博大精深,化学能助力现代中医药的发展,回答15~16题。
15.板蓝根含生物碱、糖类、酚类等多种物质,有清热解毒、凉血利咽的功效。板蓝根属于( )
A.混合物B.纯净物C.化合物D.单质
16.板蓝根中某有效成分的化学式为C9H7NO2。下列关于该成分的说法不正确的是( )
A.由碳、氢、氮、氧四种元素组成
B.氮、氧元素的质量比为1:2
C.1个分子中有19个原子
D.碳元素的质量分数最大
17.(1分)配制100g15%的NaCl溶液的过程如图。下列说法不正确的是( )
A.称量时,需称量15gNaCl固体
B.量取时,需量取100mL蒸馏水
C.溶解时,用玻璃棒搅拌以加快NaCl的溶解
D.从配好的溶液中取出10g,其溶质的质量分数为15%
18.(1分)下列化学方程式书写正确的是( )
A.H2O2H2↑+O2↑
B.CH4+2O2═2H2O+CO2
C.Cu+AgNO3═Cu(NO3)2+Ag
D.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
化学为我国载人深潜事业的发展提供了强有力的支撑。回答19~20题。
19.为使深海载人潜水器不过重,又能克服深海的巨大压力,以及耐深海海水的腐蚀,科学家选用钛合金制作潜水器的外壳。据此分析钛合金的性能不包括( )
A.密度小B.抗压能力强
C.导电导热性好D.抗腐蚀性好
20.潜水器常用过氧化钠(Na2O2)作供氧剂,其反应为2Na2O2+2CO2═O2+2X。下列说法正确的是( )
A.CO2中碳元素的化合价为+2价
B.该反应为复分解反应
C.X由钠元素和碳元素组成
D.该反应能消耗潜水器中的CO2
KCl溶液是临床常用的电解质平衡调节药。依据实验和溶解度曲线,回答21~22题。
21.②中溶质的质量为( )
A.30gB.70gC.100gD.130g
22.下列说法正确的是( )
A.②中溶质的质量分数为30%
B.③中溶质与溶剂的质量比为40:100
C.④是不饱和溶液
D.KCl饱和溶液升温可变为不饱和溶液
23.(1分)利用如图实验验证分子在不断运动,观察到b中溶液变红。下列说法不正确的是( )
A.HCl分子运动到了b中
B.利用了盐酸的酸性
C.利用了浓盐酸的挥发性
D.可用浓硫酸代替浓盐酸
24.(1分)乙炔(C2H2)燃烧时火焰温度可超过3000℃,燃烧反应前后分子种类变化的微观示意图如图:
下列说法不正确的是( )
A.26g甲中氢元素的质量为2g
B.乙的相对分子质量为32
C.生成的丙、丁均为氧化物
D.生成的丙与丁的分子个数比为1:1
25.(1分)用如图实验研究碱的性质。用注射器分别推入等体积的溶液,观察到实验①中气球明显变鼓,实验②中气球略微变鼓。下列说法不正确的是( )
A.实验前需检查两个装置的气密性
B.实验中气球变鼓是因为集气瓶内气压小于外界大气压
C.实验①②的现象除气球变鼓程度不同,无其他明显差异
D.从吸收CO2的效果来看,浓NaOH溶液优于澄清石灰水
二、【生活现象解释】
26.(4分)从稻种到美食,凝结着劳动者的智慧。
(1)选种:可用密度为1.16g•mL﹣1的NaCl溶液选种。NaCl溶液的溶质为 。
(2)种植:水稻最适宜在中性土壤中生长。若要改良酸性土壤以适宜水稻生长,可以选择的物质为 (填序号)。
a.NaCl
b.Ca(OH)2
c.H2SO4
(3)施肥:水稻在生长早期需施加大量氮肥。常见的化肥K2SO4、CO(NH2)2、Ca3(PO4)2中,属于氮肥的是 。
(4)制作美食:粽子是我国端午节的传统美食,某粽子中含有糯米、蛋黄、肉等食材,其中富含糖类的是 。
27.(3分)我国要在2060年前实现碳中和,需要多方共同努力。
(1)下列做法符合“低碳”理念的有 (填序号)。
a.骑自行车出行
b.纸张双面打印
c.使用一次性餐具
(2)我国已能将CO2捕集后通过输送管道注入海底,实现碳封存。
①捕集后CO2被压缩,其分子间隔 (填“变大”或“变小”)。
②输送管道易被酸腐蚀,解释CO2进入输送管道前需干燥的原因: 。
三、【科普阅读理解】
28.(6分)阅读下面科普短文。
微塑料是指直径小于5mm的塑料颗粒。微塑料难以降解,污水处理厂也不能将其彻底去除,会对生态环境造成危害。为此,研究人员开展了絮凝法去除废水中微塑料的研究。磨砂洗面奶中含有微塑料。为研究絮凝剂种类、絮凝温度和沉降时间对微塑料絮凝效果的影响,研究人员配制了1.0g•L﹣1磨砂洗面奶废水进行模拟实验,并测得该废水的浊度为450NTU(浊度越小,絮凝效果越好)。研究人员研究不同絮凝剂对微塑料絮凝效果的影响,结果见表1。表1用不同絮凝剂处理后的水样浊度。
为研究絮凝温度对絮凝效果的影响,研究人员向1L废水中加入10mg硫酸铝,分别在不同温度下沉降40min后测定浊度,结果如图1所示。为研究沉降时间对絮凝效果的影响,研究人员向1L废水中加入10mg硫酸铝,保持絮凝温度相同,沉降不同时间后测定浊度,结果如图2所示。
未来,政府、企业、科研机构和公众将共同努力,推动微塑料污染的防治工作。
依据文章回答下列问题。
(1)塑料属于 (填“金属材料”或“有机合成材料”)。
(2)聚合硫酸铁不能作为磨砂洗面奶废水的絮凝剂,结合表1分析其证据是 。
(3)由图1可知,该实验条件下硫酸铝的最佳絮凝温度为 ℃。
(4)由图2可得结论:使用硫酸铝作为絮凝剂,保持絮凝温度相同,在实验研究的沉降时间范围内, 。
(5)判断下列说法是否正确(填“对”或“错”)。
①微塑料不难降解,污水处理厂就能将其彻底去除。
②絮凝剂种类、絮凝温度、沉降时间都对絮凝效果有影响。
四、【生产实际分析】
29.(3分)镍(Ni)可用于制造不锈钢等。以粗氧化镍(主要成分为NiO,含有少量Fe2O3)制备高纯镍的主要流程如图:
(1)①中NiO发生置换反应生成了水,该反应的化学方程式为 。
(2)步骤③的目的是 。
(3)④中发生反应的基本反应类型是 。
30.(3分)纳米级Mg(OH)2有独特的阻燃性能,应用广泛。以MgO制备纳米级Mg(OH)2的主要流程如图:
(1)稀释塔内壁不能使用铁质材料,用化学方程式解释其原因: 。
(2)反应池中加入的碱为 。
(3)上述流程中,镁元素的化合价 (填“改变”或“不变”)。
五、【基本实验及其原理分析】
31.(2分)从A或B中任选一个作答,若均作答,按A计分。
(1)①中反应的化学方程式为 。
(2)②中观察到的现象是 。
32.(3分)实验小组进行实验,去除粗盐中的难溶性杂质。
(1)将粗盐溶解后,能将其中的难溶性杂质去除的实验操作是 (填操作名称)。
(2)蒸发需要用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、 (填序号)。
①试管
②蒸发皿
③烧杯
④玻璃棒
(3)开始加热至出现晶体前,溶液中氯化钠的质量分数逐渐 (填“增大”或“减小”)。
33.(3分)如图所示,向井穴板的孔穴1~4中滴加稀盐酸。
(1)孔穴1中溶液变黄,因为生成了 (填化学式)。
(2)产生气泡的孔穴有 (填序号),其中发生反应的化学方程式为 (写出一个即可)。
34.(3分)用如图实验验证可燃物的燃烧条件。
已知:白磷的着火点为40℃,红磷的着火点为240℃。
(1)将电炉调到100℃,能证明可燃物燃烧需要温度达到着火点的现象是 。
(2)为验证可燃物燃烧需要与氧气接触,可将电炉调至 (填序号)。
a.20℃
b.120℃
c.300℃
(3)实验中用到了铜板,利用了铜 的性质。
35.(2分)为验证铁、铜、银的金属活动性顺序,设计如下实验。
(1)实验1中,能说明铁的金属活动性比铜强的现象是 。
(2)为达成实验目的,X可以为 (填序号)。
a.CuSO4
b.AgNO3
c.H2SO4
36.(3分)用如图实验探究NaOH与H2SO4的反应。
(1)步骤1中能观察到的实验现象是 。
(2)步骤2中发生反应的化学方程式为 。
(3)该实验能证明NaOH与H2SO4发生反应,结合实验现象说明理由: 。
六、【科学探究】
37.(6分)铜箔应用广泛,工业上可用电解法制备。常用的电解液为CuSO4溶液,并用稀H2SO4调电解液初始pH。兴趣小组研究电流密度、电解液初始pH、电极板间距对Cu的电沉积速率和铜箔的拉伸强度的影响。
【查阅资料】
ⅰ.一般情况下,酸的浓度越大,pH越小。
ⅱ.其他条件不变时,CuSO4浓度越小,电沉积速率越小。
【进行实验】兴趣小组在如图所示装置中按下表进行实验,记录0~45min内平均电沉积速率及拉伸强度的数据。
【解释与结论】
(1)电解CuSO4溶液的反应如下,配平化学方程式:2CuSO4+2H2O□Cu+□H2SO4+O2↑。
(2)①②③的目的是 。
(3)为探究电极板间距的影响,④中a为 。为使铜箔的拉伸强度最大,应选择的电极板间距为 mm。
(4)根据②⑥⑦,可得关于电沉积速率的结论是 。
【反思与评价】
(5)另一小组实时监控电解过程中的电沉积速率,发现电沉积速率有加快的现象。结合实验推测可能的原因是 。
七、【实际应用定量计算】
38.(4分)NaCl是生活中常见的调味品,也是重要的工业原料。工业上利用它制备Na、NaOH的反应如下:
①2NaCl2Na+Cl2↑
②2NaCl+2H2O2NaOH+H2↑+Cl2↑
(1)①中,若消耗117kgNaCl,计算生成的Na的质量(写出计算过程及结果)。
(2)分别利用①和②制备质量相等的Cl2,理论上需要的NaCl质量 (填“相等”或“不相等”)。
参考答案与试题解析
一、本部分共25题,每题1分,共25分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.(1分)空气成分中,体积分数约占78%的是( )
A.氧气B.氮气C.二氧化碳D.稀有气体
【解答】解:空气的成分及各成分的体积分数分别是:氮气占78%、氧气占21%、稀有气体占0.94%、二氧化碳占0.03%、其它气体和杂质占0.03%.由此可知B符合题意。
故选:B。
2.(1分)各种元素在人体中的含量(质量分数)如图,其中含量最多的金属元素是( )
A.氧B.氢C.钙D.镁
【解答】解:由图示信息可知,人体中的含量最多的金属元素是钙元素。
故选:C。
3.(1分)做好垃圾分类,有利于保护环境。西瓜皮属于( )
A.厨余垃圾B.其他垃圾C.可回收物D.有害垃圾
【解答】解:厨余垃圾是指居民日常生活及食品加工、饮食服务、单位供餐等活动中产生的垃圾,西瓜皮没有回收价值,属于厨余垃圾。
故选:A。
4.(1分)下列物质的性质属于化学性质的是( )
A.金呈黄色B.银易导电
C.蔗糖易熔化D.碳酸易分解
【解答】解:A、金呈黄色,属于物质的颜色,不需要发生化学变化就表现出来,属于物理性质,故A错;
B、银易导电,属于物质的导电性,不需要发生化学变化就表现出来,属于物理性质,故B错;
C、蔗糖易熔化,不需要发生化学变化就表现出来,属于物理性质,故C错;
D、碳酸分解生成水和二氧化碳,属于化学变化,所以碳酸易分解,属于化学性质,故D正确。
故选:D。
5.(1分)下列金属中,活动性最强的是( )
A.CuB.AgC.FeD.Al
【解答】解:根据常见金属的活动性顺序,可知Al>Fe>Cu>Ag,所以金属Al的活动性最强。
故选:D。
6.(1分)2023年10月16日是第43个世界粮食日。下列做法不合理的是( )
A.合理使用化肥,提高粮食产量
B.随意大量施用农药,杀灭病虫害
C.提倡“光盘”行动,减少浪费
D.调节土壤酸碱度以适合农作物的生长
【解答】解:A、农药化肥会污染土壤、水源等,合理使用化肥,能减少环境污染,故A不符合题意;
B、大量使用农药会污染土壤、水源等,故B符合题意;
C、提倡“光盘”行动,减少浪费,节约资源,故C不符合题意;
D、在土壤中加入酸性或碱性物质,调节土壤酸碱度,有利于农作物生长,故D不符合题意;
故选:B。
7.(1分)下列实验操作不正确的是( )
A.加热液体B.倾倒液体
C.稀释浓硫酸D.检查气密性
【解答】解:A、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的三分之一,图中所示操作正确。
B、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨试管口,图中所示操作正确。
C、稀释浓硫酸时,要把浓硫酸慢慢地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的散失;一定不能把水注入浓硫酸中,以防止酸液飞溅,图中所示操作错误。
D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴试管外壁,若导管口有气泡冒出,装置不漏气,图中所示操作正确。
故选:C。
8.(1分)下列符号中,能表示2 个氮原子的是( )
A.N2B.2NC.2N2D.2NH3
【解答】解:A、N2可表示1个氮分子,故选项错误。
B、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氮原子表示为:2N,故选项正确。
C、2N2可表示2个氮分子,故选项错误。
D、2NH3可表示2个氨分子,故选项错误。
故选:B。
9.(1分)下列标志应标识在浓硫酸试剂瓶上的是( )
A.B.
C.D.
【解答】解:A、图中所示标志是易燃气体标志,故错误;
B、图中所示标志是自燃物品标志,故错误;
C、图中所示标志是爆炸品标志,故错误;
D、图中所示标志是腐蚀品标志,故正确。
故选:D。
我国科学家在化学、化工领域做出了重大贡献。回答10~11题。
10.化工科学家侯德榜发明了“联合制碱法”生产纯碱.下列物质中,俗称纯碱的是( )
A.Na2CO3B.NaClC.NaOHD.NaHCO3
【解答】解:A、碳酸钠俗称纯碱、苏打,故A正确;
B、纯碱不是氯化钠的俗称,故B错误;
C、氢氧化钠俗称烧碱、火碱、苛性钠,故C错误;
D、碳酸氢钠俗称小苏打,故D错误。
故选:A。
11.“中国稀土之父”徐光宪独创稀土萃取法。钇属于稀土元素,它在元素周期表中的信息如图。下列说法不正确的是( )
A.钇原子的质子数为39
B.钇的元素符号为Y
C.钇原子的核外电子数为39
D.一个钇原子的质量为88.91g
【解答】解:A、根据元素周期表中的一格中获取的信息,该元素的原子序数为39;根据原子序数=核电荷数=质子数,则钇原子的质子数为39,故选项说法正确;
B、根据元素周期表中的一格可知,字母表示该元素的元素符号,元素符号为Y,故选项说法正确;
C、根据元素周期表中的一格中获取的信息,该元素的原子序数为39;根据原子序数=核电荷数=质子数=核外电子数,则钇原子的质子数为39,所以核外电子也数为39,故选项说法正确;
D、根据元素周期表中的一格中获取的信息,可知元素的相对原子质量为88.91,非原子的实际质量,故选项说法错误;
故选:D。
12.(1分)下列物质含有氧气的是( )
A.H2OB.CO2C.空气D.H2O2
【解答】解:A、H2O是纯净物,没有氧气;故选项错误;
B、CO2是纯净物,没有氧气;故选项错误;
C、空气中含有氧气、氮气等,故选项正确;
D、H2O2是纯净物,没有氧气;故选项错误;
故选:C。
13.(1分)下列金属矿石可用来冶炼铜的是( )
A.赤铁矿(主要成分为Fe2O3)
B.辉铜矿(主要成分为Cu2S)
C.铝土矿(主要成分为Al2O3)
D.磁铁矿(主要成分为Fe3O4)
【解答】解:A、赤铁矿中不含铜元素,不能用于冶炼铜,不合题意;
B、辉铜矿中含有铜元素,可用于冶炼铜,符合题意;
C、铝土矿中不含铜元素,不能用于冶炼铜,不合题意;
D、磁铁矿中不含铜元素,不能用于冶炼铜,不合题意;
故选:B。
14.(1分)下列关于物质用途的说法不正确的是( )
A.二氧化碳用于灭火
B.氧气用于医疗急救
C.氯化钠用于治疗胃酸过多
D.盐酸用于金属表面除锈
【解答】解:A、二氧化碳不能燃烧、不能支持燃烧、密度比空气的大,可用于灭火,故选项说法正确。
B、氧气能供给呼吸,可用于医疗急救,故选项说法正确。
C、氯化钠不能与胃液中的盐酸反应,不能用于治疗胃酸过多,故选项说法错误。
D、盐酸能与铁锈的主要成分氧化铁反应生成氯化铁和水,可用于金属表面除锈,故选项说法正确。
故选:C。
中医药文化博大精深,化学能助力现代中医药的发展,回答15~16题。
15.板蓝根含生物碱、糖类、酚类等多种物质,有清热解毒、凉血利咽的功效。板蓝根属于( )
A.混合物B.纯净物C.化合物D.单质
【解答】解:A、板蓝根含生物碱、糖类、酚类等多种物质,属于混合物;故选项正确;
B、纯净物是由一种物质组成,板蓝根不是纯净物,属于混合物;故选项错误;
C、由两种或两种以上的元素组成的纯净物叫化合物,板蓝根不是化合物,属于混合物;故选项错误;
D、由同种元素组成的纯净物叫单质,板蓝根不是单质,属于混合物;故选项错误;
故选:A。
16.板蓝根中某有效成分的化学式为C9H7NO2。下列关于该成分的说法不正确的是( )
A.由碳、氢、氮、氧四种元素组成
B.氮、氧元素的质量比为1:2
C.1个分子中有19个原子
D.碳元素的质量分数最大
【解答】解:A、C9H7NO2由碳、氢、氮、氧四种元素组成,正确但不符合题意,故选项错误;
B、氮、氧元素的质量比为1:2错误,因为1:2是原子个数比,错误符合题意,故选项正确;
C、1个分子中的原子个数=9+7+1+2=19,正确但不符合题意,故选项错误;
D、C9H7NO2中碳元素的质量分数最大正确,因为碳元素、氢元素、氮元素、氧元素的质量比=(12×9):7:14:32=108:7:14:32;正确但不符合题意,故选项错误;
故选:B。
17.(1分)配制100g15%的NaCl溶液的过程如图。下列说法不正确的是( )
A.称量时,需称量15gNaCl固体
B.量取时,需量取100mL蒸馏水
C.溶解时,用玻璃棒搅拌以加快NaCl的溶解
D.从配好的溶液中取出10g,其溶质的质量分数为15%
【解答】解:A、配制100g15%的NaCl溶液,称量时,需称量NaCl固体的质量为100g×15%=15g,故A正确;
B、量取时,需要蒸馏水的质量为100g﹣15g=85g,体积为85g÷1g/mL=85mL,故B错误;
C、溶解时,用玻璃棒搅拌可以加快NaCl的溶解速率,故C正确;
D、溶液是均一、稳定的,则从配好的溶液中取出10g,其溶质的质量分数为15%,故D正确;
故选:B。
18.(1分)下列化学方程式书写正确的是( )
A.H2O2H2↑+O2↑
B.CH4+2O2═2H2O+CO2
C.Cu+AgNO3═Cu(NO3)2+Ag
D.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【解答】解:A、过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为2H2O22H2O+O2↑,故选项错误。
B、该化学方程式缺少反应条件,正确的化学方程式应为CH4+2O22H2O+CO2,故选项错误。
C、该化学方程式没有配平,正确的化学方程式应为Cu+2AgNO3═Cu(NO3)2+2Ag,故选项错误。
D、该化学方程式书写完全正确,故选项正确。
故选:D。
化学为我国载人深潜事业的发展提供了强有力的支撑。回答19~20题。
19.为使深海载人潜水器不过重,又能克服深海的巨大压力,以及耐深海海水的腐蚀,科学家选用钛合金制作潜水器的外壳。据此分析钛合金的性能不包括( )
A.密度小B.抗压能力强
C.导电导热性好D.抗腐蚀性好
【解答】解:钛合金用于深海装备主要利用了钛合金的抗腐蚀性好、抗压能力强、密度小,与导电导热性好无关。
故选:C。
20.潜水器常用过氧化钠(Na2O2)作供氧剂,其反应为2Na2O2+2CO2═O2+2X。下列说法正确的是( )
A.CO2中碳元素的化合价为+2价
B.该反应为复分解反应
C.X由钠元素和碳元素组成
D.该反应能消耗潜水器中的CO2
【解答】解:A、根据化合物中各元素的化合价代数和为零,CO2中氧元素为﹣2价,故碳元素的化合价为+4,故A错误;
B、由分析可知,反应为2Na2O2+2CO2═O2+2Na2CO3,生成物中,氧气属于单质,所以该反应不属于复分解反应,故B错误;
C、由分析可知,X的化学式为Na2CO3,Na2CO3由钠、碳、氧三种元素组成,故C错误;
D、根据反应2Na2O2+2CO2═O2+2Na2CO3可知,该反应能消耗潜水器中的CO2,故D正确;
故选:D。
KCl溶液是临床常用的电解质平衡调节药。依据实验和溶解度曲线,回答21~22题。
21.②中溶质的质量为( )
A.30gB.70gC.100gD.130g
【解答】解:加入30g的氯化钾后烧杯底部没有固体剩余,再次加入10g的氯化钾后烧杯底部才有固体剩余,所以②中溶质的质量为30g,故选:A。
22.下列说法正确的是( )
A.②中溶质的质量分数为30%
B.③中溶质与溶剂的质量比为40:100
C.④是不饱和溶液
D.KCl饱和溶液升温可变为不饱和溶液
【解答】解:A、②中溶质的质量分数为×100%≠30%,故A错误;
B、20℃时,氯化钾的溶解度小于40g,所以③中溶质与溶剂的质量比小于40:100,故B错误;
C、40℃时,氯化钾的溶解度是40g,所以④是饱和溶液,故C错误;
D、氯化钾的溶解度随温度的升高而增大,所以KCl饱和溶液升温可变为不饱和溶液,故D正确。
故选:D。
23.(1分)利用如图实验验证分子在不断运动,观察到b中溶液变红。下列说法不正确的是( )
A.HCl分子运动到了b中
B.利用了盐酸的酸性
C.利用了浓盐酸的挥发性
D.可用浓硫酸代替浓盐酸
【解答】解:A、浓盐酸具有挥发性,是HCl分子运动到了b中,故选项说法正确。
B、观察到b中溶液变红,利用了盐酸的酸性,故选项说法正确。
C、观察到b中溶液变红,两者没有直接接触,利用了浓盐酸的挥发性,故选项说法正确。
D、浓硫酸不具有挥发性,不能用浓硫酸代替浓盐酸,故选项说法错误。
故选:D。
24.(1分)乙炔(C2H2)燃烧时火焰温度可超过3000℃,燃烧反应前后分子种类变化的微观示意图如图:
下列说法不正确的是( )
A.26g甲中氢元素的质量为2g
B.乙的相对分子质量为32
C.生成的丙、丁均为氧化物
D.生成的丙与丁的分子个数比为1:1
【解答】解:由发生反应的微观过程图可知,该反应的方程式是:2C2H2+5O24CO2+2H2O;
A、由微粒的构成可知,甲的化学式为C2H2,26g甲中氢元素质量为:26g××100%=2g,故A说法正确;
B、乙的相对分子质量为:16×2=32,故B说法正确;
C、由物质的组成可知,丙是二氧化碳,丁是水,均为氧化物、故C说法正确;
D、由化学方程式可知,生成丙与丁的分子个数比为2:1,故D说法不正确;
故选:D。
25.(1分)用如图实验研究碱的性质。用注射器分别推入等体积的溶液,观察到实验①中气球明显变鼓,实验②中气球略微变鼓。下列说法不正确的是( )
A.实验前需检查两个装置的气密性
B.实验中气球变鼓是因为集气瓶内气压小于外界大气压
C.实验①②的现象除气球变鼓程度不同,无其他明显差异
D.从吸收CO2的效果来看,浓NaOH溶液优于澄清石灰水
【解答】解:A、实验前需检查两个装置的气密性,故选项正确。
B、实验中气球变鼓是因为集气瓶内气压小于外界大气压,导致外界气体进入气球,故选项正确。
C、实验①②的现象除气球变鼓程度不同外,②中液体变浑浊,故选项不正确。
D、从吸收CO2的效果来看,浓NaOH溶液优于澄清石灰水,故选项正确。
故选:C。
二、【生活现象解释】
26.(4分)从稻种到美食,凝结着劳动者的智慧。
(1)选种:可用密度为1.16g•mL﹣1的NaCl溶液选种。NaCl溶液的溶质为 NaCl 。
(2)种植:水稻最适宜在中性土壤中生长。若要改良酸性土壤以适宜水稻生长,可以选择的物质为 b (填序号)。
a.NaCl
b.Ca(OH)2
c.H2SO4
(3)施肥:水稻在生长早期需施加大量氮肥。常见的化肥K2SO4、CO(NH2)2、Ca3(PO4)2中,属于氮肥的是 CO(NH2)2 。
(4)制作美食:粽子是我国端午节的传统美食,某粽子中含有糯米、蛋黄、肉等食材,其中富含糖类的是 糯米 。
【解答】解:(1)NaCl溶液为NaCl的水溶液,溶质为NaCl;
(2)水稻最适宜在中性土壤中生长,若要改良酸性土壤,可向土壤中施加适量的氢氧化钙,故选:b;
(3)氮肥是氮、磷、钾中含有氮元素的肥料,CO(NH2)2是氮肥;
(4)糯米富含淀粉,淀粉属于糖类;蛋黄富含蛋白质;肉富含油脂与蛋白质。
故答案为:(1)NaCl;
(2)b;
(3)CO(NH2)2;
(4)糯米。
27.(3分)我国要在2060年前实现碳中和,需要多方共同努力。
(1)下列做法符合“低碳”理念的有 ab (填序号)。
a.骑自行车出行
b.纸张双面打印
c.使用一次性餐具
(2)我国已能将CO2捕集后通过输送管道注入海底,实现碳封存。
①捕集后CO2被压缩,其分子间隔 变小 (填“变大”或“变小”)。
②输送管道易被酸腐蚀,解释CO2进入输送管道前需干燥的原因: 二氧化碳能和水反应生成碳酸 。
【解答】解:(1)a.骑自行车出行,能减少二氧化碳排放量,符合“低碳”理念。
b.纸张双面打印,可以减少森林的砍伐,树木可以通过光合作用吸收二氧化碳,同时还可以减少生产中所消耗的能源,符合“低碳”理念。
c.使用一次性餐具,增加了资源的消耗、二氧化碳的排放等,不符合“低碳”理念。
(2)①捕集后CO2被压缩,是因为分子间有间隔,气体受压后,分子间的间隔变小。
②输送管道易被酸腐蚀,CO2进入输送管道前需干燥,是因为二氧化碳能和水反应生成碳酸。
故答案为:
(1)ab;
(2)①变小;②二氧化碳能和水反应生成碳酸。
三、【科普阅读理解】
28.(6分)阅读下面科普短文。
微塑料是指直径小于5mm的塑料颗粒。微塑料难以降解,污水处理厂也不能将其彻底去除,会对生态环境造成危害。为此,研究人员开展了絮凝法去除废水中微塑料的研究。磨砂洗面奶中含有微塑料。为研究絮凝剂种类、絮凝温度和沉降时间对微塑料絮凝效果的影响,研究人员配制了1.0g•L﹣1磨砂洗面奶废水进行模拟实验,并测得该废水的浊度为450NTU(浊度越小,絮凝效果越好)。研究人员研究不同絮凝剂对微塑料絮凝效果的影响,结果见表1。表1用不同絮凝剂处理后的水样浊度。
为研究絮凝温度对絮凝效果的影响,研究人员向1L废水中加入10mg硫酸铝,分别在不同温度下沉降40min后测定浊度,结果如图1所示。为研究沉降时间对絮凝效果的影响,研究人员向1L废水中加入10mg硫酸铝,保持絮凝温度相同,沉降不同时间后测定浊度,结果如图2所示。
未来,政府、企业、科研机构和公众将共同努力,推动微塑料污染的防治工作。
依据文章回答下列问题。
(1)塑料属于 有机合成材料 (填“金属材料”或“有机合成材料”)。
(2)聚合硫酸铁不能作为磨砂洗面奶废水的絮凝剂,结合表1分析其证据是 利用聚合硫酸铁时测定的废水的浊度为600NTU,絮凝效果差 。
(3)由图1可知,该实验条件下硫酸铝的最佳絮凝温度为 30 ℃。
(4)由图2可得结论:使用硫酸铝作为絮凝剂,保持絮凝温度相同,在实验研究的沉降时间范围内, 沉降时间越长,絮凝效果越好 。
(5)判断下列说法是否正确(填“对”或“错”)。
①微塑料不难降解,污水处理厂就能将其彻底去除。 错
②絮凝剂种类、絮凝温度、沉降时间都对絮凝效果有影响。 对
【解答】解:(1)塑料属于有机合成材料。
故答案为:有机合成材料。
(2)聚合硫酸铁不能作为磨砂洗面奶废水的絮凝剂,结合表1分析其证据是利用聚合硫酸铁时测定的废水的浊度为600NTU,絮凝效果差。
故答案为:利用聚合硫酸铁时测定的废水的浊度为600NTU,絮凝效果差。
(3)由图1可知,该实验条件下硫酸铝的最佳絮凝温度为30℃,是因为该温度下硫酸铝的絮凝效果最好。
故答案为:30。
(4)由图2可得结论:使用硫酸铝作为絮凝剂,保持絮凝温度相同,在实验研究的沉降时间范围内,沉降时间越长,絮凝效果越好。
故答案为:沉降时间越长,絮凝效果越好。
(5)①微塑料难降解,说法不正确。
②絮凝剂种类、絮凝温度、沉降时间都对絮凝效果有影响,说法正确。
故答案为:①错;②对。
四、【生产实际分析】
29.(3分)镍(Ni)可用于制造不锈钢等。以粗氧化镍(主要成分为NiO,含有少量Fe2O3)制备高纯镍的主要流程如图:
(1)①中NiO发生置换反应生成了水,该反应的化学方程式为 NiO+H2Ni+H2O 。
(2)步骤③的目的是 除去Fe(CO)3 。
(3)④中发生反应的基本反应类型是 分解反应 。
【解答】解:(1)①中NiO和氢气发生置换反应生成镍和水,反应化学方程式为NiO+H2Ni+H2O;
(2)根据流程图可知,步骤③是通过蒸馏从Ni(CO)4、Fe(CO)3混合物中得到Ni(CO)4,故步骤③的目的是除去Fe(CO)3;
(3)④中是Ni(CO)4在260~350℃的条件下生成一氧化碳和镍,符合一变多的特征,属于分解反应。
故答案为:
(1)NiO+H2Ni+H2O;
(2)除去Fe(CO)3;
(3)分解反应。
30.(3分)纳米级Mg(OH)2有独特的阻燃性能,应用广泛。以MgO制备纳米级Mg(OH)2的主要流程如图:
(1)稀释塔内壁不能使用铁质材料,用化学方程式解释其原因: Fe+H2SO4=FeSO4+H2↑ 。
(2)反应池中加入的碱为 NaOH 。
(3)上述流程中,镁元素的化合价 不变 (填“改变”或“不变”)。
【解答】解:(1)浓硫酸被稀释后得到稀硫酸,若稀释塔内壁使用铁质材料,稀硫酸与铁反应生成硫酸亚铁和氢气,稀释塔被腐蚀,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;
(2)根据化学反应前后元素的种类不变及复分解反应发生规律可知,氢氧化钠与硫酸镁反应生成氢氧化镁沉淀和硫酸钠,因此反应池中加入的碱为NaOH;
(3)上述流程中,涉及到含镁的物质有氧化镁、硫酸镁、氢氧化镁,因此镁元素的化合价没有发生改变。
故答案为:
(1)Fe+H2SO4=FeSO4+H2↑;
(2)NaOH;
(3)不变。
五、【基本实验及其原理分析】
31.(2分)从A或B中任选一个作答,若均作答,按A计分。
(1)①中反应的化学方程式为 2KMnO4K2MnO4+MnO2+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑ 。
(2)②中观察到的现象是 红热的木炭燃烧,发出白光或紫色石蕊溶液变红色 。
【解答】解:(1)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,要注意配平;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;故答案为:2KMnO4K2MnO4+MnO2+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)A中②的现象:红热的木炭燃烧,发出白光;B中②的现象:紫色石蕊试液变红色,因为二氧化碳和水反应生成碳酸;故答案为:红热的木炭燃烧,发出白光或紫色石蕊溶液变红色。
32.(3分)实验小组进行实验,去除粗盐中的难溶性杂质。
(1)将粗盐溶解后,能将其中的难溶性杂质去除的实验操作是 过滤 (填操作名称)。
(2)蒸发需要用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、 ②④ (填序号)。
①试管
②蒸发皿
③烧杯
④玻璃棒
(3)开始加热至出现晶体前,溶液中氯化钠的质量分数逐渐 增大 (填“增大”或“减小”)。
【解答】解:(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与氯化钠初步分离)、过滤(把不溶物彻底除去)、蒸发(氯化钠从溶液中分离出来)得到精盐的过程,则将粗盐溶解后,能将其中的难溶性杂质去除的实验操作是过滤。
(2)蒸发是利用加热的方法,使溶液中溶剂不断蒸发而析出溶质的过程,蒸发需要用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、蒸发皿、玻璃棒。
(3)开始加热至出现晶体前,溶液中溶质质量不变,溶剂质量不断减少,溶液中氯化钠的质量分数逐渐增大。
故答案为:
(1)过滤;
(2)②④;
(3)增大。
33.(3分)如图所示,向井穴板的孔穴1~4中滴加稀盐酸。
(1)孔穴1中溶液变黄,因为生成了 FeCl3 (填化学式)。
(2)产生气泡的孔穴有 3、4 (填序号),其中发生反应的化学方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑或Mg+2HCl═MgCl2+H2↑ (写出一个即可)。
【解答】解:(1)孔穴1中溶液变黄,因为生成了FeCl3。
故答案为:FeCl3。
(2)产生气泡的孔穴有3、4,其中发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑、Mg+2HCl═MgCl2+H2↑。
故答案为:3、4;Na2CO3+2HCl═2NaCl+H2O+CO2↑或Mg+2HCl═MgCl2+H2↑。
34.(3分)用如图实验验证可燃物的燃烧条件。
已知:白磷的着火点为40℃,红磷的着火点为240℃。
(1)将电炉调到100℃,能证明可燃物燃烧需要温度达到着火点的现象是 电炉上白磷燃烧,红磷不燃烧 。
(2)为验证可燃物燃烧需要与氧气接触,可将电炉调至 c (填序号)。
a.20℃
b.120℃
c.300℃
(3)实验中用到了铜板,利用了铜 导热 的性质。
【解答】解:(1)将电炉调到100℃,能证明可燃物燃烧需要温度达到着火点的现象是电炉上白磷燃烧,红磷不燃烧;
(2)由图可知,②、③的唯一变量为是否与氧气接触,故为验证可燃物燃烧需要与氧气接触,可将电炉调至300℃,故选c;
(3)实验中用到了铜板,利用了铜导热的性质。
故答案为:(1)电炉上白磷燃烧,红磷不燃烧;
(2)c;
(3)导热。
35.(2分)为验证铁、铜、银的金属活动性顺序,设计如下实验。
(1)实验1中,能说明铁的金属活动性比铜强的现象是 铜球表面无变化,铁球表面有气泡冒出 。
(2)为达成实验目的,X可以为 b (填序号)。
a.CuSO4
b.AgNO3
c.H2SO4
【解答】解:(1)铜球不与硫酸反应,铁球与硫酸反应生成硫酸亚铁和氢气,可得出结论:铁的金属活动性比铜强。
(2)通过实验1证明铁的金属活动性比铜强;所以实验2要证明铜的金属活动性比银强;
a、铜、银都不与硫酸铜反应,无法判断铜、银的金属活动性,故错误;
b、铜与硝酸银反应,说明铜的金属活动性比银强,故正确;
c、铜、银都不与硫酸反应,无法判断铜、银的金属活动性,故错误。
故答案为:(1)铜球表面无变化,铁球表面有气泡冒出;
(2)b。
36.(3分)用如图实验探究NaOH与H2SO4的反应。
(1)步骤1中能观察到的实验现象是 溶液变红色 。
(2)步骤2中发生反应的化学方程式为 2NaOH+H2SO4═Na2SO4+2H2O 。
(3)该实验能证明NaOH与H2SO4发生反应,结合实验现象说明理由: 溶液由红色变成无色,说明氢氧化钠消失,即氢氧化钠能和稀硫酸反应 。
【解答】解:(1)步骤1中能观察到的实验现象是溶液变红色。
故答案为:溶液变红色。
(2)步骤2中发生反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O。
故答案为:2NaOH+H2SO4═Na2SO4+2H2O。
(3)该实验能证明NaOH与H2SO4发生反应,是因为溶液由红色变成无色,说明氢氧化钠消失,即氢氧化钠能和稀硫酸反应。
故答案为:溶液由红色变成无色,说明氢氧化钠消失,即氢氧化钠能和稀硫酸反应。
六、【科学探究】
37.(6分)铜箔应用广泛,工业上可用电解法制备。常用的电解液为CuSO4溶液,并用稀H2SO4调电解液初始pH。兴趣小组研究电流密度、电解液初始pH、电极板间距对Cu的电沉积速率和铜箔的拉伸强度的影响。
【查阅资料】
ⅰ.一般情况下,酸的浓度越大,pH越小。
ⅱ.其他条件不变时,CuSO4浓度越小,电沉积速率越小。
【进行实验】兴趣小组在如图所示装置中按下表进行实验,记录0~45min内平均电沉积速率及拉伸强度的数据。
【解释与结论】
(1)电解CuSO4溶液的反应如下,配平化学方程式:2CuSO4+2H2O□Cu+□H2SO4+O2↑。
(2)①②③的目的是 探究电解液初始pH对电沉积速率、拉伸强度的影响 。
(3)为探究电极板间距的影响,④中a为 3或2 。为使铜箔的拉伸强度最大,应选择的电极板间距为 20 mm。
(4)根据②⑥⑦,可得关于电沉积速率的结论是 其它条件相同时,电流密度越大,电沉积速率越大 。
【反思与评价】
(5)另一小组实时监控电解过程中的电沉积速率,发现电沉积速率有加快的现象。结合实验推测可能的原因是 电流通过时放热,温度升高,导致电沉积速率加快 。
【解答】解:(1)反应的化学方程式是2CuSO4+2H2O2Cu+2H2SO4+O2↑。
故答案为:2;2。
(2)①②③的目的是探究电解液初始pH对电沉积速率、拉伸强度的影响。
故答案为:探究电解液初始pH对电沉积速率、拉伸强度的影响。
(3)为探究电极板间距的影响,④中a为3(③④对比)或2(④⑤对比)。为使铜箔的拉伸强度最大,应选择的电极板间距为20mm。
故答案为:3或2;20。
(4)根据②⑥⑦,可得关于电沉积速率的结论是其它条件相同时,电流密度越大,电沉积速率越大。
故答案为:其它条件相同时,电流密度越大,电沉积速率越大。
(5)另一小组实时监控电解过程中的电沉积速率,发现电沉积速率有加快的现象。结合实验推测可能的原因是电流通过时放热,温度升高,导致电沉积速率加快。
故答案为:电流通过时放热,温度升高,导致电沉积速率加快。
七、【实际应用定量计算】
38.(4分)NaCl是生活中常见的调味品,也是重要的工业原料。工业上利用它制备Na、NaOH的反应如下:
①2NaCl2Na+Cl2↑
②2NaCl+2H2O2NaOH+H2↑+Cl2↑
(1)①中,若消耗117kgNaCl,计算生成的Na的质量(写出计算过程及结果)。
(2)分别利用①和②制备质量相等的Cl2,理论上需要的NaCl质量 相等 (填“相等”或“不相等”)。
【解答】解:(1)设生成的Na的质量为x。
2NaCl2Na+Cl2↑
117 46
117kg x
x=46kg
答:若消耗117kgNaCl,生成的Na的质量为46kg。
(2)分别利用①和②制备质量相等的Cl2,由反应的化学方程式2NaCl2Na+Cl2↑、2NaCl+2H2O2NaOH+H2↑+Cl2↑可知,两个反应中,氯化钠中的氯元素全部转化成氯气,所以理论上需要的NaCl质量相等。
故答案为:
(1)46kg;
(2)相等。
絮凝剂
聚合硫酸铁
硅藻土
生石灰
硫酸铝
浊度/NTU
600
140
2.60
1.30
A.O2的制取与性质
B.CO2的制取与性质
实验序号
电流密度(A•m−2)
电解液初始pH
电极板间距(mm)
电沉积速率(g•h−1•m−2)
拉伸强度(MPa)
①
300
1
20
335
80
②
300
2
20
315
98
③
300
3
20
300
96
④
300
a
10
320
92
⑤
300
2
30
300
91
⑥
200
2
20
225
78
⑦
400
2
20
510
87
絮凝剂
聚合硫酸铁
硅藻土
生石灰
硫酸铝
浊度/NTU
600
140
2.60
1.30
A.O2的制取与性质
B.CO2的制取与性质
实验序号
电流密度(A•m−2)
电解液初始pH
电极板间距(mm)
电沉积速率(g•h−1•m−2)
拉伸强度(MPa)
①
300
1
20
335
80
②
300
2
20
315
98
③
300
3
20
300
96
④
300
a
10
320
92
⑤
300
2
30
300
91
⑥
200
2
20
225
78
⑦
400
2
20
510
87
相关试卷
这是一份北京市海淀区2023届九年级中考一模化学试卷+答案,共10页。
这是一份2022年北京市海淀区中考化学一模试卷(含答案),共40页。
这是一份2022年北京市海淀区中考一模化学试题,共11页。试卷主要包含了下列属于金属元素的是,下列属于有机化合物的是,下列属于溶液的是,下列CO的性质属于化学性质的是,下列金属活动性最弱的是,配制50g15%的NaCl溶液等内容,欢迎下载使用。








