海南省海口市海南师范大学附属中学2023-2024学年九年级下学期期中考试化学试题A卷
展开一、选择题(共14小题,每小题3分,共42分)
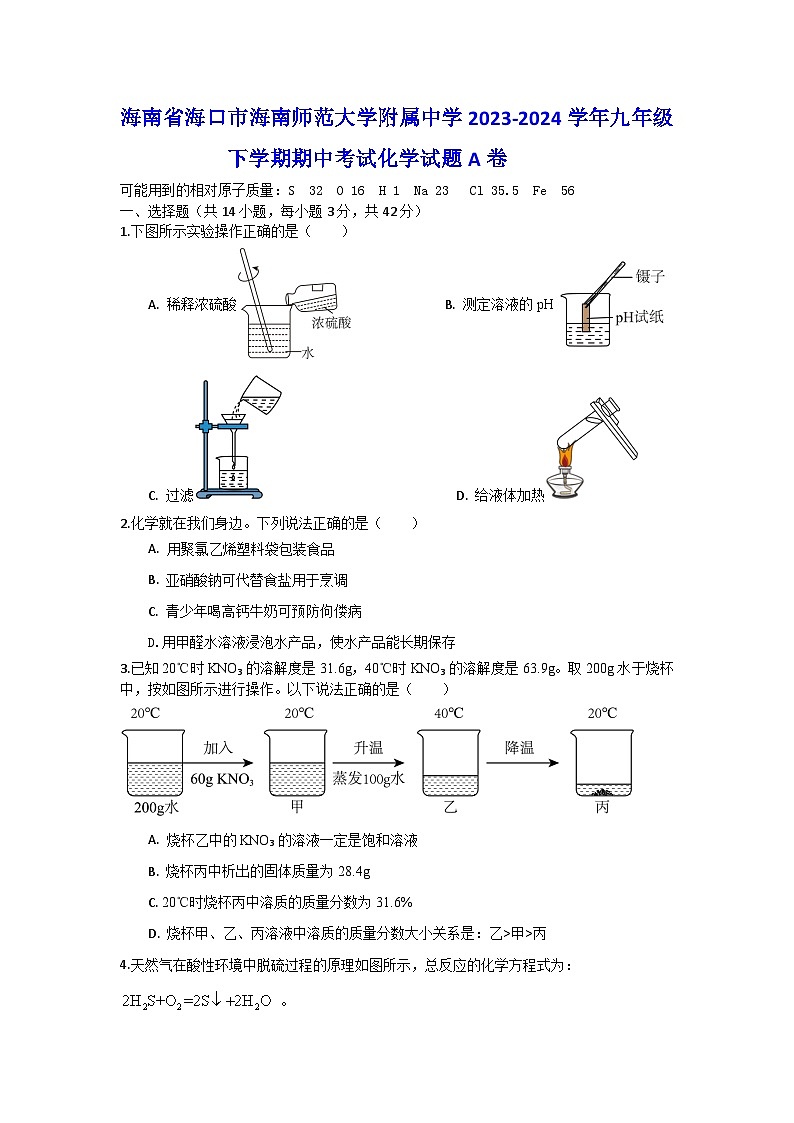
1.下图所示实验操作正确的是( )
A. 稀释浓硫酸B. 测定溶液的pH
C. 过滤 D. 给液体加热
2.化学就在我们身边。下列说法正确的是( )
A. 用聚氯乙烯塑料袋包装食品
B. 亚硝酸钠可代替食盐用于烹调
C. 青少年喝高钙牛奶可预防佝偻病
D.用甲醛水溶液浸泡水产品,使水产品能长期保存
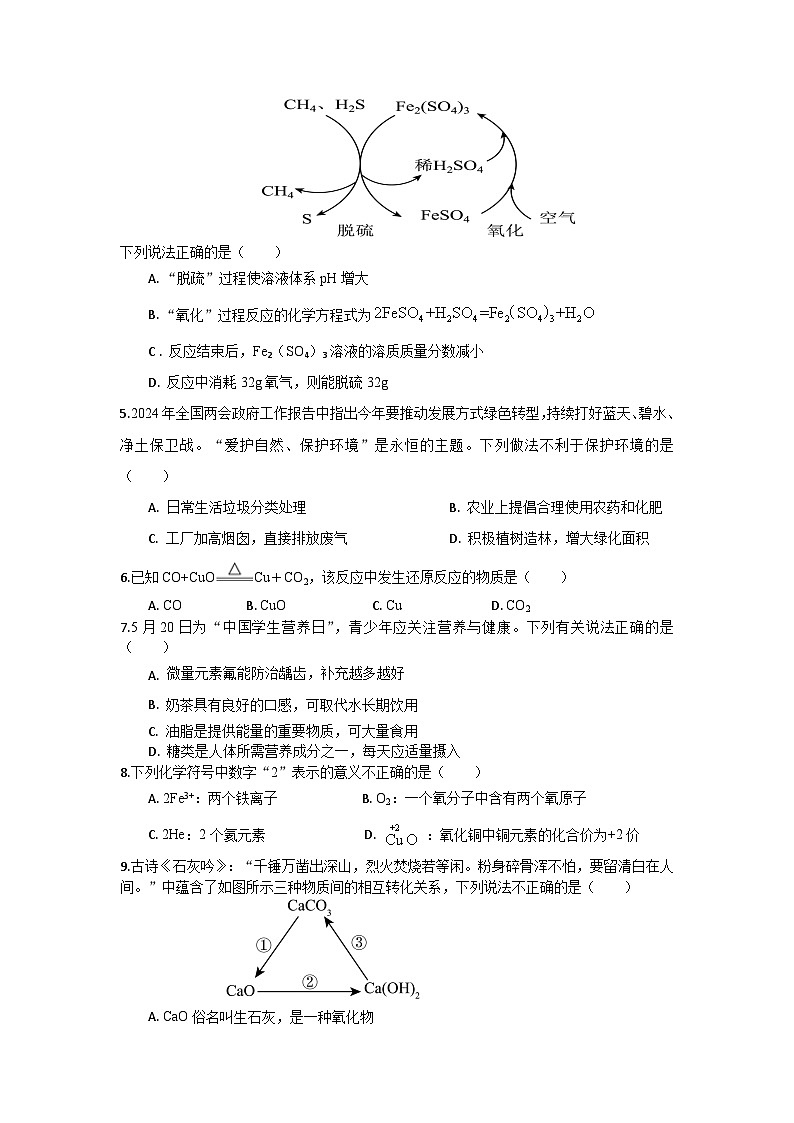
3.已知20℃时KNO3的溶解度是31.6g,40℃时KNO3的溶解度是63.9g。取200g水于烧杯中,按如图所示进行操作。以下说法正确的是( )
A. 烧杯乙中的KNO3的溶液一定是饱和溶液
B. 烧杯丙中析出的固体质量为28.4g
C. 20℃时烧杯丙中溶质的质量分数为31.6%
D. 烧杯甲、乙、丙溶液中溶质的质量分数大小关系是:乙>甲>丙
4.天然气在酸性环境中脱硫过程的原理如图所示,总反应的化学方程式为: 。
下列说法正确的是( )
A. “脱疏”过程使溶液体系pH增大
B. “氧化”过程反应的化学方程式为
C . 反应结束后,Fe2(SO4)3溶液的溶质质量分数减小
D. 反应中消耗32g氧气,则能脱硫32g
5.2024年全国两会政府工作报告中指出今年要推动发展方式绿色转型,持续打好蓝天、碧水、净土保卫战。“爱护自然、保护环境”是永恒的主题。下列做法不利于保护环境的是( )
A. 日常生活垃圾分类处理 B. 农业上提倡合理使用农药和化肥
C. 工厂加高烟囱,直接排放废气 D. 积极植树造林,增大绿化面积
6.已知CO+CuOCu+CO2,该反应中发生还原反应的物质是( )
A. CO B. CuO C. Cu D. CO2
7.5月20日为“中国学生营养日”,青少年应关注营养与健康。下列有关说法正确的是( )
微量元素氟能防治龋齿,补充越多越好
B. 奶茶具有良好的口感,可取代水长期饮用
C. 油脂是提供能量的重要物质,可大量食用
D. 糖类是人体所需营养成分之一,每天应适量摄入
8.下列化学符号中数字“2”表示的意义不正确的是( )
A. 2Fe3+:两个铁离子 B. O2:一个氧分子中含有两个氧原子
C. 2He:2个氦元素 D. :氧化铜中铜元素的化合价为+2价
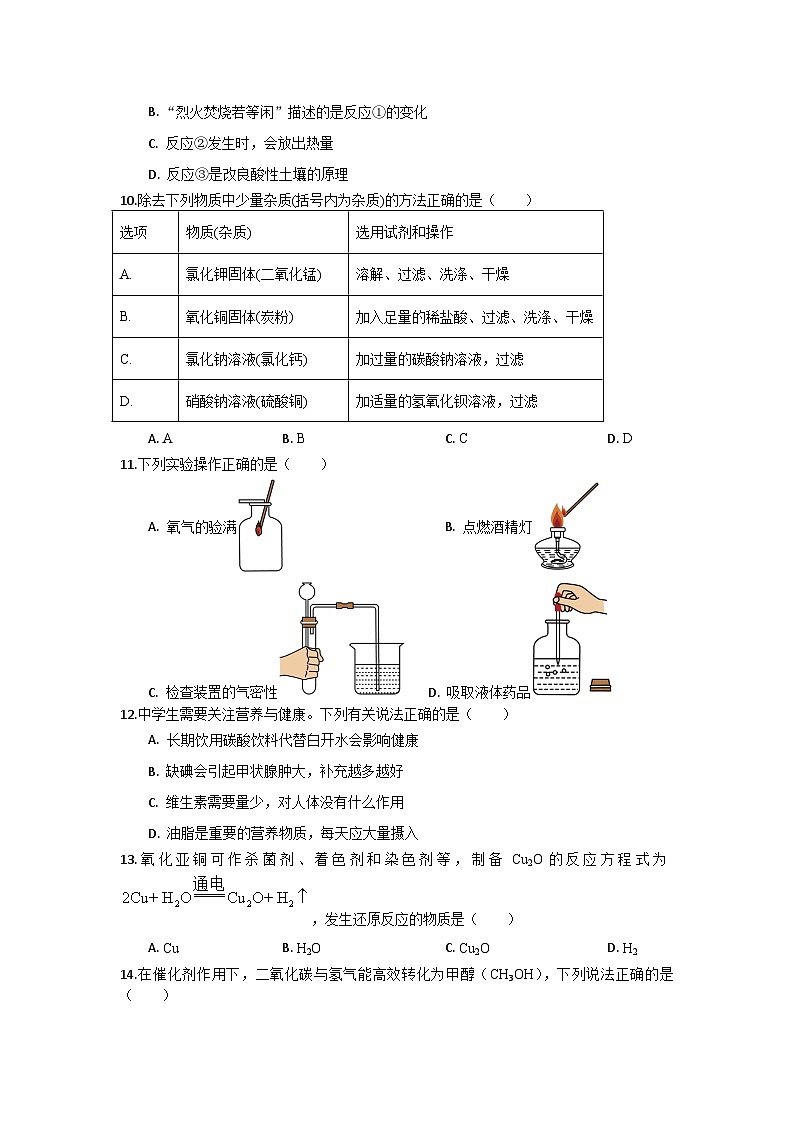
9.古诗《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”中蕴含了如图所示三种物质间的相互转化关系,下列说法不正确的是( )
A. CaO俗名叫生石灰,是一种氧化物
B. “烈火焚烧若等闲”描述的是反应①的变化
C. 反应②发生时,会放出热量
D. 反应③是改良酸性土壤的原理
10.除去下列物质中少量杂质(括号内为杂质)的方法正确的是( )
A. AB. BC. CD. D
11.下列实验操作正确的是( )
A. 氧气的验满 B. 点燃酒精灯
C. 检查装置的气密性 D. 吸取液体药品
12.中学生需要关注营养与健康。下列有关说法正确的是( )
A. 长期饮用碳酸饮料代替白开水会影响健康
B. 缺碘会引起甲状腺肿大,补充越多越好
C. 维生素需要量少,对人体没有什么作用
D. 油脂是重要的营养物质,每天应大量摄入
13.氧化亚铜可作杀菌剂、着色剂和染色剂等,制备 Cu2O 的反应方程式为,发生还原反应的物质是( )
A. CuB. H2OC. Cu2OD. H2
14.在催化剂作用下,二氧化碳与氢气能高效转化为甲醇(CH3OH),下列说法正确的是( )
A. 反应前后原子、分子种类没有发生改变
B. 反应前后氢元素的化合价未改变
C. 该反应的四种物质中有两种氧化物
D. 参加反应的甲和乙的个数比为1∶1
二、非选择题(共58分)
15.(8分)2024年4月29日,神舟十八号载人航天飞船成功发射,推动中国航天发展进入新高度。
(1)航天器的天线用钛合金制成。钛合金属于______________(选填“混合物”或“纯净物”) ;
(2)宇航服在制造过程中使用了合成纤维、羊毛、尼龙膜等材料。材料中属于天然高分子材料的是______________ ;
(3)下列航天食品中富含糖类的是______________(填字母) ;
A.太空粽子 B.鱼香肉丝 C.酱香油麦菜
(4)空间站里的备用O2可由高氯酸锂(LiC1O4)受热分解获得,同时生成LiC1。该反应的化学方程式为______________ ;
(5)运载火箭使用的燃料为液氢。科学家研发出一种以铝镓合金和水为原料常温下获得氢气的新工艺,主要反应为 ,该化学反应的基本反应类型为______________,该工艺流程的优点是______________。
16.(10分)海口市早已在城区全面禁止燃放烟花爆竹。
(1)制作烟花爆竹的主要原料黑火药,其爆炸时发生的主要反应为
①爆炸反应中,元素化合价没有发生变化的是O和______________(填元 素符号),
②燃放烟花爆竹时,产生有刺激性气味的SO2的原因是______________ ;
(2)兴趣小组设计了如图所示实验装置,进行实验探究SO2的性质 ;
已知:I.
Ⅱ.
①根据pH计传感器采集信息形成的图像,可以判断出装置B在_______________min后,得到的溶液pH值达到酸雨的标准;在0-5min之间,其溶液的酸性不断______________,
②装置C用NaOH溶液吸收SO2的目的是______________,发生反应的化学方程式为______________ ;
(3)SO2是一种食品添加剂。葡萄酒酿造过程中添加SO2可以防止其变质,但必须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤250mgL。为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤一:取100ml该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成H2SO4(发生反应的化学方程式为 ),
步骤二:向锥形瓶中滴加1~2滴酚酞试液,然后滴加NaOH溶液至恰好完全反应,测得锥形瓶中H2SO4的质量为29.4mg,
①步骤二中,观察到锥形瓶中的溶液由无色变成______________,证明H2SO4溶液已反应完全。
②通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
17.(10分)下图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空。
(1)在______℃时,甲和丙的溶解度相等;
(2)t1℃时,将乙溶液的状态由 M 点变为N 点,方法是______;
(3)t3℃时,将40g 甲放入 50g 水中,充分溶解后所得溶液的质量为______;
(4)t3℃时,将 125g 丙的饱和溶液降温至t1℃,应再加入______g 丙才能恰好达到饱和状态。
18.(10分)回答下列有关实验基本操作和设计的问题。
(1)量取18.0mL蒸馏水最好选用的量筒规格是_______(填序号);
A.5mL B.10mL C.25mL D.100mL
(2)向如图所示烧杯中,加入适量的_________(填序号),可能引燃铜片上的白磷;
A.浓硫酸 B.硝酸铵 C.氯化钠
(3)探究紫色石蕊变色规律的实验中,往点滴板1~6号的孔穴中先加入如图所示的试剂,再分别滴入2滴紫色石蕊溶液。其中作为空白对照实验的是孔穴_______(填孔穴编号);
(4)实验室常用较浓的过氧化氢溶液与二氧化锰制氧气;
①反应的化学方程式为_________________________________,
②实验中,为了得到平稳的气流,最适合的装置组合是_______________(填序号)。
19.(10分)现有已部分锈独的生铁粉末(成分为碳、铁、氧化铁),化学兴趣小组欲测定该生铁粉末在锈蚀前的含碳量以及锈蚀的程度,设计了如下探究过程。
实验步骤一:取a克上述生铁样品放入一洁净干燥烧杯中,进行如下实验。
(1)生铁出现锈蚀现象的原因是_______;
实验中所得滤渣需要用蒸馏水洗涤、干燥后再称量。滤液甲在以下实验中已不需要,将其倒入废液缸。
实验步骤二:另取a克该生铁样品,进行如图所示实验,实验装置气密性良好。
(2)A装置瓶中盛放的试剂是_______;(填物质名称)
为防止装置内氢气不纯,加热时可能发生爆炸,实验前要打开弹簧夹K,先通入一会儿氢气,再点燃酒精灯加热,待完全反应后,熄灭酒精灯,冷却至室温,关闭弹簧夹K。实验结束后,C装置内浓硫酸的质量增加了0.54克。
实验步骤三:小组同学取实验步骤二中B装置硬质玻璃管内反应后所得全部黑色粉末进行了如下实验,所用装置和滤渣已略去。
(3)通过以上实验可得出,生铁中已锈蚀的铁的质量是__,生铁粉末锈蚀前的含碳量是___,有同学认为,由上述实验得出的已锈蚀的铁的质量可能存在误差,理由是_______;
(4)实验小组取部分滤液乙于烧杯中,加入一定质量的镁粉,充分反应后过滤,将滤渣洗涤、干燥,所得滤渣的质量与加入镁粉的质量相等,则所取溶液中参加反应的溶质的质量比是_______。(填最简整数比)
20.(10分)某氯碱工厂用电解饱和食盐水制取烧碱,原理为∶2H2O+2NaCl2NaOH+H2↑+Cl2↑,另将生成的H2与Cl2恰好完全化合生成HCl制取浓盐酸。现将22.1t饱和食盐水电解完全(忽略水的挥发和气体的溶解),共收集到H2为0.1t。试计算:
(1)NaOH中质量分数最大的元素为______;
(2)电解后所得烧碱溶液的溶质质量分数(结果精确到0.1%);
(3)制得溶质质量分数为36.5%浓盐酸的质量。
参考答案
15.【答案】(1)混合物 (2)羊毛
(3)A (4)
(5) ①. 置换反应 ②. 节约能源##操作安全简单等(写出一条合理即可)
【解析】【小问1详解】
钛合金是一种合金,属于混合物,故填混合物。
【小问2详解】
合成纤维属于有机合成材料,不是天然高分子材料,选项错误;
羊毛是一种天然材料,属于天然高分子材料,选项正确;
尼龙膜属于有机合成材料,不是天然高分子材料,选项错误,故填羊毛。
【小问3详解】
A 太空粽子中富含糖类,选项正确;
B 鱼香肉丝中富含蛋白质,选项错误;
C 酱香油麦菜中富含维生素,选项错误,故填A。
【小问4详解】
高氯酸锂受热分解生成LiC1和氧气,故反应的化学方程式写为:LiC1O4LiCl+2O2↑。
【小问5详解】
由化学方程式可知,该反应是一种单质与一种化合物生成另一种单质与另一种化合物的反应,符合置换反应的特点,属于置换反应,故填置换反应;
该工艺流程的优点是不需要加热或通电,节约能源,两种物质在镓的作用下直接反应,操作安全简单,故填节约能源或操作安全简单等。
16.【答案】(1) ①. K ②. 少量的硫与氧气反应##
(2) ①. 2.5 ②. 增强 ③. 防止SO2污染空气
④.
(3) ①. 浅红色 ②. 设100ml该葡萄酒含有SO2的质量为x,则
解得x=19.2mg
则该葡萄酒含有SO2的含量为≤250mg/L,则SO2的含量符合国家标准
【解析】【小问1详解】
①反应前S中硫元素的化合价为0,反应后K2S中钾元素的化合价为+1价,根据“化合物中各元素化合价代数和为零”,则硫元素为-2价,且反应前KNO3中,钾元素为+1价,氧元素化合价为-2价,设氮元素化合价为x,则1+x+(-2)×3=0,解得x=+5,但反应后N2中氮元素化合价为0,反应前C元素化合价为0,反应后CO2中碳元素为+4价,所以氧元素和钾元素化合价没有变,符号为O和K。
②由于硫燃烧会产生有刺激性气味的二氧化硫,则说明燃放烟花爆竹时,少量的硫与氧气反应。
【小问2详解】
①酸雨是指pH<5.6的雨,由图可知,当时间在2.5min后,得到的溶液pH值达到酸雨的标准;
且由图可知,溶液的pH不断减小,则说明溶液的酸性不断增强。
②二氧化硫会污染空气,需要尾气处理,则氢氧化钠溶液的作用为防止二氧化硫污染空气;
氢氧化钠与二氧化硫反应生成亚硫酸钠和水,反应的化学方程式为。
【小问3详解】
①酚酞遇酸不变色,遇碱变红色,则若溶液由无色变为红色,则说明硫酸已完全反应。
②见答案。
17.【答案】 ①. t2 ②. 增加溶剂 ③. 80g ④. 15
【解析】(1)由图可知,在t2℃时,甲、丙溶解度曲线相交于一点,该温度下,甲和丙的溶解度相等;
(2)t1℃时,M点为乙的饱和溶液,N点为乙的不饱和溶液,该温度下,将乙溶液的状态由 M 点变为N 点的方法是:增加溶剂;
(3)t3℃时,甲的溶解度为60g,该温度下,将40g 甲放入 50g 水中,只能溶解30g,形成溶液的质量为50g+30g=80g;
(4)t3℃时,125g 丙的饱和溶液中溶质质量为,溶剂质量为100g,降温至t1℃,该温度下,丙的溶解度为40g,要想达到饱和,还应加入40g -25g=15g丙。
18.【答案】 ①. C ②. A ③. 1 ④. 2H2O22H2O+O2↑ ⑤. AD
【解析】(1)需要量取一定量的液体时,应选取略大于所需液体体积的量筒。量取18.0mL 蒸馏水最好选用的量筒规格是25mL ,故选C;(2)燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;向烧杯中,加入适量的浓硫酸,由于浓硫酸溶于水放出大量热,使白磷的温度达到着火点,可能引燃铜片上的白磷;(3)因所用溶液中都有水,其中作为空白对照实验的是孔穴1(水);(4)①过氧化氢在二氧化锰的作用下分解生成水和氧气。反应的化学方程式为2H2O2 2H2O+O2↑;②实验中,为了得到平稳的气流,最适合的装置组合是AD,因用注射器可以控制液体的滴加速率,而控制反应速率。
19.【答案】(1)生铁为铁合金,铁与氧气和水共同接触时会生锈
(2)浓硫酸 (3) ①. 1.12g ②. 4% ③. 实验步骤二中,碳与氧化铁发生了反应
(4)1270:973##973:1270
【解析】【小问1详解】
生铁属于铁合金,铁与空气中的氧气与水蒸气共同作用时会生锈。
【小问2详解】
铁锈的主要成分为氧化铁,氧化铁能与氢气反应生成铁和水,则可根据生成的水的质量,求出生铁中氧化铁的含量,则装置A中为浓硫酸,浓硫酸具有吸水性,可干燥氢气。
【小问3详解】
使木炭充分反应,同时还可防止氧气过多的逸出,说明生成的水的质量为0.54g,设生铁样品中氧化铁的质量为x,则
解得x=1.6g,根据元素守恒,则生铁中已锈蚀的铁的质量是;
将黑色粉末加入过量稀盐酸中,铁能与盐酸反应生成氯化亚铁和氢气,氧化铁能与盐酸反应生成氯化铁和水,碳不与盐酸反应,则剩余的固体为碳单质,则碳单质的质量为0.28g,设铁的质量为y,由于产生氢气的质量为0.24g,则
解得y=6.72g,则生铁末锈蚀前的总质量为0.28g+6.72g=7g,则生铁粉末锈蚀前的含碳量是;
由于实验步骤二中,碳与氧化铁能发生反应,则氢气还原的氧化铁的质量偏少,则得出的已锈蚀的铁的质量可能存在误差。
【小问4详解】
滤液乙为盐酸和氯化亚铁,盐酸能与镁反应生成氯化镁和氢气,镁能与氯化亚铁反应生成氯化镁和铁,设生成的铁的质量为56,设与铁反应的镁的质量为x,氯化亚铁的质量为y,则
、
解得x=24g、y=127g,由于所得滤渣的质量与加入镁粉的质量相等,则与盐酸反应的镁的质量为56g-24g=32g,设盐酸的质量为z,则
解得z≈97.3g,则所取溶液中氯化亚铁与盐酸溶质的质量比是1270:973。
20.【答案】(1)Na;
(2)解:设生成氢氧化钠的质量为x,生成氯气的质量为y
x=4t
y=3.55t
电解后所得烧碱溶液的溶质质量分数为;
(3)解:设氢气和氯气反应生成氯化氢的质量为z
z=3.65t
制得溶质质量分数为36.5%浓盐酸的质量:3.65t÷36.5%=10t。
答:(2)电解后所得烧碱溶液的溶质质量分数为21.7%;
(3)制得溶质质量分数为36.5%浓盐酸的质量为10t。
【解析】(1)氢氧化钠中Na、O、H元素的质量比为:23:16:1,故钠元素的质量分数最大,故填:Na;
(2)见答案;
(3)见答案。
选项
物质(杂质)
选用试剂和操作
A.
氯化钾固体(二氧化锰)
溶解、过滤、洗涤、干燥
B.
氧化铜固体(炭粉)
加入足量的稀盐酸、过滤、洗涤、干燥
C.
氯化钠溶液(氯化钙)
加过量的碳酸钠溶液,过滤
D.
硝酸钠溶液(硫酸铜)
加适量的氢氧化钡溶液,过滤
海南省海口市海南师范大学附属中学2023-2024学年九年级下学期期中考试化学试题B卷: 这是一份海南省海口市海南师范大学附属中学2023-2024学年九年级下学期期中考试化学试题B卷,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
海南省海口市义龙中学2023-2024学年九年级下学期第3次月考化学试题A卷(解析版): 这是一份海南省海口市义龙中学2023-2024学年九年级下学期第3次月考化学试题A卷(解析版),共7页。试卷主要包含了听录音, 选择正确的选项,听录音, 选择正确的图片,听录音, 选择正确的答句,听录音, 圈出正确的信息,阅读理解等内容,欢迎下载使用。
海南省海口市城西中学2023-2024学年九年级上学期期中考试化学试题: 这是一份海南省海口市城西中学2023-2024学年九年级上学期期中考试化学试题,共4页。试卷主要包含了选择题,填空题,简答题,实验题,计算题等内容,欢迎下载使用。












