


湖北省武汉市六校联考2023-2024学年高一下学期4月期中考试化学试题
展开
这是一份湖北省武汉市六校联考2023-2024学年高一下学期4月期中考试化学试题,文件包含2023-2024学年湖北省武汉市六校联考高一下期中化学试卷原卷版docx、2023-2024学年湖北省武汉市六校联考高一下期中化学试卷解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
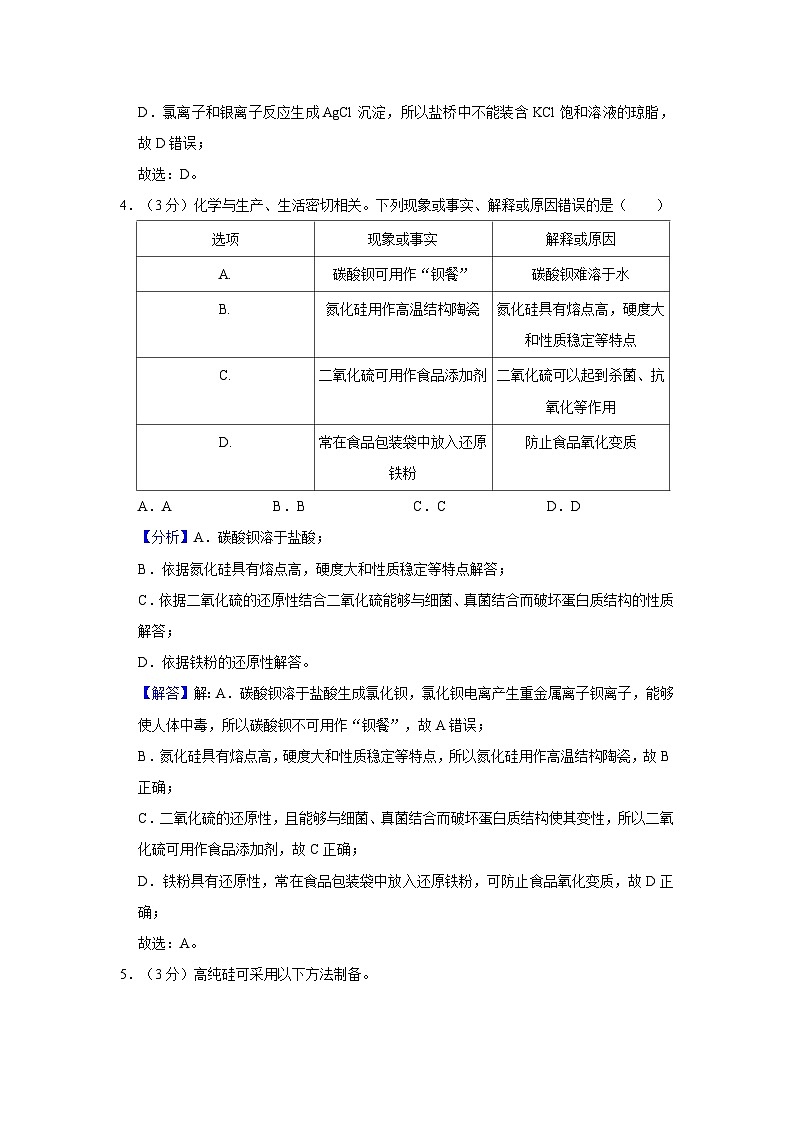
1.(3分)热量的释放或吸收是化学反应中能量变化的常见形式。下列化学变化为吸热反应的是( )
A.燃料燃烧B.酸碱中和
C.煅烧石灰石D.工业合成氨
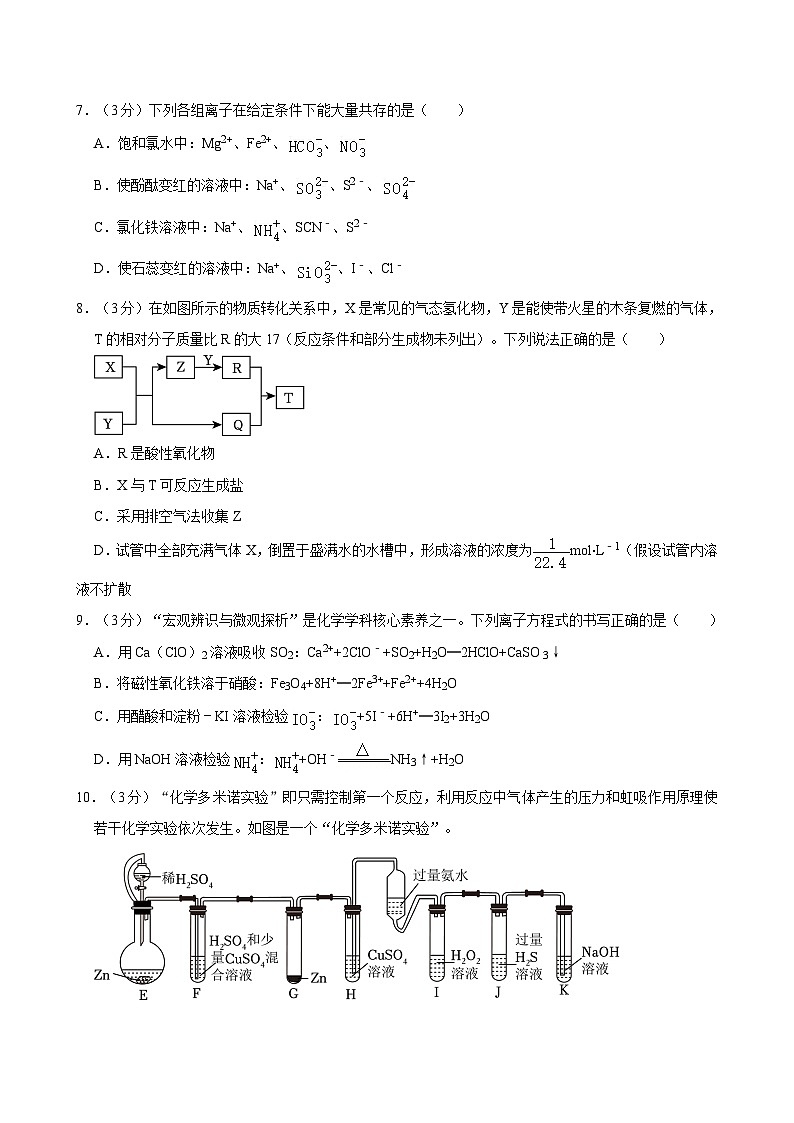
2.(3分)化学是一门以实验为基础的学科。利用下列装置和试剂进行实验,能达到实验目的的是( )
A.AB.BC.CD.D
3.(3分)根据2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计如图所示的原电池,下列说法错误的是( )
A.电极X的材料是Cu
B.Y为AgNO3溶液
C.每生成1mlAg,电路中转移1mle﹣
D.盐桥中可装有含KCl饱和溶液的琼脂
4.(3分)化学与生产、生活密切相关。下列现象或事实、解释或原因错误的是( )
A.AB.BC.CD.D
5.(3分)高纯硅可采用以下方法制备。
下列说法正确的是( )
A.石英砂是制陶瓷和水泥的主要原料之一
B.过程①的化学方程式为SiO2+CSi+CO2↑
C.通过SiO2SiCl4Si,实现粗硅的制备
D.过程④的化学方程式为SiHCl3+H2Si+3HCl
6.(3分)下列依据热化学方程式得出的结论正确的是( )
A.AB.BC.CD.D
7.(3分)下列各组离子在给定条件下能大量共存的是( )
A.饱和氯水中:Mg2+、Fe2+、、
B.使酚酞变红的溶液中:Na+、、S2﹣、
C.氯化铁溶液中:Na+、、SCN﹣、S2﹣
D.使石蕊变红的溶液中:Na+、、I﹣、Cl﹣
8.(3分)在如图所示的物质转化关系中,X是常见的气态氢化物,Y是能使带火星的木条复燃的气体,T的相对分子质量比R的大17(反应条件和部分生成物未列出)。下列说法正确的是( )
A.R是酸性氧化物
B.X与T可反应生成盐
C.采用排空气法收集Z
D.试管中全部充满气体X,倒置于盛满水的水槽中,形成溶液的浓度为ml⋅L﹣1(假设试管内溶液不扩散
9.(3分)“宏观辨识与微观探析”是化学学科核心素养之一。下列离子方程式的书写正确的是( )
A.用Ca(ClO)2溶液吸收SO2:Ca2++2ClO﹣+SO2+H2O═2HClO+CaSO3↓
B.将磁性氧化铁溶于硝酸:Fe3O4+8H+═2Fe3++Fe2++4H2O
C.用醋酸和淀粉﹣KI溶液检验:+5I﹣+6H+═3I2+3H2O
D.用NaOH溶液检验:+OH﹣NH3↑+H2O
10.(3分)“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理使若干化学实验依次发生。如图是一个“化学多米诺实验”。
已知:①Cu2++4NH3⋅H2O═4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2分解的催化剂)
②F和L中的硫酸溶液浓度相同
下列有关分析错误的是( )
A.进行实验前必须检查装置气密性
B.整套装置共发生3个氧化还原反应
C.装置J中出现浅黄色浑浊
D.装置K的作用是吸收尾气
11.(3分)已知:N2(g)+3F2(g)═2NF3(g) ΔH=﹣281kJ•ml﹣1。相关的键能数据如下表所示,则x的值为( )
A.340.3B.138C.153D.756
12.(3分)一种新型复合光催化剂(C3N4﹣CQDs)可利用太阳光实现水的高效分解,原理如图所示。水的分解、反应Ⅰ及反应Ⅱ的焓变依次为ΔH、ΔH1、ΔH2(以每生成2mlH2或1mlO2计算)。下列说法错误的是( )
A.反应Ⅰ的化学方程式为2H2OH2↑+H2O2
B.若ΔH2<0,则ΔH>ΔH1
C.该过程存在非极性键的断裂与形成
D.该过程涉及太阳能、热能及化学能之间的转化
13.(3分)我国科研人员以二硫化钼(MS2)作为电极催化剂,研发出一种Zn﹣NO电池系统,实现了合成氨和对外供电,其工作原理如图所示。已知双极膜可将水解离为H+和OH﹣,并实现其定向通过。下列说法正确的是( )
A.电子由Zn/ZnO电极流出
B.电池工作时NaOH和Na2SO4溶液浓度均不变
C.Zn/ZnO电极表面发生的反应为Zn﹣2e﹣═Zn2+
D.当电路通过2mle﹣时,整个电池系统增重6.0g
14.(3分)利用空气催化氧化法除电石渣浆上层清液中的S2﹣的过程如图所示。下列说法错误的是( )
A.过程Ⅰ中氧化剂与还原剂物质的量之比为1:2
B.过程Ⅱ的离子方程式为4+2S2﹣+9H2O═S2+4Mn(OH)2↓+10OH﹣
C.碱性条件下,氧化性强弱顺序为O2>>S3
D.将1mlS2﹣完全转化为理论上需要33.6LO2(标准状况下)
15.(3分)将38.4g Cu与0.22L浓硝酸混合恰好完全反应生成氮的氧化物,这些氧化物恰好与NaOH溶液反应得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示。
下列说法正确的是( )
A.反应Ⅰ中硝酸只体现氧化性
B.反应Ⅱ中NO作氧化剂
C.混合气体中N2O4的物质的量为0.2ml
D.浓硝酸的物质的量浓度为10ml•L﹣1
二、非选择题:本题共4题,共55分。
16.(14分)化学反应在发生物质变化的同时伴随有能量变化,是人类获取能量的重要途径。
回答下列问题:
(1)天然气的综合利用是各国科学家研究的重要课题。天然气燃烧过程中的能量变化,符合如图中的 (填标号)。
(2)液态肼(N2H4)与NO2可作火箭推进剂,二者反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═2NO2(g)ΔH1=+66kJ•ml﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)ΔH2=﹣534kJ•ml﹣1
N2H4(l)与NO2(g)反应的热化学方程式为 。此反应除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(3)用过硫酸钠结合紫外线(UV)辐照去除废水中尿素[CO(NH2)2](其中C为+4价,N为﹣3价),其机理如图1所示,尿素和过硫酸钠溶液发生的离子反应方程式为 。
(4)锌锰干电池是最早使用的化学电池,基本构造如图2所示。电路中每通过0.02mle﹣,负极质量减少 g,工作时在正极放电产生两种气体,其中一种气体分子是10e﹣的微粒,则正极的电极反应式是 。
(5)燃料电池具有广阔的发展前景。熔融碳酸盐乙醇(C2H5OH)燃料电池如图3所示。电极a上发生的电极反应式为 。
17.(14分)某化学小组利用HNO3氧化FeSO4时,发现溶液变深棕色。作出以下猜想:
猜想Ⅰ:生成的NO与Fe2+或Fe3+反应,使溶液变为深棕色;
猜想Ⅱ:生成的NO2与Fe2+或Fe3+反应,使溶液变为深棕色。
设计如图装置验证猜想。
回答下列问题:
(1)盛装浓硝酸的仪器名称是 。
(2)实验室保存浓硝酸的方法是 。
(3)实验开始前应先检查装置气密性,然后通N2的目的是 。
(4)为验证猜想Ⅰ,A同学关闭活塞 ,打开活塞 及分液分液漏斗活塞,观察到 (填实验现象),证明是NO与Fe2+反应。
(5)为验证猜想Ⅱ,B同学关闭活塞a,b,打开活塞c及分液分液漏斗活塞,出现与A同学相同的实验现象,B认为深棕色是NO2与Fe2+反应产生的,但A认为B的结论不严谨,理由是 。
(6)该实验装置存在的不足是 。
18.(13分)某废催化剂含SiO2、ZnO、ZnS和CuS,从废催化剂中回收锌和铜的流程如图所示。
回答下列问题:
(1)步骤①产生的气体的电子式为 ,实验室常用FeS与稀硫酸制备该气体,其化学方程式为 。
(2)滤渣2的主要成分是S和 (填化学式)。
(3)步骤③中加入H2O2溶液的目的是 (用离子方程式表示),加热温度不宜过高的原因是 。
(4)步骤②和④的“一系列操作”包括 、 、过滤、洗涤、低温干燥。洗涤晶体时用乙醇代替蒸馏水的目的是 ,并缩短干燥所需时间。
19.(14分)氮及其化合物既是重要的化工产品,又是重要的化工原料,它们在反应中常涉及能量变化。如图为合成氨以及氨氧化制硝酸的流程示意图。
回答下列问题:
(1)液氨可作制冷剂的原因是 。
(2)氧化炉中NH3被氧化的化学方程式为 。
(3)向吸收塔中通入A的作用是 。
(4)汽车发动机工作时会引发N2和O2反应,生成的NOx等造成大气污染,其中生成NO的能量变化如图所示,则N2(g)+O2(g)═2NO(g)的ΔH= 。
N2(g)和O2(g)反应生成NO(g)过程中的能量变化
(5)NH3催化还原氮氧化物技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产的尾气处理,反应原理如图所示。
若反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为 。
(6)利用NO2与NH3反应构成如图所示的电池,也可用于上述硝酸生产的尾气处理。
①B的电极反应式为 。
②当有4.8mlOH﹣通过阴离子交换膜时,理论上生成N2的物质的量为 。
A.验证SO2的漂白性
B.测定中和反应的反应热
C.实验室制氨气
D.比较Cl、C、Si的非金属性
选项
现象或事实
解释或原因
A.
碳酸钡可用作“钡餐”
碳酸钡难溶于水
B.
氮化硅用作高温结构陶瓷
氮化硅具有熔点高,硬度大和性质稳定等特点
C.
二氧化硫可用作食品添加剂
二氧化硫可以起到杀菌、抗氧化等作用
D.
常在食品包装袋中放入还原铁粉
防止食品氧化变质
选项
热化学方程式
结论
A.
P4(s,白磷)═4P(s,黑磷)ΔH=﹣157.2kJ•ml﹣1
黑磷更稳定
B.
CaO(s)+H2O(l)═Ca(OH)2(aq)ΔH<0
反应放热可设计成原电池
C.
H+(aq)+OH﹣(aq)═H2O(l)ΔH=﹣57.3kJ•ml﹣1
稀硫酸与氢氧化钠固体反应生成1ml水时放出57.3kJ热量
D.
C(s)+(g)═CO(g)ΔH=﹣110.5kJ•ml﹣1
碳的燃烧热为110.5kJ•ml﹣1
化学键
N≡N
F﹣F
N﹣F
键能/kJ•ml﹣1
940
x
280
相关试卷
这是一份广东省珠海市六校联考2023-2024学年高一下学期4月期中考试化学试题(含解析),文件包含2023-2024学年第二学期高一年级期中学业质量监测试题化学docx、2023-2024学年第二学期高一年级期中学业质量监测试题化学参考答案docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份河北省保定市六校联考2023-2024学年高一下学期4月期中考试化学试题,共6页。
这是一份湖北省襄阳市鄂北六校2023-2024学年高一下学期4月期中联考化学试题,共9页。








