

2024年高考押题预测卷—化学(福建卷01)(考试版)
展开
这是一份2024年高考押题预测卷—化学(福建卷01)(考试版),共10页。试卷主要包含了设为阿伏加德罗常数的值,某铜配合物的结构如下图所示等内容,欢迎下载使用。
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 Si—28 S—32 Cl—35.5 K—39 Mn—55 Fe—56 Cu—64 Zn—65 Br-80 Ag—108 Ba—137
1.2024年央视春晚首次应用5G-A技术,Al含量高,硬科技霸屏,下列有关说法错误的是
A.舞蹈《瓷影》所诠释的青花瓷,其主要原材料为含水的铝硅酸盐
B.晚会采用的LED屏,其发光材料通常是以Si3N4为基础,用Al取代部分Si,用O取代部分N后所得的陶瓷制作而成
C.5G-A技术所需高频通讯材料之一的LCP(液晶高分子)在一定加热状态下一般会变成液晶,液晶既具有液体的流动性,又表现出类似晶体的各向异性
D.芯片中二氧化硅优异的半导体性能。使得晚会上各种AI技术得以完美体现
2.下列化学用语或图示表达正确的是
A.CO2的电子式为:B.基态锗原子的简化电子排布式:
C.的空间结构为D.铝原子最高能级的电子云轮廓图:
3.阿斯巴甜是市场上主流甜味剂之一,以下是以天门冬氨酸为原料合成阿斯巴甜的路线。
下列说法不正确的是
A.天门冬氨酸难溶于乙醇、乙醚
B.①④的目的是为了保护氨基
C.反应过程中包含了取代反应、消去反应
D.相同物质的量的阿斯巴甜分别与盐酸和氢氧化钠充分反应,消耗HCl与NaOH的物质的量之比为2∶3
4.设为阿伏加德罗常数的值。下列说法正确的是
A.电解精炼铜时,若阴极析出3.2g铜,则阳极失电子数大于
B.90g葡萄糖分子中,手性碳原子个数为
C.氯碱工业两极共收集到标准状况下2.24L气体时理论上迁移的数为
D.标准状况下5.6L C4H10中含有的键数为
5.某铜(Ⅱ)配合物的结构如下图所示。其中元素X和Y均位于第二周期,X的第一电离能低于同周期相邻元素,Y元素基态原子p轨道电子排布是半充满状态,Z元素基态原子核外电子共有9种空间运动状态。下列说法正确的是
A.最简单氢化物的键角:
B.基态原子的未成对电子数:
C.X、Y、Z的最简单氢化物均存在分子间氢键
D.该配合物中微粒间的相互作用有离子键、共价键和配位键
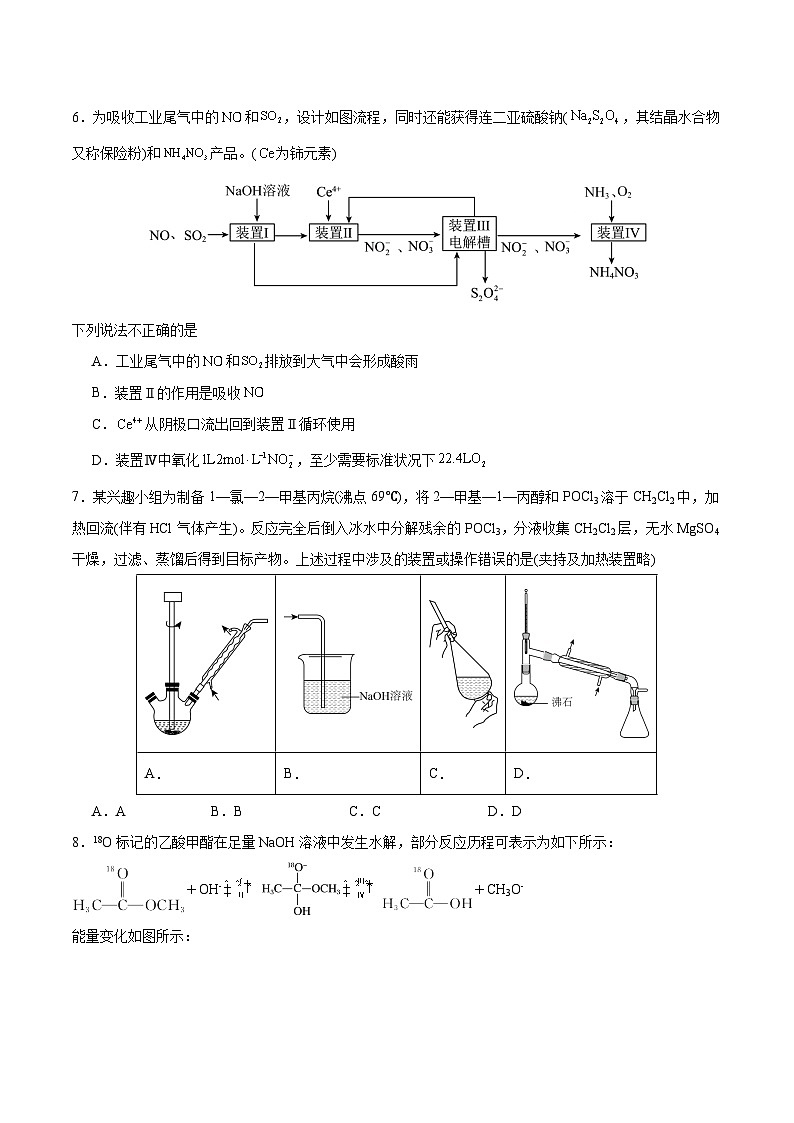
6.为吸收工业尾气中的和,设计如图流程,同时还能获得连二亚硫酸钠(,其结晶水合物又称保险粉)和产品。(为铈元素)
下列说法不正确的是
A.工业尾气中的和排放到大气中会形成酸雨
B.装置Ⅱ的作用是吸收
C.从阴极口流出回到装置Ⅱ循环使用
D.装置Ⅳ中氧化,至少需要标准状况下
7.某兴趣小组为制备1—氯—2—甲基丙烷(沸点69℃),将2—甲基—1—丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)
A.AB.BC.CD.D
8.18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为如下所示:
+OH-+CH3O-
能量变化如图所示:
已知为快速平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
9.水系铵根离子可充电电池具有成本低、安全、无污染等优点,该电池以(含、、元素)为正极材料,电解质溶液中主要存在团簇离子。其放电工作原理如图所示。下列说法错误的是
A.放电时,向Y极方向移动
B.放电时,Y极的电极反应式为
C.与间通过离子键结合
D.充电时,增加了1ml时,X极质量增加46g
10.菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同下体系中与关系如图所示(代表),已知。下列有关说法正确的是
A.数量级为
B.溶液时,
C.时,曲线①呈上升趋势的原因是部分转化为
D.点时,体系中
11.(15分)利用炼锌钴渣[主要含C(OH)2、FeSO4、NiSO4和Zn、Cu单质]协同制备C(OH)3和高纯Zn的流程如下。
(1)“酸浸”过程C(OH)2发生反应的离子方程式为 。
(2)“沉铁”过程CaCO3的作用有 。
(3)“沉镍”过程pH对溶液中C(Ⅱ)、Ni(Ⅱ)含量的影响如图。
①由图判断,应调节pH= 。
②该过程C可能发生的反应如下:
C2++6NH3·H2O=[C(NH3)6]2++6H2O K1=105
C2++2NH3·H2O=C(OH)2↓+2 K2
则K2= ,[C(NH3)6]2+为 (填“热力学”或“动力学”)产物。
(已知:25℃时,Kb(NH3·H2O)=10-4.8,Ksp[C(OH)2]=10-15)
(4)“沉钴”过程生成C(OH)3的离子方程式为 。
(5)一种以Zn和V2O5为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下图一所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。
①基态V原子的价电子中,两种自旋状态的电子数之比为 。
②上述电池充电时阳极的电极反应式为 。
③金属Zn的晶胞如图二,密度为ρg/cm3,则晶胞空间占有率为 。
12.(15分)氮氧化物是大气的主要污染物,为防治环境污染,科研人员做了大量研究。
I.汽油燃油车上安装三元催化转化器,可以使和两种尾气反应生成,可有效降低汽车尾气污染,反应为。
(1)下表中数据是该反应中的相关物质的标准摩尔生成焓()(标准摩尔生成焓是指在、条件下,由稳定态单质生成化合物时的焓变)数据。
则 。
(2)将和按物质的量之比以一定的流速分别通过两种催化剂(和)进行反应,相同时间内测定逸出气体中的含量,从而确定尾气脱氮率(的转化率),结果如图所示。
①下脱氮率较高的催化剂是 (填“”或“”)。
②催化剂催化条件下,后,脱氮率随温度升高而下降的原因是 。
Ⅱ.一定条件下与可发生反应:。
(3)将与按物质的量之比置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
A.体系压强保持不变B.与的物质的量之比保持不变
C.D.
(4)将一定量的与置于密闭容器中发生反应,在相同时间内测得的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。的平衡转化率与压强、温度及氮硫比的关系如图2所示。
①由图1可知,温度过高或过低均不利于该反应的进行,原因是 。
②图2中压强: (填“>”“
相关试卷
这是一份2023年高考押题预测卷01(浙江卷)-化学(考试版),共12页。
这是一份2023年高考押题预测卷01(浙江卷)-化学(考试版),共12页。
这是一份2022年高考押题预测卷01(天津卷)-化学(考试版),共5页。








