

2024年高考押题预测卷—化学(江苏卷01)(考试版)
展开(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 V-51
1.传统燃油汽车正在向电动化、智能化、网联化方向转型,下列说法不正确的是( )
A.电动汽车使用的磷酸铁锂电池属于二次电池
B.汽车中使用的橡胶、塑料属于有机高分子材料
C.车用芯片是以二氧化硅做半导体材料制成的
D.燃油汽车排气管装催化转化器可以减少NOx排放
2.OF2能在干燥空气中迅速发生反应:O2+4N2+6OF2=4NF3+4NO2。下列表示反应中相关微粒的化学用语错误的是( )
A.中子数为10的氧原子:O B.氮原子的结构示意图:
C.OF2的结构式:F—O—F D.NF3的电子式:
3.实验室从碘的四氯化碳溶液中分离并得到单质碘,主要步骤为:用浓NaOH溶液进行反萃取(3I2+6OH-=5I-+IO3-+3H2O)、分液、酸化(5I-+ IO3-+6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )
A.用装置甲反萃取时,倒转振荡过程中要适时旋开活塞放气
B.用装置乙分液时,先放出有机相,关闭活塞,从上口倒出水相
C.用装置丙从酸化后的体系中分离出单质碘
D.用装置丁干燥单质碘
4.工业上利用反应KCl(l)+Na(l)NaCl(l)+K(g)制备K,下列说法不正确的是( )
A.沸点:Na<KB.离子半径:r(K+)<r(Cl-)
C.碱性:NaOH<KOHD.第一电离能:I1(Na)<I1(Cl)
阅读下列材料,完成5~7题:
氮的常见氢化物有氨(NH3)和肼(N2H4)。Mg3N2与水反应可产生NH3,液氨发生微弱电离产生NH2-,液氨能与碱金属(如Na、K)反应产生H2。NH3中一个H被-NH2取代可得N2H4,常温下N2H4为液体,具有很高的燃烧热(622.1 kJ·ml-1)。以硫酸为电解质,通过催化电解可将N2转化为N2H4;碱性条件下,NaClO氧化NH3也可制备N2H4。
5.下列有关氮及其化合物的说法正确的是( )
A.N2中σ键与π键的数目比例为1∶1
B.液氨电离可表示为:2NH3NH4++NH2-
C.N2H4的结构式为
D.Mg3N2中存在Mg与N2之间的强烈相互作用
6.下列化学反应表示正确的是( )
A.肼在氧气中燃烧:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH =622.1 kJ·ml-1
B.液氨与钠反应:2Na+2NH3=2NaNH2+H2↑
C.NaClO氧化NH3制备N2H4:4NH3+ClO-+2OH-=2N2H4+Cl-+3H2O
D.电解法制备N2H4的阴极反应:N2+4H+-4e- =N2H4
7.下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A.NH3分子间存在氢键,NH3极易溶于水
B.液氨汽化时吸收大量的热,可用作制冷剂
C.N2H4中N原子能与H+形成配位键,N2H4的水溶液呈碱性
D.N2H4具有还原性,可用作燃料电池的燃料
8.在指定条件下,下列选项所示的物质间转化能实现的是( )
A.
B.
C.
D.
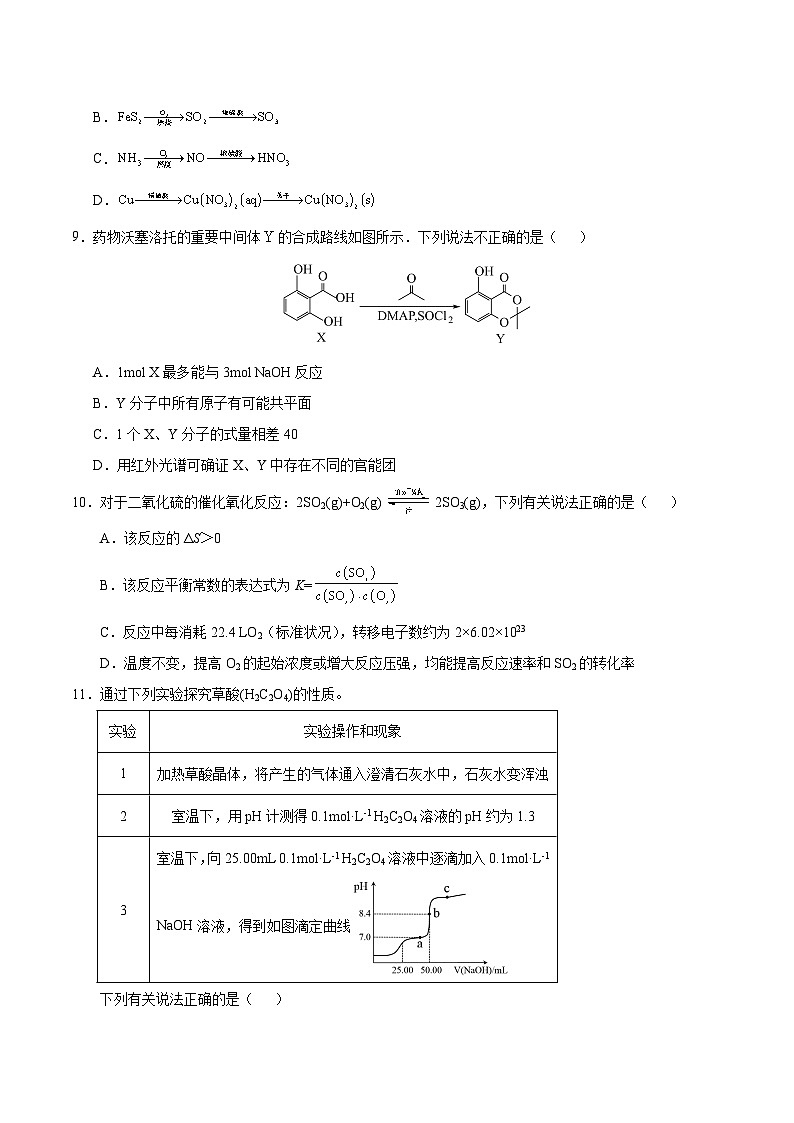
9.药物沃塞洛托的重要中间体的合成路线如图所示.下列说法不正确的是( )
A.1ml X最多能与3ml NaOH反应
B.Y分子中所有原子有可能共平面
C.1个X、Y分子的式量相差40
D.用红外光谱可确证X、Y中存在不同的官能团
10.对于二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g),下列有关说法正确的是( )
A.该反应的ΔS>0
B.该反应平衡常数的表达式为K=
C.反应中每消耗22.4 LO2(标准状况),转移电子数约为2×6.02×1023
D.温度不变,提高O2的起始浓度或增大反应压强,均能提高反应速率和SO2的转化率
11.通过下列实验探究草酸(H2C2O4)的性质。
下列有关说法正确的是( )
A.依据实验1的现象,无法确定气体的成分
B.0.1 ml·L-1 H2C2O4溶液中存在c(H+)=2c(C2O42-)+c(HC2O4-)
C.a、b、c对应的溶液中,水的电离程度:c>b>a
D.V(NaOH)=25.00mL时的溶液中:c(C2O42-)<c(H2C2O4)
12.室温下,通过矿物中的PbSO4获得Pb(NO3)2的过程如下:
已知:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14。下列说法正确的是( )
A.Na2CO3溶液中:c(OH-)<c(H+)+c(HCO3-)+ c(H2CO3)
B.反应PbSO4+CO32-PbCO3+SO42-正向进行,需满足
C.“脱硫”后上层清液中:2c(SO42-)+c(OH-)=c(Na+)+c(H+)
D.PbCO3悬浊液加入HNO3“溶解”过程中,溶液中CO32-浓度逐渐减小
13.二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH1>0
反应Ⅱ CH3OH(g) +H2O(g)=CO2(g)+3H2(g) ΔH2>0
反应Ⅲ CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的CH3OCH3实际转化率、CO2实际选择性与CO2平衡选择性随温度的变化如图所示.CO2的选择性.下列说法不正确的是( )
A.曲线a表示CH3OCH3实际转化率随温度的变化
B.200℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C.适当增加,有利于提高H2产率
D.一定温度下,若增大压强,CO的平衡产量不变
14.(15分)V2O5广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
“还原”步骤中生成N2,反应的化学方程式为 ;若不加N2H4,HCl也能还原V2O5生成VO2+和Cl2,分析反应中不生成Cl2的原因: 。
(2)对制得的晶体进行含钒量的测定:称取4.000g样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为100mL溶液;量取20.00mL溶液,加入几滴指示剂,用0.2000ml·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,滴定过程中反应为VO2++Fe2++2H+=VO2++Fe3++H2O;平行滴定4次,消耗标准溶液的体积分别为22.50mL、22.45mL、21.00mL、22.55mL,则样品中钒元素的质量分数为 (写出计算过程,结果保留两位小数)。
(3)750℃时,将氧钒碱式碳酸铵晶体与NH3反应制备共价晶体VN,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是 。
(4)V2O5可溶于强酸强碱,不同pH、不同钒元素浓度时,+5价V存在形态如题图所示:
①将0.01ml V2O5溶解在200mL烧碱溶液中,剩余溶液的c(OH-)=0.01ml·L-1,反应的离子方程式为 。
②V2O74-具有对称结构,其结构式可表示为 。
15.(15分)有机化合物H是一种用于治疗心血管疾病的常用药物,其合成路线如下:
(1)A中官能团的名称为 。
(2)C的结构简式为 。
(3)E是一种含有5个碳原子的环酯,则D+E→F的化学方程式为 。
(4)C+G→H的反应类型为 。
(5)C的一种同分异构体同时满足下列条件,写出该同分异构体的一种结构简式:___。
①分子中有三键;②核磁共振氢谱中有三组峰,峰面积之比为6:2:1;③能与FeCl3溶液发生显色反应。
(6)已知硝基苯能被Fe在盐酸作用下还原为苯胺:。设计以苯和为原料制备的合成路线(其他无机试剂和有机溶剂任用,合成路线示例见本题干)。 。
16.(15分)硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。工业上用软锰矿(主要成分为MnO2,含铁、铝的化合物等杂质)制得硫酸锰的流程如下:
(1)“酸浸”时SO2与MnO2反应的化学方程式为: 。此过程中,如果SO2废气中混有空气,有副反应发生,部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2,原因是 (用平衡移动原理结合化学方程式解释),欲消除生成的硫酸,试剂A最好是 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(2)SO2气体中混有空气,实验测得酸浸液中Mn2+、SO42-的浓度随反应时间t变化如下图,产生该现象的原因是 。
(3)浸出液中阳离子主要有Mn2+、Fe2+、Al3+等。氧化后加入NaOH溶液调节pH的目的是 ;溶液的pH不能超过6的原因是 。
(4)硫酸锰的溶解度曲线如下图所示,请设计由滤液制备MnSO4·H2O晶体的实验方案: 。
(实验中须用到的试剂: 80~90℃的蒸馏水:除常用仪器外须使用的仪器:真空干燥箱。)
17.(16分)氮氧化物会严重污染空气,汽车尾气及一些工业生产的烟气中都含有氮氧化物,工业上常用催化转化法、氨还原法、氧化剂氧化法进行处理。回答下列问题:
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:N2(g)+O2(g)2NO(g) △H1=+180.0kJ·ml-1 ①
CO(g)+O2(g)CO2(g) △H2=-283.5kJ·ml-1 ②
则反应2CO(g)+2NO(g)N2(g)+2CO2(g) △H= 。
(2)在2L的密闭容器中充入1ml NO2和2ml CO,发生下述反应:4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0
下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的 点。
(3)利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,其反应历程如下图所示。图中生成X的中间反应的离子方程式为 ,历程图中总反应的化学方程式为 。
(4)在酸性条件下,用NaClO2作氧化剂可将NO氧化为NO3-,并放出热量。
①该反应的离子方程式为 。
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++ClO2-=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。
图1 图2
起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是 。以NaClO2溶液为吸收剂,NO的氧化率随温度的变化情况,如图2所示。温度超过60℃后,NO氧化率下降,试解释其原因: 。
评卷人
得分
一、选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题目要求的。
实验
实验操作和现象
1
加热草酸晶体,将产生的气体通入澄清石灰水中,石灰水变浑浊
2
室温下,用pH计测得0.1ml·L-1 H2C2O4溶液的pH约为1.3
3
室温下,向25.00mL 0.1ml·L-1 H2C2O4溶液中逐滴加入0.1ml·L-1 NaOH溶液,得到如图滴定曲线
评卷人
得分
二、非选择题:本题共4小题,共61分。
2023年高考押题预测卷01(浙江卷)-化学(考试版): 这是一份2023年高考押题预测卷01(浙江卷)-化学(考试版),共12页。
2023年高考押题预测卷01(浙江卷)-化学(考试版): 这是一份2023年高考押题预测卷01(浙江卷)-化学(考试版),共12页。
2023年高考押题预测卷01(江苏卷)-化学(考试版)A4: 这是一份2023年高考押题预测卷01(江苏卷)-化学(考试版)A4,共9页。












