

所属成套资源:2024年高考押题预测卷:上海卷
2024年高考押题预测卷—化学(上海卷03)(考试版)
展开
这是一份2024年高考押题预测卷—化学(上海卷03)(考试版),共7页。
化 学
(考试时间:60分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、中国前沿科技巡礼(20分)
1.科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
其中“刻蚀”过程可能用到刻蚀剂HF、NH4BF4及清洗剂CH3CH(OH)CH3。
基态F原子核外电子有 种空间运动状态.
②下列为氟原子激发态的电子排布式的是________(填标号)。
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p5 D.1s22s22p33p2
③C、N、O、F四种元素的第一电离能由大到小的顺序为 。
④氟硼酸铵(NH4BF4)中B的杂化方式为 ,BF4-的空间构型为 。
(2)复兴号高铁车体材质用到了Mn、C等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是 (填元素符号),Mn原子的配位数为 ,CH3CN中σ键与π键数目之比为 。
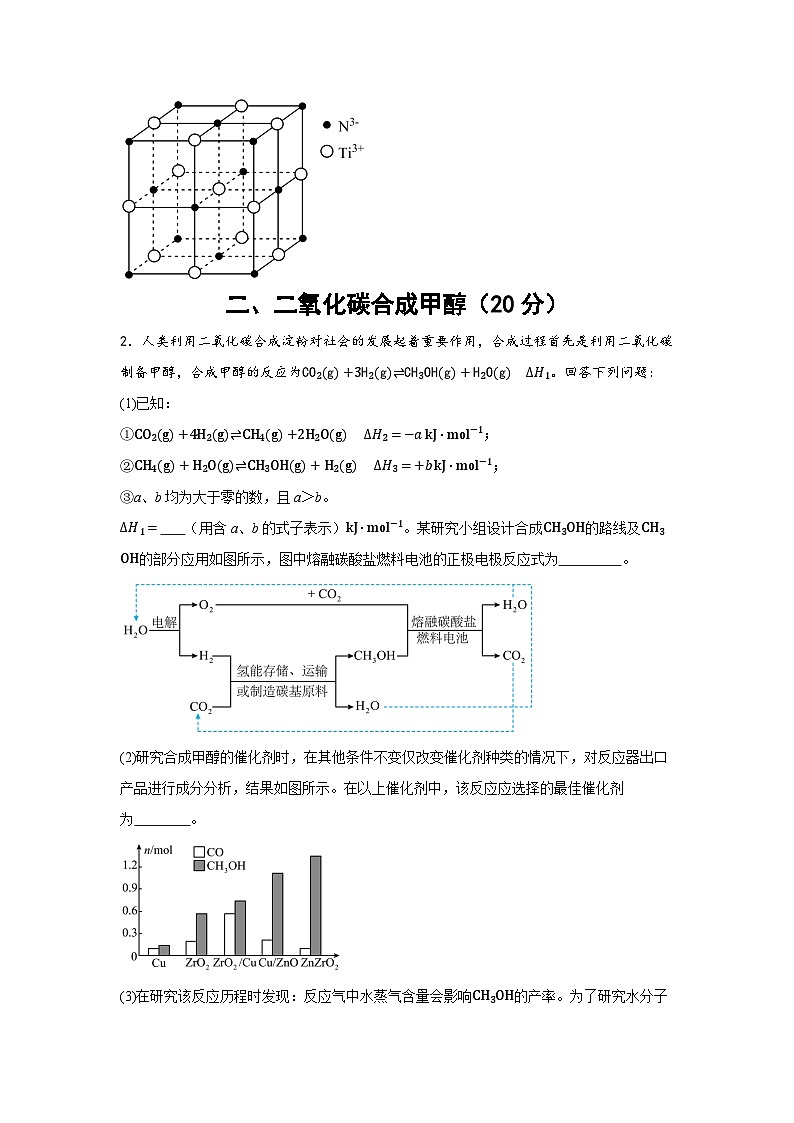
(3)超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 (列出计算式即可)g⋅cm-3。
二、二氧化碳合成甲醇(20分)
2.人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为CO2g+3H2g⇌CH3OHg+H2Og ΔH1。回答下列问题:
(1)已知:
①CO2g+4H2g⇌CH4g+2H2Og ΔH2=−a kJ⋅ml−1;
②CH4g+H2Og⇌CH3OHg+H2g ΔH3=+b kJ⋅ml−1;
③a、b均为大于零的数,且a>b。
ΔH1= (用含a、b的式子表示)kJ⋅ml−1。某研究小组设计合成CH3OH的路线及CH3OH的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为 。
(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应应选择的最佳催化剂为 。
(3)在研究该反应历程时发现:反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
①依反应历程图所示,写出有水参与时反应的化学方程式: 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是 。
(4)在T℃时,将6ml CO2(g)和12ml H2(g)充入容积为10L的恒容容器中,只发生CO2g+3H2 g⇌CH3OHg+H2Og,初始压强为p0 kPa,测得体系中剩余H2(g)的物质的量随时间变化如图中状态Ⅰ所示。
①T℃时,0~1min内甲醇的反应速率vCH3OH= ml⋅L−1⋅min−1,该反应的平衡常数Kp= kPa−2。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得nH2随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是 。
(5)一种可吸附甲醇的材料,其化学式为CNH234BOCH343Cl,部分晶体结构如图所示,其中CNH23+为平面结构。
下列说法错误的是
A.该晶体中存在N−H⋯O氢键
B.CNH23+中C原子为sp2杂化
C.基态原子的未成对电子数:N>C=O>B
D.基态原子的第一电离能:O>N>C>B
三.实验室合成亚硫酸亚铜铵(20分)
3.NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
实验步骤:i.实验开始时,首先向三颈烧瓶中逐滴加入浓氨水直至得到深蓝色溶液;
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为 。
(2)装置C的目的是 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是SO32-;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是HSO3-;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1ml·L-1的 溶液(填化学式,下同)和0.1ml·L-1 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中NH4+的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用·L-1H2SO4溶液全部吸收,用0.0900ml·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是 %(结果保留三位有效数字)。
(7)下列操作使测得的NH4CuSO3质量分数偏大的为 (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
四.新型锂离子电池有机电解质的合成(22分)
4.温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。
(1)化合物E的分子式为 ,它的芳香同分异构体中,核磁共振氢谱为四组峰,峰面积比为3:2:2:1的结构简式为 (写一种)。
(2)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(3)A与x反应生成B,该反应的原子利用率为100%,x为 。
(4)C到D反应的化学方程式为 。
(5)下列有关说法正确的有_______。
A.F到G的反应过程中,有C=C双键的断裂和C-O键的形成
B.G到H的反应过程中,有C=O双键和C-O键的形成
C.化合物E中的碳原子只有sp和sp2两种杂化方式,且不存在手性碳原子
D.CO2属于非极性分子,其分子空间结构为直线型
(6) I中的手性碳原子有________种。
(7)选用A的同系物和x为原料,参考上述信息,制备和。写出该合成路线 (无机试剂任选)。
五、工业上提取锌(18分)
5.研究从含锌资源中获取Zn的途径具有重要意义。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、Fe2O3、FeO、PbO、Al2O3、CaO、SiO2等。
已知:
ⅰ.几种难溶电解质的Ksp
ⅱ.浸出液中主要金属正离子浓度
(1)浸出渣的主要成分有PbSO4、CaSO4和SiO2。PbO和H2SO4反应的离子方程式是 。
(2)加入试剂a的目的是 。
(3)电解前,含Zn2+溶液中铁和铝的离子浓度均需小于10−6 ml⋅L−1,应调节pH的范围是(忽略①和②导致的体积变化) 。
A.3.0~4.0 B.4.0~5.0 C .5.0~6.0 D.6.0~7.0
Ⅱ.实验室中氨浸提锌
已知:
ⅲ.ZnNH342+⇌Zn2++4NH3 K=10−9.5
ⅳ.M的结构简式如图所示,R为−C9H19,两个羟基中、酚羟基酸性较强。
(4)NH3和NH42SO4浸取ZnO发生反应的离子方程式是 。
(5)M能与Zn2+形成稳定的配合物X,相关反应为2M+Zn2+⇌2H++X。
①补全图中X的结构并用“…”标出氢键 。
②X中形成氢键有利于Zn2+的萃取,原因可能是 。
(6)从平衡移动的角度解释CO2能提高有机溶液中X含量的原因: 。序号
反应试剂、条件
反应形成的新结构
反应类型
a
H2、催化剂/Δ
−CH=CH−或−CH2−CH2−
加成反应
b
氧化反应(生成有机产物)
难溶电解质
FeOH2
FeOH3
AlOH3
ZnOH2
Ksp
4.9×10−17
2.8×10−39
1.0×10−33
3.0×10−17
粒子
Zn2+
Fe2+和Fe
Al
浓度(ml/L)
0.3
0.1
0.1
相关试卷
这是一份2024年高考押题预测卷—化学(上海卷03)(全解全析),共14页。
这是一份2023年高考押题预测卷03(浙江卷)-化学(考试版),共12页。
这是一份2023年高考押题预测卷03(上海卷)-化学(全解全析),共21页。









