






氮及其化合物-高考化学二轮复习课件
展开
这是一份氮及其化合物-高考化学二轮复习课件,共34页。PPT课件主要包含了要点导引·定锚点,教材研析·固基础,氮气与氮的固定,氨和铵盐,4实验室制法,硝酸的工业制法,酸雨及防治,实战演练·微知著,00%等内容,欢迎下载使用。
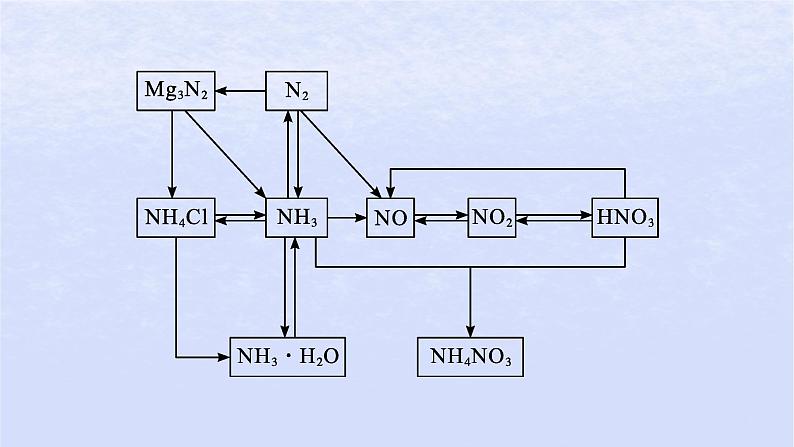
1.N元素位置与N2分子结构N元素位于元素周期表第二周期、第ⅤA族。N原子最外电子层有5个电子,既不容易得到3个电子,也不容易失去5个电子。N2的电子式为∶N︙︙N∶,结构式为N≡N。2.氮气的物理性质熔点、沸点低,密度为1.25 g·L-1(标准状况)。
4.氮元素的存在与氮的固定(1)氮元素的存在。①游离态:空气中的N2(体积分数约占78%)。②化合态:动植物体内的蛋白质、土壤和海洋里的硝酸盐和铵盐。(2)氮的固定:将大气中游离态的氮转化为氮的化合物的过程。
二、一氧化氮和二氧化氮
1.氨(1)物理性质。无色、有刺激性气味的气体,密度比空气的小;易液化;极易溶于水(常温常压下,约为1∶700)。(2)化学性质。
(氨水显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝)②与酸反应:NH3+HCl══NH4Cl(浓氨水、浓盐酸靠近时产生白烟)。
(3)主要用途。①液氨常用作制冷剂。②工业上作为制取纯碱、铵盐、硝酸的原料。
2.铵盐(1)物理性质与用途。铵盐属于离子化合物,绝大多数易溶于水。铵盐在农业上常用作化肥。(2)化学性质。
1.物理性质无色、易挥发、有刺激性气味的液体。2.化学性质
(1)浓硝酸的不稳定性:4HNO3
4NO2↑+O2↑+2H2O。
(2)强氧化性。①常温下,浓硝酸使铁、铝发生钝化。②与金属反应:Cu+4HNO3(浓) ══Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀) ══3Cu(NO3)2+2NO↑+4H2O一般情况下,浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO。
(3)一氧化氮的氧化:2NO+O2══2NO2。(4)用水吸收二氧化氮生成硝酸:3NO2+H2O══2HNO3+NO(NO循环使用)。
1.酸雨pH小于5.6的雨水。2.成因二氧化硫、氮氧化物以及它们在大气中发生反应后的生成物溶于雨水会形成酸雨。3.危害(1)直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化。(2)加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀。
4.防治(1)发展清洁能源。(2)对含硫燃料进行脱硫处理。(3)加强工厂废气的回收处理。(4)改进汽车尾气处理技术。
1.下列关于氮及其化合物的叙述正确的是( )A.NH3催化氧化生成NO实现了人工固氮B.N2与H2反应合成氨,反应中N2作氧化剂C.实验室用硝酸铵与氢氧化钙加热反应制取氨气D.打开浓硝酸的试剂瓶,瓶口出现白烟
【解析】固氮是指将游离态的氮转化为氮的化合物,NH3催化氧化生成NO不属于人工固氮;硝酸铵加热本身要发生氧化还原反应,实验室用氯化铵与氢氧化钙加热反应制取氨气;浓硝酸易挥发,打开浓硝酸的试剂瓶,瓶口出现酸雾。故选B。【答案】B
【解析】反应2NO+O2══2NO2中,N元素化合价升高,NO作还原剂。 故选B。【答案】B
3.下列装置用于进行指定实验时,能达到实验目的的是( )
A.用装置甲制备氨B.用装置乙除去氨中的少量水C.用装置丙收集氨D.用装置丁吸收多余的氨
【解析】甲装置错误,加热固体的试管口应略向下倾斜,A不正确;装置乙中的NH3能与浓硫酸反应,B不正确;装置丙烧瓶有塞子,空气无法排出,C不正确;氨在水中的溶解度很大,被水吸收时容易发生倒吸,装置丁可以防止倒吸,D正确。故选D。【答案】D
下列说法不正确的是( )A.氮氧化物会造成酸雨等污染B.①是利用Na2CO3的碱性和氧化性消除NO2C.②③的目的是将化合态的氮元素转化为N2D.②③使用催化剂,能加快消除氮氧化物的速率
【解析】反应①中,Na2CO3中的元素在反应前后无化合价变化,反应①只利用了Na2CO3的碱性。故选B。【答案】B
5.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,且无气体剩余,则甲气体的组成为( )
A.NO2、N2 B.NO、CO2C.NO2、CO2D.NO、CO2、N2
【解析】NO2是红棕色的气体,所以无色混合气体甲中一定不存在NO2,CO2可以与过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2══2Na2CO3+O2,NO是一种无色气体,与氧气反应立即变为红棕色的NO2,通过足量的过氧化钠后,气体显红棕色,说明无色混合气体甲中有NO、CO2,用排水法收集气体,广口瓶被上升的水注满,说明没有N2,所以甲气体的组成为NO、CO2,故答案选B。【答案】B
6.(2021年7月浙江学考第30题)取30.0 g牛奶样品,将所含蛋白质中的氮元素全部转化为氨,用25.00 mL 1.00 ml·L-1硫酸将其完全吸收,再加入19.00 mL 2.00 ml·L-1氢氧化钠溶液恰好生成硫酸钠和硫酸铵。请计算:(1)所用NaOH的物质的量为_______________ ml。 (2)样品中蛋白质转化生成的氨的物质的量为_______________ ml。 (3)若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为_______________。
7.氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)氢氧化钠溶液可以吸收废气中的氮氧化物:①NO2+NO+2NaOH══2NaNO2+H2O ②2NO2+2NaOH══NaNO2+NaNO3+H2O
相关课件
这是一份2023届高三化学二轮复习 ——氮及其化合物 课件,共29页。PPT课件主要包含了氮及其化合物,学习目标,氮的存在,氮的固定,由低价到高价,氮的转化纵向转化,氧化还原基本原则,纵向转化,现象为有白烟,硝酸的化学性质等内容,欢迎下载使用。
这是一份人教版新高考化学一轮复习课件--氮及其化合物,共60页。PPT课件主要包含了课标要求,备考指导,内容索引,知识筛查1氮的固定,2化学性质,整合建构,学科思想方法,典题训练,新情境模拟训练等内容,欢迎下载使用。
这是一份人教版高考化学总复习氮及其重要化合物完美课件PPT,共60页。PPT课件主要包含了红棕色,HNO3+NO,碱石灰,湿润的红色石蕊,易挥发,与水以任意比互溶,质量分数在,%以上的硝酸,本部分内容讲解结束等内容,欢迎下载使用。








