





所属成套资源:2025版新教材高中化学新人教版选择性必修1课件(46份)
- 2025版新教材高中化学第2章化学反应速率与化学平衡微专题3化学反应速率与平衡图像课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第2章化学反应速率与化学平衡研究与实践2了解汽车尾气的治理课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第1节电离平衡第2课时电离平衡常数强酸与弱酸的比较课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第2节水的电离和溶液的pH第1课时水的电离课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第2节水的电离和溶液的pH第2课时溶液的酸碱性与pH课件新人教版选择性必修1 课件 0 次下载
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教学课件ppt
展开
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教学课件ppt,共37页。PPT课件主要包含了电解质和非电解质,阳离子,电解质分子,电离成离子,的速率,3电离平衡的特征,向右移动,向左移动,电离成自由移动,离子浓度等内容,欢迎下载使用。
1.结合真实情境中的应用实例,认识电解质在水溶液中存在电离平衡。2.能用化学用语正确表示水溶液中的电离平衡。3.能通过实验证明水溶液中存在的电离平衡。1.能从宏观物质类别判断电解质的强弱,培养宏观辨识与微观探析能力。2.认识弱电解质的电离有一定限度,是可以调控的,培养变化观念与平衡思想。3.建立电离平衡的认知模型,培养证据推理与模型认知的能力。
一、强电解质和弱电解质
2.强电解质与弱电解质的比较
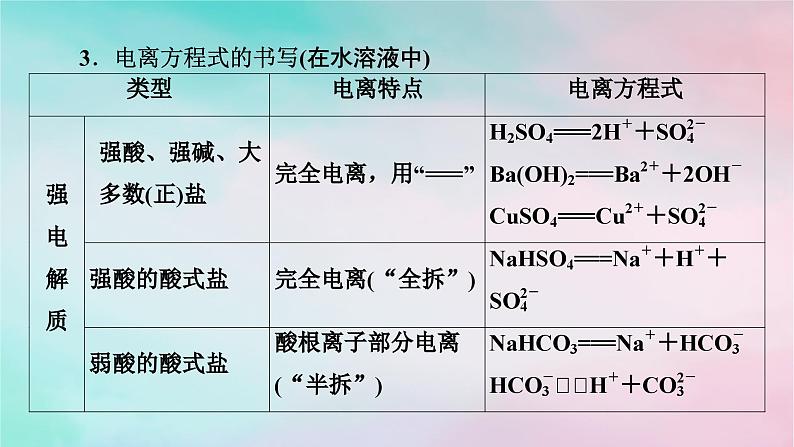
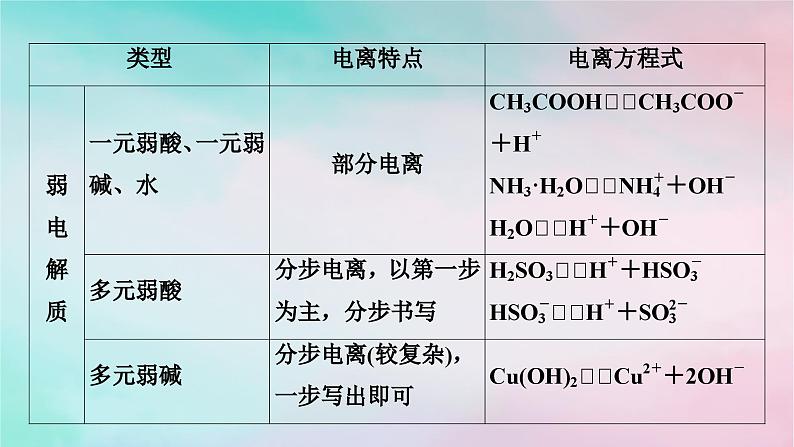
3.电离方程式的书写(在水溶液中)
注意 一元弱酸H3BO3(硼酸)的电离方程式为H3BO3+H2O[B(OH)4]-+H+。记忆口诀 强等号,弱可逆,多元弱酸分步写,多元弱碱一步写。
正|误|判|断(1)盐酸能导电,所以盐酸是电解质。( )(2)干冰、葡萄糖和金刚石都不导电,它们都是非电解质。( )(3)NH3溶于水能导电,所以NH3是电解质。( )(4)强电解质在溶液中不存在溶质分子,而弱电解质在溶液中存在溶质分子。( )(5)BaSO4难溶于水,其水溶液导电性很差,所以BaSO4是弱电解质。( )(6)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强。( )(7)强电解质都是离子化合物,弱电解质都是共价化合物。( )
深|度|思|考1.BaCO3难溶于水,所以属于弱电解质。该说法对吗?提示:不对;尽管BaCO3在水中的溶解度很小,但溶于水的部分能够全部电离,所以BaCO3属于强电解质。2.强、弱电解质的本质区别是什么?提示:强、弱电解质的本质区别是在水中的电离程度不同,强电解质全部电离,弱电解质部分电离且在水溶液中存在电离平衡。
3.强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱吗?溶液的导电能力取决于什么?提示:不一定。溶液的导电能力取决于溶液中自由移动离子的浓度和所带电荷数,溶液中自由移动离子的浓度越大,所带电荷越多,则导电能力越强。而电解质的强弱是指电解质在水溶液中的电离情况,二者无必然关系,即强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
应|用|体|验1.下列物质的分类组合全部正确的是( ) 解析:A项,HCl为强电解质;C项,BaCO3为强电解质,Cu既不是电解质也不是非电解质;D项,NaOH为强电解质。
2.在水溶液中,下列物质的电离方程式书写正确的是( )解析:HF、NH3·H2O属于弱电解质,不完全电离,故D项正确,B项错误;H2SO3为二元弱酸,应分步电离,故C项错误;NaHCO3的电离方程式NaHCO3===Na++HCO,故A项错误。
(1)CO2、SO2、NH3等物质溶于水能导电,是因为溶于水后生成H2CO3、H2SO3,NH3·H2O等电解质导电,不是其本身电离出离子,故为非电解质。单质、溶液既不是电解质,也不是非电解质。(2)电解质的强、弱与其溶解性无关。难溶盐如BaSO4、CaCO3等,溶于水的部分能完全电离,是强电解质。易溶的如CH3COOH、NH3·H2O等在溶液中电离程度较小,是弱电解质。
1.电离平衡状态(1)建立过程
二、弱电解质的电离平衡
(2)概念:在一定条件(如温度、浓度)下,弱电解质分子___________ ______与_______________________________相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
离子结合成弱电解质分子的速率
2.外界条件对弱电解质的电离平衡的影响(1)温度:弱电解质的电离一般是_______过程,升高温度,使电离平衡向_______的方向移动,电离程度_______。(口诀:越热越电离)(2)浓度:在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率_______,电离程度_______。(口诀:越稀越电离)(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度_______。(4)化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向_______的方向移动,电离程度增大。
【思考】分析改变下列条件对醋酸电离平衡的影响,填写下表:
3.电解质溶液的导电性(1)电解质溶液的导电原理电解质在溶液中_________________的阴、阳离子,在电源(电场)的作用下沿某一方向_______移动,形成电流。注意 金属导电是因为其含有自由移动的电子。
(2)影响电解质溶液导电能力的因素电解质溶液的导电能力与溶液中__________及离子所带__________有关,离子_______越大,离子所带电荷越多,导电能力_______。
正|误|判|断(1)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。( )(2)电离平衡向右移动,弱电解质的电离程度一定增大。( )(3)导电能力强的溶液里自由移动的离子数目一定比导电能力弱的溶液里自由移动的离子数目多。( )(4)盐酸的导电能力一定比醋酸溶液的强。( )
(5)随着温度的升高,弱电解质溶液和金属的导电能力均增强。( )(6)向醋酸溶液中滴加等浓度NaOH溶液,混合溶液的导电能力不变。( )(7)向H2S溶液中通入Cl2直至过量,混合溶液的导电能力增强。( )
深|度|思|考用1 ml·L-1醋酸进行导电性实验,发现灯泡亮度很低;用1 ml· L-1氨水进行导电性实验,发现灯泡亮度同样很低;但若将两种溶液等体积混合后进行导电性实验,灯泡亮度却显著增加。请分析其中的原因。提示:醋酸和NH3·H2O都是弱电解质,在水溶液中均不能完全电离,溶液中的离子浓度较小,导电能力较差,故灯泡均较暗;醋酸与氨水反应生成的醋酸铵为强电解质,完全电离成阴、阳离子,溶液中的离子浓度增大,所以导电能力增强,灯泡变得较亮,发生反应的离子方程
应|用|体|验A.加入少量浓盐酸,平衡逆向移动B.加入少量NaOH固体,平衡正向移动C.加入少量0.1 ml·L-1NH4Cl溶液,溶液中c(OH-)减小D.加入少量MgSO4固体,溶液pH增大
A.滴加新制氯水,平衡向左移动,溶液pH减小B.加水,平衡向右移动,溶液中氢离子浓度增大C.通入过量SO2气体,平衡向左移动,溶液pH增大D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小
归纳总结:外界条件对电离平衡影响的四个不一定(1)加水稀释时,溶液中不一定所有的离子浓度都减小。例如,稀醋酸加水稀释时,溶液中的c(H+)减小,c(OH-)增大。
(3)电离平衡右移,离子的浓度不一定增大。例如,在CH3COOH溶液中加水稀释或加少量NaOH固体,都会引起平衡右移,但c(H+)都比原平衡时要小。(4)电离平衡右移,电离程度不一定增大。例如,增大弱电解质的浓度,电离平衡向右移动,弱电解质的电离程度减小。
1.(2021·浙江6月选考,2)下列物质属于弱电解质的是( )A.CO2 B.H2OC.HNO3 D.NaOH
2.下列电离方程式中正确的是( )
3.将1 ml冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项中表明已达到电离平衡状态的是( )A.醋酸的浓度达到1 ml·L-1B.H+的浓度达到0.5 ml·L-1C.醋酸分子的浓度、醋酸根离子的浓度、 H+的浓度均为0.5 ml·L-1D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等
解析:在未电离时c(CH3COOH)=1 ml·L-1,当醋酸、H+、CH3COO-的浓度不再变化时(但此时三者的浓度不一定是0.5 ml· L-1),醋酸的电离达到平衡状态。依据平衡状态的第一个标志即分子电离成离子的速率与离子结合成分子的速率相等可知,此时溶液达到电离平衡状态。
(1)加入少量纯醋酸,平衡将_________________,溶液中c(H+)将_______(填“增大”“减小”或“不变”)。(2)加入一定量蒸馏水,平衡将_________________,溶液中c(H+)将_______(填“增大”“减小”或“不变”)。
相关课件
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH评课ppt课件,共28页。PPT课件主要包含了水的电离,电解质,H2O,水的离子积,Kw的应用,酸碱性,×10-12,-10,随堂演练·知识落实等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡说课ppt课件,共51页。PPT课件主要包含了电离平衡常数,各种离子浓度的乘积,未电离分子的浓度,电离常数只与温度,75×10-5,电离程度,强酸与弱酸的比较,随堂演练·知识落实等内容,欢迎下载使用。
这是一份化学选择性必修1第一节 电离平衡获奖课件ppt,文件包含高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数PPT课件+pptx、高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数教师版docx、高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数学生版docx等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。









