





所属成套资源:2025版新教材高中化学新人教版选择性必修1课件(46份)
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第2节水的电离和溶液的pH第2课时溶液的酸碱性与pH课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第2节水的电离和溶液的pH第3课时pH的计算课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第3节盐类的水解第1课时盐类的水解课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第3节盐类的水解第2课时影响盐类水解的主要因素及盐的水解常数的应用课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第3节盐类的水解第3课时盐类水解的应用及广义水解课件新人教版选择性必修1 课件 0 次下载
人教版 (2019)选择性必修1第二节 水的电离和溶液的pH说课课件ppt
展开
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH说课课件ppt,共46页。PPT课件主要包含了酸碱中和滴定实验,已知浓度的酸或碱,未知浓度的碱或酸,甲基橙,浅红色,不恢复,平均值,减小滴定误差,56%,中和滴定误差分析等内容,欢迎下载使用。
1.通过实验探究,掌握酸碱中和滴定的原理。2.结合真实情境中的应用实例,掌握酸碱中和滴定的操作方法和误差分析。3.结合真实情境中的应用实例,了解酸碱中和滴定在生产、生活中的应用。1.通过酸碱中和滴定原理的理解、指示剂选择等,形成滴定原理的认知模型,并根据模型应用到其他滴定(如氧化还原反应滴定、沉淀滴定)中去。2.能根据教材中的酸碱中和滴定实验,完成实验操作,观察现象,客观地进行记录、收集实验证据,培养科学探究与创新意识。
1.原理(1)含义:酸碱中和滴定是依据_____反应,用___________________ 来测定_______________________的方法。(2)原理中和反应中酸提供的H+与碱提供的OH-的物质的量相等。即 c(H+)·V酸=c(OH-)·V碱,
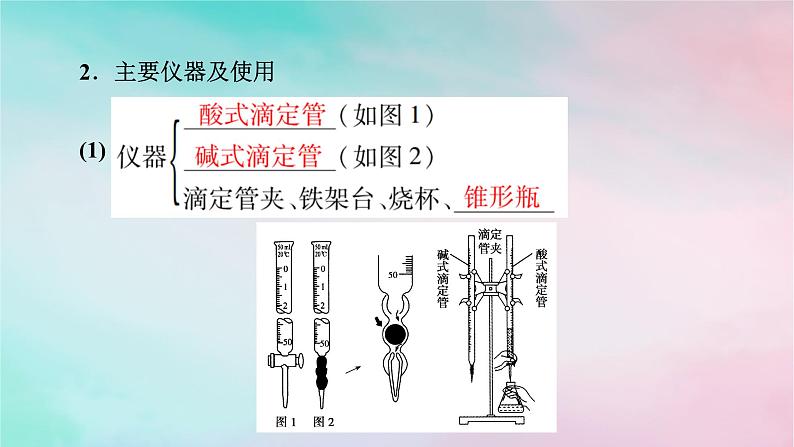
2.主要仪器及使用(1)
(2)滴定管的结构及使用方法。
注意事项 a.将液面在0mL处的25mL的酸式滴定管中的液体全部放出,液体的体积大于25 mL,因为尖嘴部分无刻度。b.使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
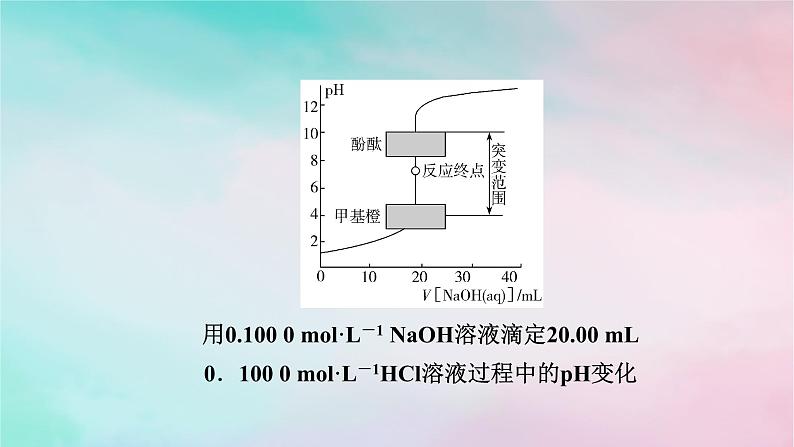
3.主要试剂(1)待测液;(2)标准液;(3)指示剂。4.指示剂的选择(1)原理由曲线可以看出,在酸、碱中和滴定过程中,在接近滴定终点时溶液的pH有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
用0.100 0 ml·L-1 NaOH溶液滴定20.00 mL0.100 0 ml·L-1HCl溶液过程中的pH变化
(2)指示剂的选择若滴定终点为碱性时,选择_______;酸性时,选择_________;中性时,酚酞、甲基橙均可以。一般不选择石蕊,变色现象不明显。(3)常用酸碱指示剂及变色范围
5.滴定操作(1)滴定前准备
(2)滴定注意 滴速:先快后慢,接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。(3)终点判断等到滴入最后半滴标准液,指示剂变色,且在半分钟内_________原来的颜色,视为滴定终点并记录此时滴定管的读数。
6.数据处理为减少实验误差,重复实验2~3次,根据每次所用标准溶液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的_________。
正|误|判|断(1)一支标有“20 ℃、25 mL”字样的滴定管内装液体到刻度1.00 mL时,管内液体的体积大于24.00 mL。( )(2)用50 mL酸式滴定管可准确量取25.00 mL KMnO4溶液。( )(3)“中和滴定”实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用。( )(4)当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数。( )(5)量取20.00 mL待测液时可用量筒量取。( )(6)滴定管盛标准溶液时,调液面一定要调到“0”刻度。( )
深|度|思|考1.酸碱恰好完全反应的点与滴定终点是否相同?提示:不相同。酸碱恰好完全反应是指酸与碱按照化学计量数恰好完全反应,酸和碱都不剩余,此时溶液可能为中性,也可能为酸性或碱性;而滴定终点是指指示剂颜色恰好变化的点,二者不相同。酸碱恰好完全反应的点与滴定终点特别接近,在一般科学研究中不会造成大的误差。
2.在酸碱中和滴定实验中,标准液的浓度是越大越好还是越小越好?提示:标准液的浓度一般以0.100 0 ml·L-1为宜。浓度太大,易引起较大误差;浓度太小,所需标准液体积太大,不易操作。3.用盐酸滴定氨水(氯化铵溶液显酸性),选什么作指示剂?怎样描述滴定终点?提示:可选择甲基橙作指示剂。滴入半滴标准盐酸时,溶液由黄色变为橙色,且半分钟内颜色不再变化,则达到滴定终点。
应|用|体|验1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图示仪器,从下表中选出正确选项( )
解析:甲为酸式滴定管,乙为碱式滴定管。酸性溶液、强氧化性溶液(如KMnO4溶液)一般装在酸式滴定管中,碱性溶液一般装在碱式滴定管中。指示剂的选择一般情况下,强碱滴定强酸用酚酞作指示剂,强酸滴定强碱用甲基橙或酚酞作指示剂。当指示剂可以有多种选择时,选择的指示剂最好是到达滴定终点时由浅变深发生变化。中和滴定时,一般情况下是把已知物质的量浓度的标准溶液滴入待测的未知浓度的溶液中,但把未知物质的量浓度的溶液滴入已知物质的量浓度的溶液中,只要操作正确,也可以求得待测溶液浓度。
2.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在_____(填字母)称量。A.小烧杯中B.洁净纸片上C.托盘上
(2)滴定时,用0.2000ml·L-1的盐酸来滴定待测溶液,不可选用_____(填字母)作指示剂。A.甲基橙 B.石蕊C.酚酞 D.甲基红(3)滴定过程中,眼睛应注视_________________________;在铁架台上垫一张白纸,其目的是___________________________________ ________________。(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________ml·L-1,烧碱样品的纯度是_________。
锥形瓶内溶液颜色的变化
便于观察锥形瓶内液体颜色的变化,
解析:(1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中。(2)酸碱中和滴定时,一般应选甲基橙、酚酞、甲基红等颜色变化较明显的指示剂,石蕊在酸或碱溶液中颜色变化不明显,易造成误差。(3)为准确判断滴定终点,眼睛应注视锥形瓶内溶液颜色变化,且在铁架台上垫一张白纸。
[特别提醒]滴定终点的判断答题模板
1.分析依据c待测、V待测均为代入定值,误差均体现在_________的大小。
2.常见的误差分析(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
(2)在进行误差分析时,要特别注意弄懂俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。
下列图示读数对滴定结果的影响如下:①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
正|误|判|断(1)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL。( )(2)中和滴定实验时,滴定管、锥形瓶均用待盛液润洗。( )(3)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁。( )(4)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸
相关课件
这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH示范课ppt课件,共26页。PPT课件主要包含了×10-7,×10-13,-lgcH+,④②①③,溶液酸碱性的判断,甲基橙,利用pH试纸测定,酸度计,~14,不正确等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH评课ppt课件,共28页。PPT课件主要包含了水的电离,电解质,H2O,水的离子积,Kw的应用,酸碱性,×10-12,-10,随堂演练·知识落实等内容,欢迎下载使用。
这是一份2025版高考化学一轮总复习第8章水溶液中的离子反应与平衡第28讲水的电离和溶液的pH酸碱中和滴定及拓展应用课件,共60页。PPT课件主要包含了考点1水的电离,水的电离,水的离子积常数,BCA=D=E,×10-9,-lgcH+,表面皿,玻璃棒,标准比色卡,ncmol·L-1等内容,欢迎下载使用。










