



所属成套资源:2025版新教材高中化学新人教版选择性必修1课件(46份)
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡第4节沉淀溶解平衡第2课时沉淀溶解平衡的应用与Ksp的计算课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡实验活动3盐类水解的应用课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡微专题5电解质溶液中微粒间的关系课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡微专题6溶液中粒子浓度图像分析课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第3章水溶液中的离子反应与平衡研究与实践3了解水处理过程中的化学原理课件新人教版选择性必修1 课件 0 次下载
2025版新教材高中化学第3章水溶液中的离子反应与平衡微专题4酸碱中和滴定曲线氧化还原滴定法课件新人教版选择性必修1
展开
这是一份2025版新教材高中化学第3章水溶液中的离子反应与平衡微专题4酸碱中和滴定曲线氧化还原滴定法课件新人教版选择性必修1,共38页。
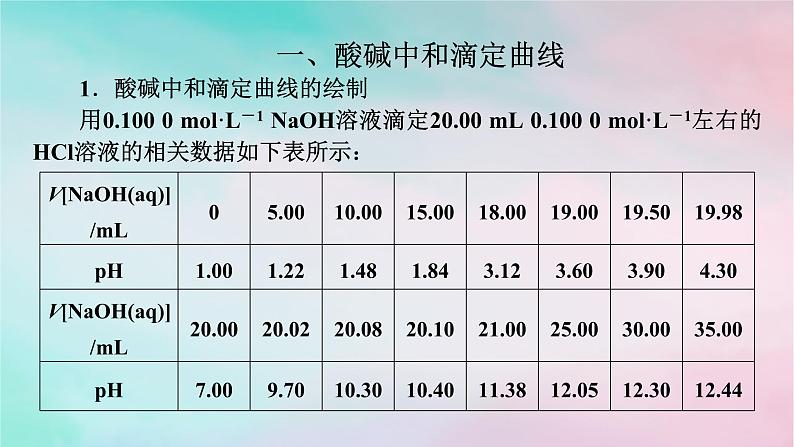
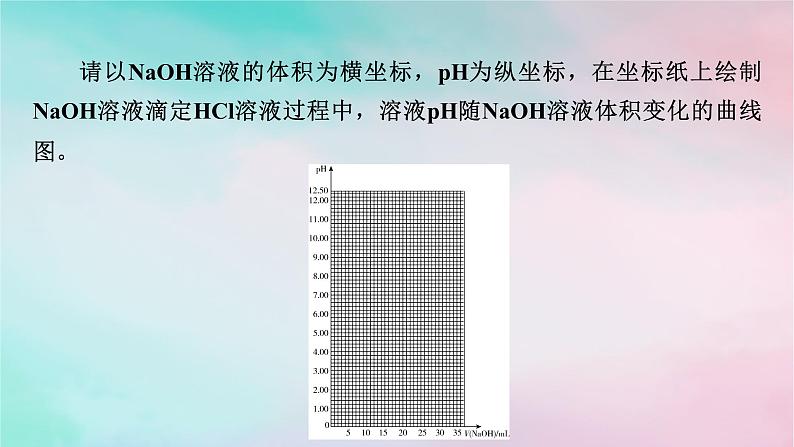
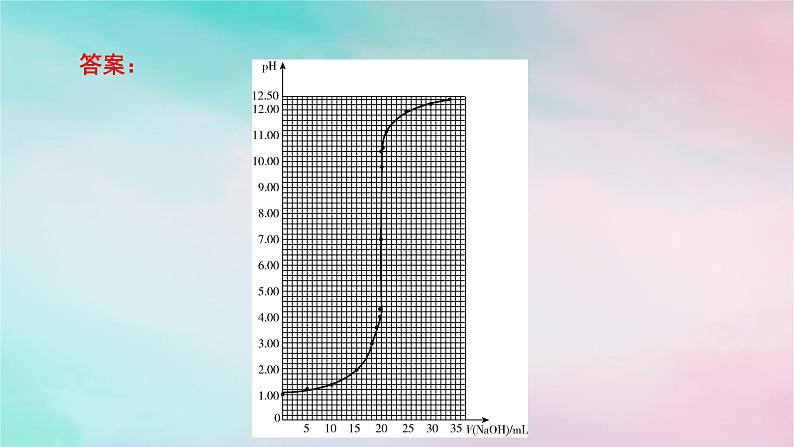
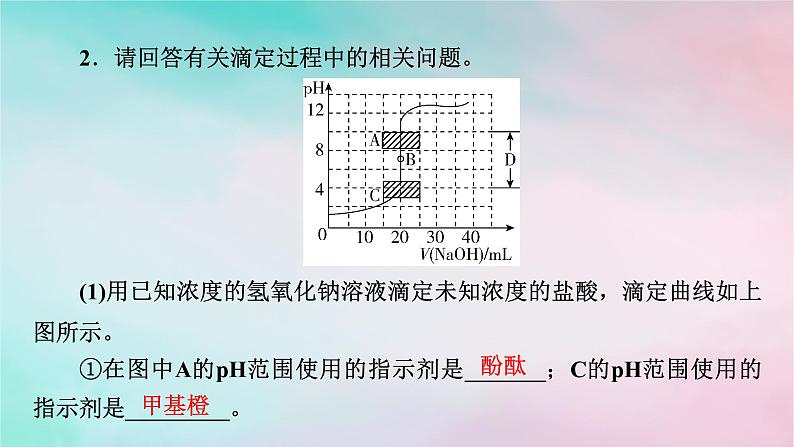
微专题4 酸碱中和滴定曲线 氧化还原滴定法一、酸碱中和滴定曲线1.酸碱中和滴定曲线的绘制用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1左右的HCl溶液的相关数据如下表所示:请以NaOH溶液的体积为横坐标,pH为纵坐标,在坐标纸上绘制NaOH溶液滴定HCl溶液过程中,溶液pH随NaOH溶液体积变化的曲线图。答案:(1)由滴定曲线分析,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有何变化?_________________(2)滴定曲线对中和滴定操作有何启示?_______________________________________________________________________________________________________________________pH发生突变。在pH发生突变的范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,有利于确定滴定终点。2.分析酸碱中和滴定曲线首先看横、纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱;再找滴定终点和中性点,判断滴定终点的酸碱性,然后确定中性点(常温下pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。跟|踪|训|练1.如图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,根据图像所得结论正确的是( )A.原来盐酸的物质的量浓度为0.1 mol·L-1B.X的值为0.1C.原来盐酸的物质的量浓度为1 mol·L-1D.X的值为0.001A2.请回答有关滴定过程中的相关问题。(1)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如上图所示。①在图中A的pH范围使用的指示剂是_______;C的pH范围使用的指示剂是_________。酚酞甲基橙②下列关于上述中和滴定过程中的操作,正确的是_______(填字母)。A.用碱式滴定管量取已知浓度的烧碱溶液B.滴定管和锥形瓶都必须用待装液润洗C.滴定过程中始终注视锥形瓶中溶液颜色变化D.锥形瓶中的待测液可用量筒量取AC(2)如图表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是___。③解析:(1)①A中pH变化范围在8.2~10左右,指示剂为酚酞,C中pH变化范围在3.1~4.4左右,指示剂为甲基橙。②考查中和滴定基本常识,锥形瓶不能用待装液润洗,B错;为保证实验的准确性,待测液不能用量筒量取,D错。(2)浓度相同的3种一元酸,③的pH最小,说明酸性最强。3.某实验小组在常温下,用0.100 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的HCl溶液。已知:混合溶液的体积等于酸、碱体积相加。可根据图示计算滴定的突跃范围。(1)该HCl溶液的浓度为_________________。(2)若滴加20.02 mL NaOH溶液,所得溶液的pH≈9.7,试计算滴加19.98 mL NaOH溶液,所得溶液的pH=_________(保留一位小数)。0.100 mol·L-14.3解析:(1)20.00 mL 0.100 mol·L-1的NaOH溶液和20.00 mL HCl溶液恰好完全反应:NaOH+HCl===NaCl+H2O,则该HCl溶液的物质的量浓度等于NaOH溶液的物质的量浓度,为0.100 mol·L-1。(2)由于NaOH溶液和HCl溶液均为0.100 mol·L-1,氢氧化钠溶液中的氢氧根离子和等体积HCl溶液中的氢离子物质的量相等,若滴加19.98 mL NaOH溶液到20.00 mL HCl溶液中,则所得溶液含氯化钠和HCl,混合溶液中n(H+)=(20.00 mL-19.98 mL)×10-3 L·mL-1×0.100 mol·L-1,二、氧化还原滴定法滴定操作不仅适用于酸碱中和反应,还可应用于氧化还原反应的定量测定。1.原理以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。2.滴定方式及应用(3)间接滴定法:某些非氧化性物质,可以用间接滴定法进行测定。例如,测Ca2+含量时,先将Ca2+沉淀为CaC2O4,再用稀硫酸将所得沉淀溶解,用KMnO4标准液滴定溶液中的H2C2O4,间接求得Ca2+含量。3.指示剂氧化还原滴定的指示剂有三类:(1)氧化还原指示剂。(2)专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝。(3)自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。4.试剂常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。5.实例(1)酸性KMnO4溶液滴定H2C2O4溶液(2)Na2S2O3溶液滴定含碘溶液 6.计算依据依据化学方程式或离子方程式或关系式列比例式,或运用原子守恒、电荷守恒、得失电子守恒等列式进行计算。7.误差分析类比酸碱中和滴定处理。跟|踪|训|练(1)滴定达到终点的现象是____________________________________ ____________________________________________________。(2)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性KMnO4标准溶液的体积如表所示: 当滴入最后半滴标准液后,锥形瓶内溶液颜色恰好由无色变为浅紫红色,且30s内溶液不褪色计算试样中过氧化氢的浓度为________mol·L-1。(3)若滴定前尖嘴中有气泡,滴定后消失,则测定结果_______(填“偏高”“偏低”或“不变”)。0.1800偏高2.实验室有一瓶未知浓度的Na2S2O3溶液,通过下列实验测定其浓度。①取10.00 mL Na2S2O3溶液于锥形瓶中,滴入2~3滴指示剂。②取一滴定管,依次查漏,洗涤,用0.01 mol·L-1I2标准溶液润洗,然后注入该标准溶液,调整液面,记下读数。③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6。请回答下列问题:(1)步骤①加入的指示剂是___________。(2)步骤③达到滴定终点的判断:______________________________ _______________________________。淀粉溶液滴入最后半滴标准液时,溶液由无色变成蓝色,且半分钟内不褪色(3)已知实验数据如下表:则废水中的Na2S2O3的物质的量浓度为_______________。0.038mol·L-1(4)下列操作会导致测定结果偏高的是_______(填字母)。A.滴定管在装液前未用标准溶液润洗B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡D.达到滴定终点时,仰视读数AD3.实验室用标准KMnO4溶液滴定未知浓度的FeSO4溶液,下列说法或操作正确的是( )A.盛FeSO4溶液的锥形瓶滴定前用FeSO4溶液润洗2~3次B.选碱式滴定管量取标准KMnO4溶液,并用碘化钾淀粉溶液作指示剂C.滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低D.锥形瓶内溶液颜色变化由浅绿色变为紫红色,立即记下滴定管液面所在刻度C4.下列滴定实验中,指示剂的选择或滴定终点颜色变化有错误的是( )已知:2KMnO4+5K2SO3+3H2SO4===6K2SO4+2MnSO4+3H2O、I2+Na2S===2NaI+S↓D解析:氢氧化钠溶液滴定醋酸溶液,恰好中和时生成醋酸钠,溶液呈碱性,选择的指示剂是酚酞,终点颜色变化为无色→浅红色,A正确;盐酸滴定氨水,恰好中和时生成氯化铵,溶液呈酸性,选择的指示剂是甲基橙,终点颜色变化为黄色→橙色,B正确;亚硫酸钾被完全氧化后,过量的高锰酸钾使溶液显浅紫色,终点颜色变化为无色→浅紫色,C正确;用碘水滴定硫化钠溶液,开始时溶液为无色,硫化钠被完全氧化后,碘水过量,淀粉遇碘变蓝,可选择淀粉指示剂,滴定终点的颜色变化为无色→蓝色,D错误。DA.试样在甲中溶解,滴定管选乙B.选用淀粉作指示剂,当甲中溶液由蓝色变为无色时,即达到滴定终点C.丁图中,滴定前滴定管的读数为(a-0.50)mLD.对装有标准液的滴定管读数时,滴定前后读数方式如丁图所示,则测得的结果偏小解析:A项,甲中盛装的是含有I2的溶液,则滴定管中盛装的为Na2S2O3标准溶液,该溶液显碱性,应选用碱式滴定管(丙),不正确;B项,溶液变色且30 s内溶液不恢复原来的颜色,视为滴定终点,不正确;C项,滴定管“0”刻度在上端,故滴定前的读数为(a+0.50)mL,不正确;D项,滴定后俯视读数,将导致读数偏小,故测得的结果偏小,正确。6.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。某化学兴趣小组采用以下方法测定某绿矾样品的纯度。a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容配成待测液;b.量取25.00 mL待测液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。下列说法不正确的是( )A.a步骤中定容时,仰视会使所测绿矾晶体的浓度偏低B.滴定时盛放KMnO4溶液的仪器为酸式滴定管C.滴加最后半滴KMnO4溶液时,溶液变成浅紫红色,即为滴定终点D.上述样品中FeSO4·7H2O的质量分数约为97.5%C7.(2024·重庆高二调研)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱中和滴定和氧化还原滴定是常见的两种滴定方法:Ⅰ.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取25.00 mL双氧水至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高(1)滴定时,将高锰酸钾标准溶液注入_____(填“酸”或“碱”)式滴定管中。(2)滴定到达终点的现象是___________________________________ __________________________。Ⅱ.酸碱中和滴定:常温下,用0.100 0 mol·L-1NaOH溶液分别滴定20.00 mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:酸滴入最后半滴高锰酸钾溶液,溶液呈浅紫红色,且30秒内不褪色(1)滴定盐酸的曲线是图_____(填“1”或“2”)。(2)达到B、D状态时,反应消耗的NaOH溶液的体积a_____(填“>”“8.(2023·天津六校高二期末)Na2S2O3溶液可用于测定溶液中ClO2的含量,实验方案如下。步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+ I-+H+→I2+Cl-+H2O未配平)。(1)准确量取10.00 mL ClO2溶液的玻璃仪器是_____________。(2)确定滴定终点的现象为___________________________________ _____________________________________。(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为__________ mol·L-1(用含字母的代数式表示)。酸式滴定管滴加最后半滴Na2S2O3溶液时,溶液刚好由蓝色变为无色,且30s内不恢复原色解析:(1)ClO2溶液具有强氧化性,所以准确量取10.00 mL ClO2溶液的玻璃仪器是酸式滴定管。






