

所属成套资源:2024年同步备课高中化学苏教版必修第二册课件(26份)
高中化学苏教版 (2019)必修 第二册第三单元 化学能与电能的转化备课ppt课件
展开
这是一份高中化学苏教版 (2019)必修 第二册第三单元 化学能与电能的转化备课ppt课件,共28页。PPT课件主要包含了学习目标,相对活泼的一极,相对不活泼的一极,氧化反应,还原反应,钢铁的电化学腐蚀,4设计原电池,5保护金属设备等内容,欢迎下载使用。
1.了解原电池的概念与构成条件2.学会判断正负极3.学会判断电子流动方向3.学会书写电极方程式
思考1:电流形成的条件是什么?思考2:氧化还原反应的本质是什么?
电子的定向移动形成电流
电子发生转移(得失或偏移)
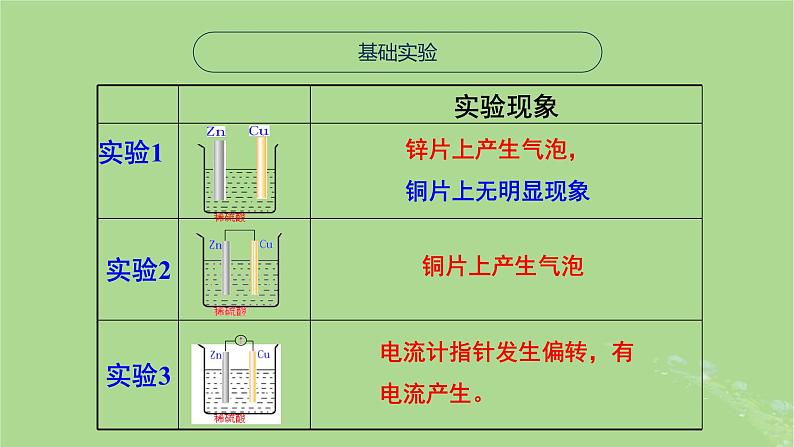
锌片上产生气泡,铜片上无明显现象
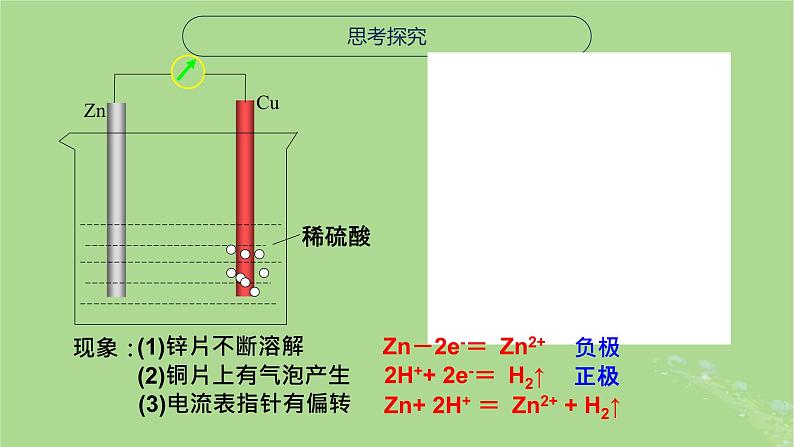
电流计指针发生偏转,有电流产生。
(3)电流表指针有偏转
(2)铜片上有气泡产生
Zn-2e-= Zn2+
2H++ 2e-= H2↑
Zn+ 2H+ = Zn2+ + H2↑
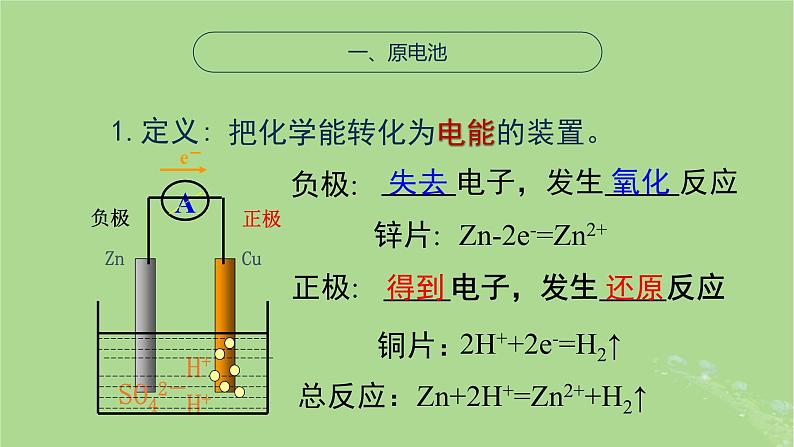
把化学能转化为电能的装置。
锌片:
电子,发生 反应
电子,发生 反应
总反应:Zn+2H+=Zn2++H2↑
Zn-2e-=Zn2+
2H++2e-=H2↑
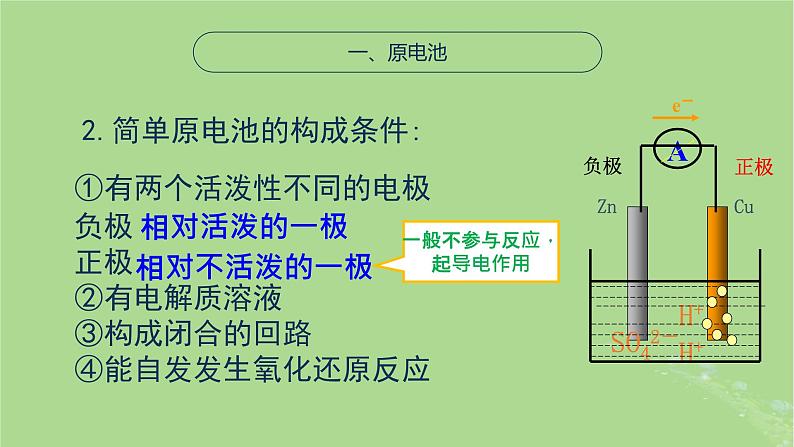
①有两个活泼性不同的电极负极正极②有电解质溶液③构成闭合的回路④能自发发生氧化还原反应
2.简单原电池的构成条件:
一般不参与反应,起导电作用
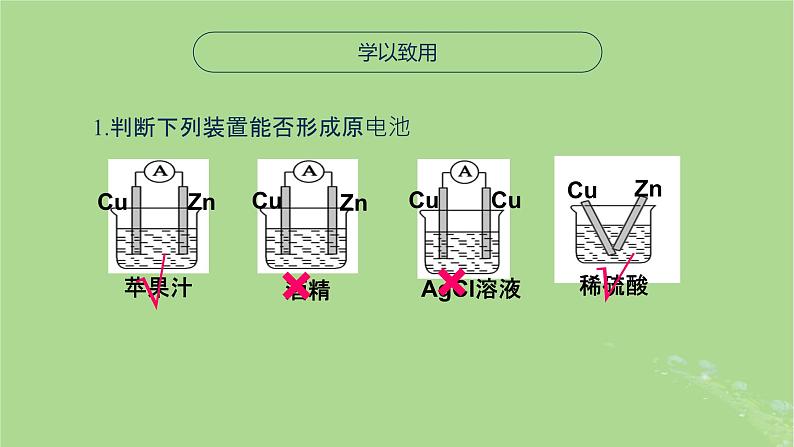
1.判断下列装置能否形成原电池
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
Zn - 2e- = Zn2+
2H+ + 2e- = H2
从负极(Zn) → 经外电路 → 正极(Cu)
从正极(Cu) → 经外电路 → 负极(Zn)
溶液中,阳离子→正极,阴离子→负极
1.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4 B、A是铜,B是锌,C为稀硫酸 C、A是铁,B是银,C为AgNO3溶液 D、A是Ag,B是铁,C为AgNO3溶液
2.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )A.A的金属性强于B B.A电极上发生的电极反应是还原反应C.电子不断由A电极经外电路流向B电极 D.A在金属性活动顺序表中一定排在氢前面
(1)确定正负极和在正负极上反应的物质
(4) 注意酸性介质或碱性介质
Fe极失电子 Ag极得电子
Fe-2e - = Fe2+
(2)确定得失电子的数目与生成微粒
(3)完全电离的物质以离子形式表示
(5)写总方程式时注意电子得失守恒
即: 负极与电解质溶液反应
Fe+2H+ = Fe 2+ +H2↑
2H++2e - = H2↑
H2SO4 (aq)
对于比较复杂的反应,可以根据总方程式来写电极反应:
根据化合价升降判断正负极
2.请写出右边原电池的电极方程式。
Mg - 2e- = Mg2+
Mg + 2H+=Mg2++ H2↑
2H+ +2e- =H2↑
Zn-2e - = Zn2+
Zn + Cu2+ = Zn2 ++ Cu
Cu2+ +2e - = Cu
Cu - 2e- = Cu2+ Fe3+ + e- = Fe2+
2 2 2
Cu + 2Fe3+ = Cu2+ + 2Fe2+
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
Al - 3e- = Al3+
Al +4OH- -3e- =AlO2- + 2H2O
6H2O +6e- =6OH—+ 3H2↑
1.写出下列原电池的电极反应和总反应(属于离子反应的,用离子方程式表示)。(1)负极:________;正极:_________;总反应式:_________。(2)负极:________;正极:_________;总反应式:_________。(3)负极:________;正极:_________;总反应式:_________。
负极(Fe): Fe - 2e- = Fe2+
正极(C): 2H+ + 2e- = H2↑
总反应式: Fe+ 2H+ = Fe2+ + H2↑
(2)加快氧化还原反应速度
负极:活泼性较强正极:活泼性较弱
实验室用Zn与稀硫酸反应制H2时 a.用粗Zn代替纯Zn b.向稀硫酸中滴加CuSO4溶液
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
实验室制氢气,用纯锌还是粗锌(含碳)好?
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极; c、d相连时,电流由d到c; a、c相连时,c极上产生大量气泡; b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( ) A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
(3)解释生活中的现象
(1)潮湿的空气里钢铁容易生锈
原理:负极反应: ;正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
Fe和少量的C与表面的水膜形成无数的微小原电池
Fe(负极):2Fe-4e--=2Fe2+ C(正极):O2+4e-+2H2O=4OH-
溶液中: Fe2++2OH- =Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁锈(Fe2O3·xH2O)
1.(吸氧腐蚀)——水膜呈碱性、弱酸性或中性
2.(析氢腐蚀)——水膜酸性较强
Fe(负极):Fe-2e-=Fe2+ C(正极):2H++2e-=H2↑
1.电化学腐蚀概念 不纯的金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
主要成分:铁粉、碳、食盐、水、吸水布(吸水棉)
使用方法:撕开后进入空气(提供氧气,供吸氧腐蚀用)
原理:负极反应: 正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3在此反应过程中放热,因此成为“暖宝宝”“热敷袋”
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(即电解质溶液中的阳离子)在正极上被还原。(2)选择合适的材料①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。②电解质溶液:电解质溶液一般能与负极反应。
(被保护金属作正极)
思考:通常在轮船的尾部和在船壳的水线以下部分,装有一定数量的锌块,请解释原 因。
原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。
相关课件
这是一份高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第二单元 化学能与电能的转化教学演示ppt课件,共17页。PPT课件主要包含了e-→等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第二册第三单元 化学能与电能的转化备课ppt课件,共27页。PPT课件主要包含了学习目标,锌片上有气泡,铜片上无气泡,不反应,锌片上无气泡,铜片上有气泡,电流表指针偏转,化学能,原电池,原理分析等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第二册专题6 化学反应与能量变化第三单元 化学能与电能的转化课文配套课件ppt,文件包含631化学能转化为电能分层练习-高一化学同步精品课堂苏教版必修第二册原卷版docx、631化学能转化为电能分层练习-高一化学同步精品课堂苏教版必修第二册解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。









