






所属成套资源:2024年同步备课高中化学新人教版必修第一册课件(23份)
高中化学人教版 (2019)必修 第一册第三节 物质的量备课课件ppt
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量备课课件ppt,共39页。PPT课件主要包含了学以致用,总结归纳,思考与交流,cHCl=,易错警示,归纳总结,记住啦,365%,溶液的稀释规律,稀释公式等内容,欢迎下载使用。
【学习目标】1.了解物质的量浓度的含义。2.掌握物质的量浓度的有关计算。
一定温度下、一定溶剂中,不能再 某物质的溶液
特征: 性和 .
组成: 和 .
在生产及科学实验中,我们经常要用到溶液
:指在一定温度和压强下,在1体积的水(溶剂)达到饱和状态时所溶解气体的体积。
4).常见气体的溶解度(常温常压):极易溶:NH3(1:700) HCl(1:500) 能 溶:CO2(1:1)、 Cl2(1:2)难 溶:H2 O2 CO等
在一定温度下, 里,形成饱和溶液,某固体物质所能溶解溶质的最大质量(g).
2)符号:用 表示,其单位是 .
一般随温度升高而减小,随压强增大而增大
3. 溶液浓度的表示方法
溶液浓度的表示方式有很多┄┄
一定条件下的溶液中 的质量与 的质量的比值.
2)表达式: .
例如,100g 40%的NaOH(aq)
:表示某种物质的水溶液
:表示100gNaOH(aq)中含40gNaOH
问 题:让你去量取100mlNaOH(aq)或称100gNaOH(aq),你更乐意做“前者”还是“后者”?
→对于溶液,量取体积要比称量质量更易操作。
用质量分数ω表示溶液浓度有它的缺陷:
①对于溶液,称量质量要比量取体积操作上更麻烦。
②两溶液混合,溶质间发生反应,往往需要知道溶质间量的关系。物质的量的关系比质量关系简单得多
2NaOH + H2SO4 = Na2SO4 +2H2O
因此,为了方便计算和量取,我们需要快速知道,量取一定体积的溶液中含多少摩的溶质,
这就是我们要学习的另一种浓度的表示方法——物质的量浓度。
即要知道, 1 L溶液中所含溶质的物质的量,
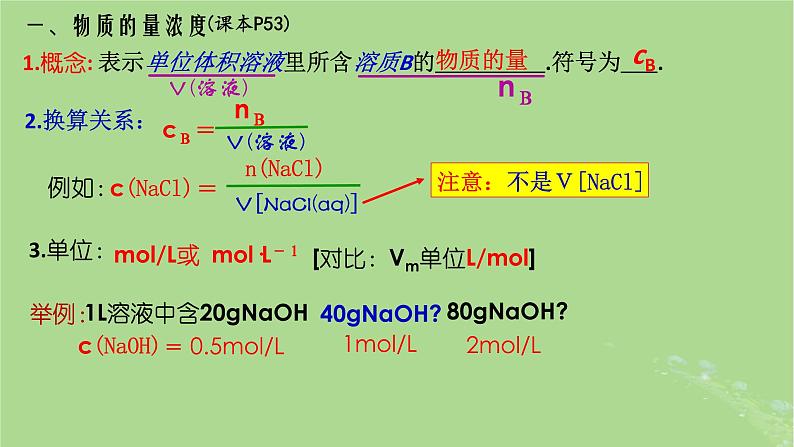
表示单位体积溶液里所含溶质B的 .符号为 .
注意:不是V[NaCl]
ml/L或 ml·L-1
[对比:Vm单位L/ml]
1L溶液中含20gNaOH
(2)取40gNaOH(s)溶于1L水配成溶液,则c(NaOH)=1ml/L;
(3)现有1ml/L的NaOH溶液2L,从中取出1L, 则取出的NaOH溶液浓度为0.5ml/L
(1)将1gNaCl溶于水制成1L溶液 ,则c(NaCl)=1ml/L
溶质用物质的量表示,不是用质量表示。
注:“1L”指“溶液的体积”
也不是溶剂 + 溶质的体积
(特别注意气体溶于水的情况)
溶液的浓度与取用的体积无关!
不同物质,尤其是不同状态的物质,体积不具加和性
例1 将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。
n(Na2CO3)=
追问:此题中, c(Na+)= ?
c(CO32-)= ?
规 律:同一溶液中,各粒子浓度之比等于其物质的量之比
1.溶质B可以指溶于溶剂中物质,也可以是其电离出来的离子。
2.同一溶液中,各粒子浓度之比等于其物质的量之比
0.2ml/LH2SO4溶液中 c(H+)= , c(SO42-)=_____;
3 ml/LAlCl3溶液中,c(Al3+)= , c(Cl-)= 。
1 ml/L Al2(SO4)3溶液中,c(Al3+)= , c(SO42-)= 。
1. 关于1 ml·L-1 K2SO4溶液的下列说法正确的是( )A.溶液中含有1 ml K2SO4B.1 ml K2SO4溶于1 L水中C.溶液中c(K+)=2 ml·L-1D.1 L溶液中含2 ml K+,2 ml SO42-
2. 下列各溶液中, c(Na+)最大的是( )A.4L 0.5 ml/L NaCl溶液B.1L 0.3 ml/L Na2SO4溶液C.0.8L 0.4 ml/L NaOH溶液D.2L 0.15 ml/L Na3PO4溶液
各溶液中 c(Na+)与取用的体积无关
1) 1 ml NaCl和1 ml AlCl3溶解在水中,配成1 L溶液,溶质的物质的量浓度是2 ml/L吗?
从物质的量浓度的概念可知,溶质只能是单一物质或微粒,而不能是混合的粒子,在计算其物质的量浓度时应分别计算。
硫酸和盐酸的混合液中:
c(HCl+H2SO4)
2) 上题中所得溶液中Cl-的浓度是多少?
单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
答案 溶液中Cl-的物质的量为4 ml,则c(Cl-)=4 ml/L。
1.用5mlNaOH配成500mL溶液,其浓度为 ml/L。
氨气溶于水形成氨水溶液,溶质指NH3
Na2O+H2O=2NaOH
3. 将0.1 mlNa2O溶于水并配成2 L溶液,其溶质的物质的量浓度为 ml/L 。
2.将标准状况下的NH322.4L溶于水中配成2L溶液,其物质的量浓度为 ml/L 。
4.要配制100 mL 0.100ml/LNa2CO3溶液需Na2CO3固体 克?
5.要配制 250 mL 1ml/LCuSO4溶液需胆矾 克?
进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式cB=nB / V(aq),要充分利用有关物质的量的各种计算公式,发挥物质的量的桥梁作用。
同一溶液中,各粒子浓度之比等于其物质的量之比
由:Al2(SO4)3~2Al3+~3SO42-
例题1.标况下,448 L HCl(g)溶于1L水中,得到稀盐酸溶液,求此溶液中c(HCl)为______ml/L ?
1LH2O + 448LHCl?
根据现有的数据,无法计算
ρ(溶液)=1.1 g/ml
m(H2O)+ m(HCl)
= 1000g+20ml×36.5g/ml
V[HCl(aq)]=
=12.71 ml/L
强调:计算时质量可以相加,体积往往不能相加!
(注意体积单位的换算)
1.在标准状况下,将V L A气体(摩尔质量为M g·ml-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(ml·L-1)为( )
①气体的物质的量: ml
②所得溶液的质量为 g
④再根据c= 计算.
2.已知:在标准状况下,1体积的水中能溶解700体积的氨气,所得氨水的密度为0.9g·cm-3。则此氨水的物质的量浓度为 ml·L-1
3.将标况下 V L NH3 溶于1L水中,所得溶液密度为ρ g/ml,则此氨水的物质的量浓度为 ml·L-1 ?
1.气体溶于水,溶质是该气体与水反应生成的物质。 NH3溶于水后虽然主要溶质是NH3·H2O,但以NH3计算。
2.气体溶于水,溶液的体积不是溶剂的体积更不是气体体积与溶剂体积之和,应根据V= 进行计算。
例2.市售的浓硫酸,其溶质的质量分数为98%,密度为1.84 g/mL,计算市售浓硫酸的物质的量浓度为 ml/L?
ω (H2SO4) = 98%
ρ(溶液)=1.84 g/ml
求: c (H2SO4)
已知量都是与取用多少无关的量
设取1L市售浓硫酸进行研究
n (H2SO4) =
cB与质量分数w的换算关系,可直接作为计算公式应用
已知某溶液的ω、ρ及溶质MB,求cB
2.已知浓盐酸的物质的量浓度为11.8ml/L,密度为1.18g/cm3, 求浓盐酸的质量分数?
1. 37%的盐酸,密度为1.19g/cm3,求其物质的量浓度?
3.物质A的相对分子质量为 M ,其室温下溶解度为 S g,此时,测得其饱和溶液的密度为ρ g/ml ,求c(A)
举例1:将100g 98% 浓硫酸稀释为49%,则需要加水 克?
原理:溶液在稀释前后,溶质的质量保持不变。
举例2:配制250ml 1ml/L HCl(aq),需要12ml/L HCl(aq) ml?
原理:溶液在稀释前后,溶质的物质的量保持不变。
c(浓)·V(浓)=c(稀)·V(稀)
m(浓)· ω(浓)=m(稀)· ω(稀)
① 将30ml 0.5ml·L-1的NaOH溶液加水稀释至500ml, 求稀释后溶液中NaOH的物质的量浓度?
0.03ml ·L-1
② 配制500mL1 ml/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%的硫酸)多少毫升?
0.5ml·L-1×30ml =c(稀)×500ml
实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。(1)此浓盐酸的物质的量浓度是______ml·L-1;(2)配制100.0 mL该浓盐酸,需要标准状况下HCl的体积为 ;(3)配制100.0 mL 3.00 ml·L-1的盐酸,需以上浓盐酸的体积为_______;(4)将10.0 mL 3.00 ml·L-1的盐酸与10.0 mL 1.00 ml·L-1的MgCl2溶液混合,则混合溶液中c(Cl-)是 。(设混合后溶液的体积不变)
2.50 ml·L-1
例1. 用100 mL 0.3 ml/L的NaOH溶液和300 mL 0.25 ml/L的H2SO4(aq)混合,混合液中c(H+)为( ) (混合时体积变化忽略不计)A.0.12 ml·L-1 B.0.24 ml·L-1C.0.30 ml·L-1 D.0.75 ml·L-1
2NaOH + H2SO4 = Na2SO4 +2H2O
例2、100mL 0.3ml·L-1 Na2SO4溶液和50mL 0.2ml·L-1的Al2(SO4)3 溶液混合后,溶液中SO42-离子的物质的量浓度为( )A、0.20ml·L-1 B、0.25ml·L-1 C、0.40ml·L-1 D、0.60ml·L-1
说明:混合后溶液的体积问题:
若题目中给出混合后溶液的密度,应根据 来计算。
若题目中指出忽略溶液体积变化,则原溶液的体积可相加
若题目中溶液都是很稀的溶液,可以忽略溶液体积变化,原溶液的体积直接相加
溶液中的电荷守恒关系:
∴溶液中,阳离子所带的正电荷总数 = 阴离子所带的负电荷总数
1ml Mg2+带 ml正电荷;
1个Na+带1个正电荷,
1ml Al3+带 ml正电荷;
1ml SO42-带 ml负电荷;
1ml Cl-带 ml负电荷;
则1ml Na+带1ml 正电荷
溶液中, 正电荷总数=负电荷总数
在NaCl、MgCl2、MgSO4形成的混合溶液中, c(Na+)= 0.10ml/L c(Mg2+)= 0.25ml/L c(Cl-)= 0.20ml/L,则c(SO42-)为( ) A.0.15 ml·L-1 B.0.10 ml·L-1 C.0.25 ml·L-1 D.0.20 ml·L-1
n(Na+) + 2n(Mg2+) === n(Cl-) + 2n(SO42-)
阳离子所带的正电荷总数
阴离子所带的负电荷总数
或者 c(Na+) + 2c(Mg2+) === c(Cl-) + 2c(SO42-)
溶液中阳离子有: 阴离子有: 。
1.把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a ml硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b ml硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( ) A. 0.1(b-2a) ml·L-1B. 10(2a-b) ml·L-1 C. 10(b-a) ml·L-1D. 10(b-2a) ml·L-1
迁移应用:电荷守恒法在物质的量浓度计算中的应用
根据题意,500 mL溶液分成5等份,每份为100 mL。
n(Ba2+)=a ml
n(Cl-)=b ml,
根据电荷守恒关系得:n(K+)=(b-2a)ml
2.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a ml NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b ml BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
注意混合液分成两等份,每份V/2 L
n(Mg2+)=a/2 ml
n(SO42-)=b ml
依据电荷守恒可知:n(K+)=2n(SO42-)-2n(Mg2+)=(2b-a)ml
定义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。单位:ml/L(或ml•L-1)公式:
nB=CB×V V=nB/CB
3)溶质B可以指溶于溶剂中物质,也可以是其电离出来的离子。
注意:1)溶液体积不等于溶剂体积。
2)同一溶液,溶质的物质的量浓度与所取溶液体积无关。
3)一定体积(标准状况下)的气体溶于水后所得溶液cB的计算
2) cB与质量分数w的换算:
此公式可按溶液体积为1 L进行推导.
②运用V(溶液)= ,求出溶液的体积;
③再根据c= 计算.
4.溶液稀释原理:稀释前后,溶质的物质的量保持不变。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教课ppt课件,共27页。PPT课件主要包含了新课引入,质量分数,体积分数,体检单,物质的量,物质的量浓度,符号cB,实验目的,实验设计,实验原理等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第三节 物质的量课堂教学课件ppt,共23页。PPT课件主要包含了物质的量浓度,符号cB,溶液混合的计算公式,课堂练习等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共27页。PPT课件主要包含了cB溶液,×Vaq,÷Vaq等内容,欢迎下载使用。










